2.2《分子的空间结构》(第1课时)课件(共28张PPT)
文档属性
| 名称 | 2.2《分子的空间结构》(第1课时)课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 06:54:39 | ||
图片预览






文档简介
(共28张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第1课时 分子的空间结构
选修二
原子结构与性质
核心素养
会判断一些典型分子的立体结构,认识分子结构的多样性和复杂性,理解价层电子对互斥模型。
通过对典型分子立体结构探究过程,学会运用观察、比较、分类及归纳等方法对信息进行加工,提高科学探究能力。
通过观察分子的立体结构,激发学习化学的兴趣,感受化学世界
的奇妙。
#0070C0
#00B0F0
一、分子结构的测定
早年科学家主要靠对物质的 进行系统总结得出规律后进行推测,现代科学家应用了许多测定分子结构的现代仪器和方法,如 、 等。
化学性质
红外光谱
晶体X射线衍射
#0070C0
#00B0F0
一、分子结构的测定
分子中的原子不是固定不动的,而是不断地振动着的。当一束红外线透过分子时,分子会吸收跟它的某些 的振动频率相同的红外线,再记录到图谱上呈现 。通过和已有 比对,或通过 计算,可以得知各吸收峰是由哪种 、哪种
方式引起的,综合这些信息,可分析分子中含有何种 或
化学键
吸收峰
谱图库
量子化学
化学键
振动
化学键
官能团
的信息。
1. 红外光谱在测定分子结构中的应用
#0070C0
#00B0F0
一、分子结构的测定
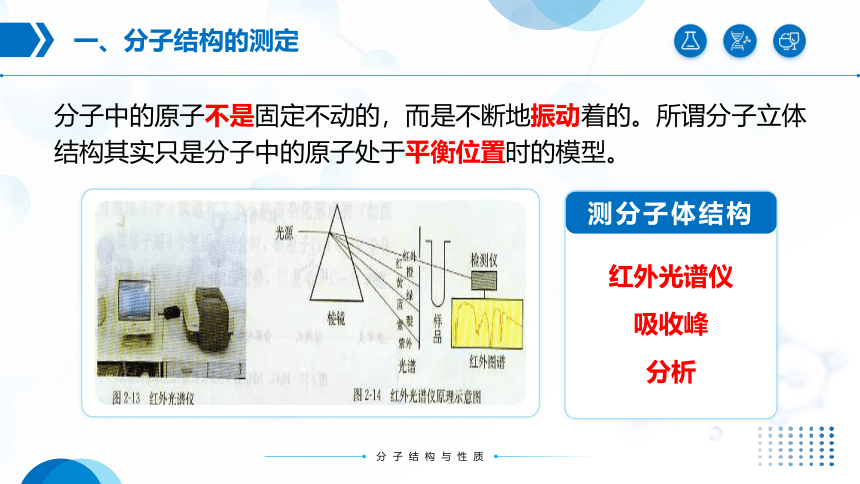
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
红外光谱仪
吸收峰
分析
测分子体结构
#0070C0
#00B0F0
一、分子结构的测定
现代化学常利用质谱仪测定分子的相对分子质量。它的基本原理是在质谱仪中使分子失去电子变成带 的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的相对分子质量。
2.质谱法在测定分子相对分子质量中的应用
正电荷
#0070C0
#00B0F0
练一练
可以准确判断有机物分子中含有哪些官能团的分析方法是( )
A. 核磁共振氢谱 B. 质谱
C. 红外光谱 D. 紫外光谱
解析 核磁共振氢谱能分析等效氢的种类 ,故A错误
质谱分析相对分子质量,故B错误
红外光谱判断有机物分子中官能团的种类,故C正确
只根据紫外光谱是不能完全确定物质的分子结构,故D错误
C
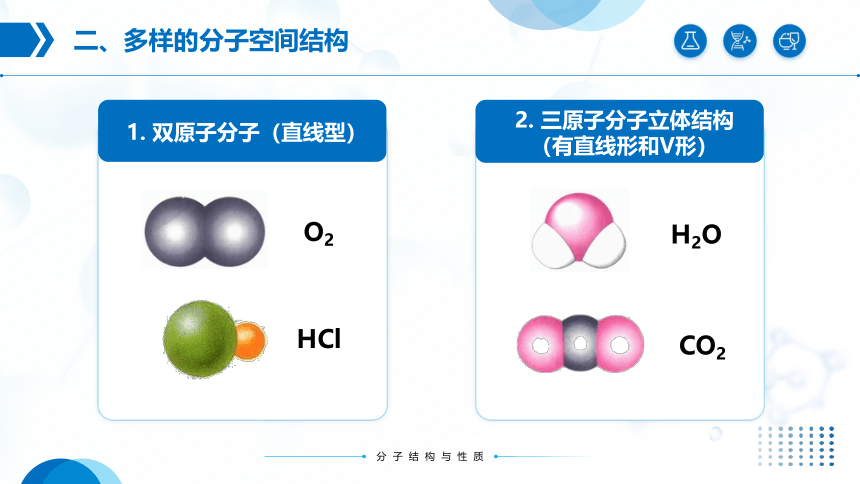
1. 双原子分子(直线型)
#0070C0
#00B0F0
二、多样的分子空间结构
O2
HCl
2. 三原子分子立体结构(有直线形和V形)
H2O
CO2
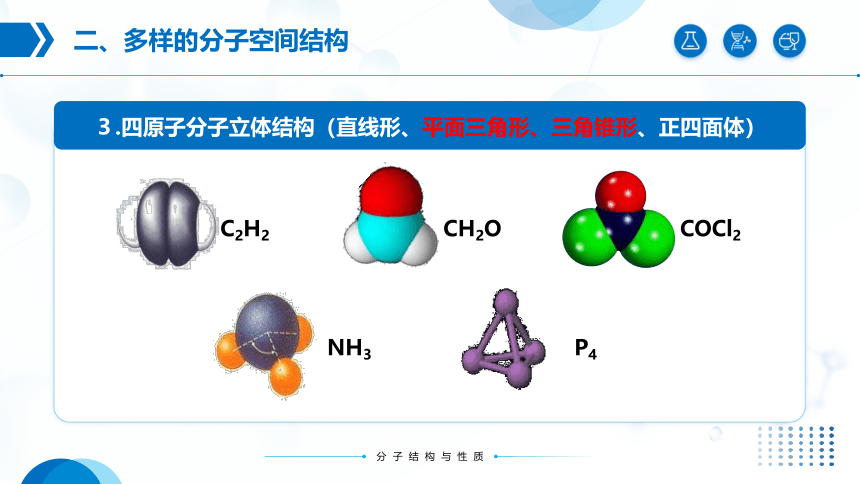
3.四原子分子立体结构(直线形、平面三角形、三角锥形、正四面体)
#0070C0
#00B0F0
二、多样的分子空间结构
C2H2
NH3
P4
CH2O
COCl2
4.五原子分子立体结构
#0070C0
#00B0F0
二、多样的分子空间结构
最常见的是正四面体
CH4
5. 其它
#0070C0
#00B0F0
二、多样的分子空间结构
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
P4O6
P4O10
椅式C6H12
船式C6H12
C10H16
S8
SF6
B12
#0070C0
#00B0F0
练一练
(1) 四原子分子一定都是平面三角形或三角锥形 ( )
(2) 正四面体形的键角均为109°28′ ( )
(3) SiCl4、SiH4、 、CH3Cl均为正四面体结构 ( )
(4) SF6分子的空间结构为正八面体形 ( )
×
×
×
√
判断正误
NH4
+
价层电子对互斥理论
#0070C0
#00B0F0
1940年Sidgwick提出价层电子对互斥理论,用以判断分子的立体构型。
分子 ABn中, A为中心,n为B 原子的个数。B均与A有键联关系。本节讨论的ABn型分子中,A为主族元素的原子。
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
对ABm型分子或离子,中心原子A价层电子对(包括成键电子对和孤对电子)之间存在排斥力,将使分子中的原子处于尽可能远的相对位置上,以使各原子之间斥力最小,分子体系能量最低。
1. 价层电子对互斥理论要点
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
2. 电子对数目与立体结构
(1)ABn型:中心原子(A)上的价电子都用于形成共价键
CO2
BF3
CH4
2
4
3
立体结构
直线形
平面三角形
正四面体形
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
分子 CO2 BF3 CH4
电子式
结构式
中心原子 有无孤对电子
空间结构
O C O
: :
: :
:
:
:
:
O=C=O
F – B - F
-
F
H- C -H
-
-
H
H
无
无
无
直线形
平面三角形
正四面体
:
:
:
H C H
:
H
H
F B F
:
:
:
F:
:
:
:
:
:
:
:
:
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
三、价层电子对互斥理论 VSEPR
(2)中心原子上有孤对电子 (未用于形成共价键的电子对) 的分子
ABn 立体结构 范例
n=2 V形 H2O
n=3 三角锥形 NH3
孤电子对、成键电子对之间排斥力大小比较:
孤-孤 > 孤- 成 > 成- 成
#0070C0
#00B0F0
三、价层电子对互斥理论 VSEPR
中心原子 代表物 中心原子 结合的原子数 分子类型 空间构型
无孤对电子 CO2 2 AB2
BF3 3 AB3
CH4 4 AB4
有孤对电子 H2O 2 AB2
NH3 3 AB3
直线形
平面三角形
正四面体
V 形
三角锥形
价层电子对互斥模型
还有2对孤对电子
还有1对孤对电子
原因
#0070C0
#00B0F0
中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H2O和NH3的中心原子分别有2对孤对电子和1对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
3. 价层电子对的计算
三、价层电子对互斥理论 VSEPR
(1) 中心原子价层电子对数=σ 键电子对数+孤电子对数。
(2) σ 键电子对数的计算
由化学式确定,即中心原子形成几个σ 键,就有几对σ 键电子对。如H2O分子中, O有 对σ 键电子对。NH3分子中, N有 对σ 键电子对。
2
3
#0070C0
#00B0F0
3. 价层电子对的计算
三、价层电子对互斥理论 VSEPR
(3)中心原子上的孤电子对数的计算
中心原子上的孤电子对数=
①a表示中心原子的价电子数;
对主族元素:a= ;
对于阳离子:a= ;
对于阴离子:a= 。
②x表示与 结合的原子数。
③b表示与中心原子结合的原子最多能接受的电子数,氢为1其他原子= 。
最外层电子数
价电子数-离子所带电荷数
价电子数+离子所带电荷数
中心原子
8-该原子的价电子数
(a-xb)
2
1
分子空间结构的确定思路
#0070C0
#00B0F0
归纳总结
中心原子价层电子对数n
分子的空间结构——略去孤电子对在价层电子对互斥模型中占有的空间
#0070C0
#00B0F0
课堂练习
1. 下列分子的空间结构模型正确的是( )
A. CO2的空间结构模型: B. H2O的空间结构模型:
C. NH3的空间结构模型: D. CH4的空间结构模型:
D
解析 CO2的空间结构为直线形,A不正确;
H2O的空间结构为V形,B不正确;
NH3的空间结构为三角锥形,C不正确;
CH4的空间结构为正四面体形,D正确。
#0070C0
#00B0F0
课堂练习
2. (1) 硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结构为______。
(2) 二硫化碳(CS2)分子中,两个C==S的夹角是180°,说明CS2分子的空间结构为_______。
解析 可由键角直接判断分子的空间结构。
V形
直线形
#0070C0
#00B0F0
课堂练习
(3)能说明CH4分子不是平面四边形,而是正四面体结构的是____(填字母)。
a. 两个键之间的夹角为109°28′
b. C—H为极性共价键
c. 4个C—H的键能、键长都相等
d. 二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
解析 五原子分子CH4可能有平面四边形和正四面体两种空间结构,不管为哪种,b、c两项都成立;若为前者,则键角为90°,CH2Cl2有两种:
和 ;若为后者,则键角为109°28′,CH2Cl2只有一种。
ad
#0070C0
#00B0F0
课堂练习
3. 若ABn型分子的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥模型,判断下列说法中正确的是( )
A.若n=2,则分子的空间结构为V形
B.若n=3,则分子的空间结构为三角锥形
C.若n=4,则分子的空间结构为正四面体形
D.以上说法都不正确
解析 若中心原子A上没有未用于形成共价键的孤电子对,则不存在σ键电子对与孤电子对之间的相互排斥。当n=2时,分子的空间结构为直线形;n=3时,分子的空间结构为平面三角形;n=4时,分子的空间结构为正四面体形。
C
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
第二章 分子结构与性质
第二节 分子的空间结构
第1课时 分子的空间结构
选修二
原子结构与性质
核心素养
会判断一些典型分子的立体结构,认识分子结构的多样性和复杂性,理解价层电子对互斥模型。
通过对典型分子立体结构探究过程,学会运用观察、比较、分类及归纳等方法对信息进行加工,提高科学探究能力。
通过观察分子的立体结构,激发学习化学的兴趣,感受化学世界
的奇妙。
#0070C0
#00B0F0
一、分子结构的测定
早年科学家主要靠对物质的 进行系统总结得出规律后进行推测,现代科学家应用了许多测定分子结构的现代仪器和方法,如 、 等。
化学性质
红外光谱
晶体X射线衍射
#0070C0
#00B0F0
一、分子结构的测定
分子中的原子不是固定不动的,而是不断地振动着的。当一束红外线透过分子时,分子会吸收跟它的某些 的振动频率相同的红外线,再记录到图谱上呈现 。通过和已有 比对,或通过 计算,可以得知各吸收峰是由哪种 、哪种
方式引起的,综合这些信息,可分析分子中含有何种 或
化学键
吸收峰
谱图库
量子化学
化学键
振动
化学键
官能团
的信息。
1. 红外光谱在测定分子结构中的应用
#0070C0
#00B0F0
一、分子结构的测定
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
红外光谱仪
吸收峰
分析
测分子体结构
#0070C0
#00B0F0
一、分子结构的测定
现代化学常利用质谱仪测定分子的相对分子质量。它的基本原理是在质谱仪中使分子失去电子变成带 的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的相对分子质量。
2.质谱法在测定分子相对分子质量中的应用
正电荷
#0070C0
#00B0F0
练一练
可以准确判断有机物分子中含有哪些官能团的分析方法是( )
A. 核磁共振氢谱 B. 质谱
C. 红外光谱 D. 紫外光谱
解析 核磁共振氢谱能分析等效氢的种类 ,故A错误
质谱分析相对分子质量,故B错误
红外光谱判断有机物分子中官能团的种类,故C正确
只根据紫外光谱是不能完全确定物质的分子结构,故D错误
C
1. 双原子分子(直线型)
#0070C0
#00B0F0
二、多样的分子空间结构
O2
HCl
2. 三原子分子立体结构(有直线形和V形)
H2O
CO2
3.四原子分子立体结构(直线形、平面三角形、三角锥形、正四面体)
#0070C0
#00B0F0
二、多样的分子空间结构
C2H2
NH3
P4
CH2O
COCl2
4.五原子分子立体结构
#0070C0
#00B0F0
二、多样的分子空间结构
最常见的是正四面体
CH4
5. 其它
#0070C0
#00B0F0
二、多样的分子空间结构
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
P4O6
P4O10
椅式C6H12
船式C6H12
C10H16
S8
SF6
B12
#0070C0
#00B0F0
练一练
(1) 四原子分子一定都是平面三角形或三角锥形 ( )
(2) 正四面体形的键角均为109°28′ ( )
(3) SiCl4、SiH4、 、CH3Cl均为正四面体结构 ( )
(4) SF6分子的空间结构为正八面体形 ( )
×
×
×
√
判断正误
NH4
+
价层电子对互斥理论
#0070C0
#00B0F0
1940年Sidgwick提出价层电子对互斥理论,用以判断分子的立体构型。
分子 ABn中, A为中心,n为B 原子的个数。B均与A有键联关系。本节讨论的ABn型分子中,A为主族元素的原子。
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
对ABm型分子或离子,中心原子A价层电子对(包括成键电子对和孤对电子)之间存在排斥力,将使分子中的原子处于尽可能远的相对位置上,以使各原子之间斥力最小,分子体系能量最低。
1. 价层电子对互斥理论要点
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
2. 电子对数目与立体结构
(1)ABn型:中心原子(A)上的价电子都用于形成共价键
CO2
BF3
CH4
2
4
3
立体结构
直线形
平面三角形
正四面体形
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
分子 CO2 BF3 CH4
电子式
结构式
中心原子 有无孤对电子
空间结构
O C O
: :
: :
:
:
:
:
O=C=O
F – B - F
-
F
H- C -H
-
-
H
H
无
无
无
直线形
平面三角形
正四面体
:
:
:
H C H
:
H
H
F B F
:
:
:
F:
:
:
:
:
:
:
:
:
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
三、价层电子对互斥理论 VSEPR
(2)中心原子上有孤对电子 (未用于形成共价键的电子对) 的分子
ABn 立体结构 范例
n=2 V形 H2O
n=3 三角锥形 NH3
孤电子对、成键电子对之间排斥力大小比较:
孤-孤 > 孤- 成 > 成- 成
#0070C0
#00B0F0
三、价层电子对互斥理论 VSEPR
中心原子 代表物 中心原子 结合的原子数 分子类型 空间构型
无孤对电子 CO2 2 AB2
BF3 3 AB3
CH4 4 AB4
有孤对电子 H2O 2 AB2
NH3 3 AB3
直线形
平面三角形
正四面体
V 形
三角锥形
价层电子对互斥模型
还有2对孤对电子
还有1对孤对电子
原因
#0070C0
#00B0F0
中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H2O和NH3的中心原子分别有2对孤对电子和1对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
三、价层电子对互斥理论 VSEPR
#0070C0
#00B0F0
3. 价层电子对的计算
三、价层电子对互斥理论 VSEPR
(1) 中心原子价层电子对数=σ 键电子对数+孤电子对数。
(2) σ 键电子对数的计算
由化学式确定,即中心原子形成几个σ 键,就有几对σ 键电子对。如H2O分子中, O有 对σ 键电子对。NH3分子中, N有 对σ 键电子对。
2
3
#0070C0
#00B0F0
3. 价层电子对的计算
三、价层电子对互斥理论 VSEPR
(3)中心原子上的孤电子对数的计算
中心原子上的孤电子对数=
①a表示中心原子的价电子数;
对主族元素:a= ;
对于阳离子:a= ;
对于阴离子:a= 。
②x表示与 结合的原子数。
③b表示与中心原子结合的原子最多能接受的电子数,氢为1其他原子= 。
最外层电子数
价电子数-离子所带电荷数
价电子数+离子所带电荷数
中心原子
8-该原子的价电子数
(a-xb)
2
1
分子空间结构的确定思路
#0070C0
#00B0F0
归纳总结
中心原子价层电子对数n
分子的空间结构——略去孤电子对在价层电子对互斥模型中占有的空间
#0070C0
#00B0F0
课堂练习
1. 下列分子的空间结构模型正确的是( )
A. CO2的空间结构模型: B. H2O的空间结构模型:
C. NH3的空间结构模型: D. CH4的空间结构模型:
D
解析 CO2的空间结构为直线形,A不正确;
H2O的空间结构为V形,B不正确;
NH3的空间结构为三角锥形,C不正确;
CH4的空间结构为正四面体形,D正确。
#0070C0
#00B0F0
课堂练习
2. (1) 硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结构为______。
(2) 二硫化碳(CS2)分子中,两个C==S的夹角是180°,说明CS2分子的空间结构为_______。
解析 可由键角直接判断分子的空间结构。
V形
直线形
#0070C0
#00B0F0
课堂练习
(3)能说明CH4分子不是平面四边形,而是正四面体结构的是____(填字母)。
a. 两个键之间的夹角为109°28′
b. C—H为极性共价键
c. 4个C—H的键能、键长都相等
d. 二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
解析 五原子分子CH4可能有平面四边形和正四面体两种空间结构,不管为哪种,b、c两项都成立;若为前者,则键角为90°,CH2Cl2有两种:
和 ;若为后者,则键角为109°28′,CH2Cl2只有一种。
ad
#0070C0
#00B0F0
课堂练习
3. 若ABn型分子的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥模型,判断下列说法中正确的是( )
A.若n=2,则分子的空间结构为V形
B.若n=3,则分子的空间结构为三角锥形
C.若n=4,则分子的空间结构为正四面体形
D.以上说法都不正确
解析 若中心原子A上没有未用于形成共价键的孤电子对,则不存在σ键电子对与孤电子对之间的相互排斥。当n=2时,分子的空间结构为直线形;n=3时,分子的空间结构为平面三角形;n=4时,分子的空间结构为正四面体形。
C
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
