2.3《分子结构与物质的性质》(第2课时)课件(共33张PPT)
文档属性
| 名称 | 2.3《分子结构与物质的性质》(第2课时)课件(共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 00:00:00 | ||
图片预览








文档简介
(共33张PPT)
第二章 分子结构与性质
第三节 分子空间作用力
第2课时 《分子间作用力1》
选修二
原子结构与性质
核心素养
掌握范德华力、氢键的概念。
通过范德华力、氢键对物质性质影响的探析,形成“结构决定性质”的认知模型。
3. 能从微观角度理解分子的手性,形成判断手性分子的思维模型。
#0070C0
#00B0F0
一、范德华力
研究表明分子之间普遍存在着相互作用力,
而荷兰物理学家范德华是最早研究这种作用力的科学家,因而把这种分子间作用力称为范德华力。
J.D.Van der Waals
#0070C0
#00B0F0
一、范德华力
① 创意菜中干冰除了制造烟雾效果外还
可以保持低温,为什么?
干冰汽化吸热。
② 干冰汽化有没有破坏化学键?为什么
会吸热呢?
说明干冰分子之间存在着相互作用力。
思考讨论
#0070C0
#00B0F0
一、范德华力
思考讨论
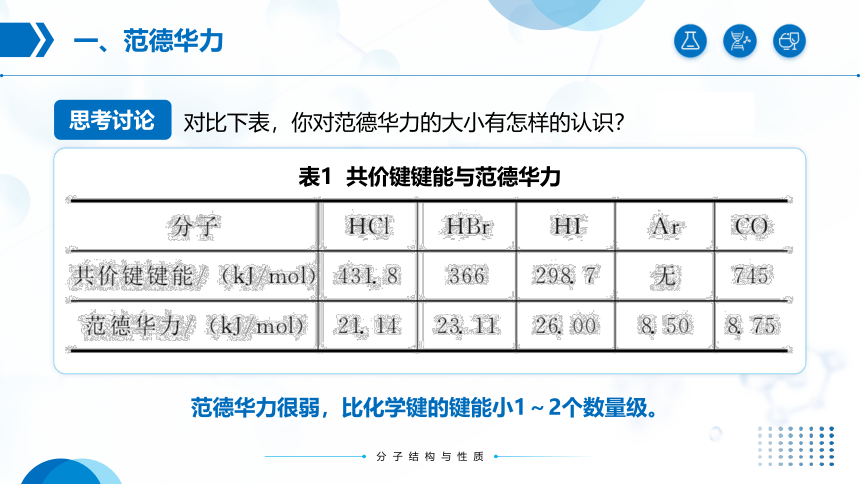
对比下表,你对范德华力的大小有怎样的认识?
范德华力很弱,比化学键的键能小1~2个数量级。
表1 共价键键能与范德华力
#0070C0
#00B0F0
一、范德华力
思考讨论
在某些物质如Br2、I2的熔化沸腾过程中,克服了什么作用力?
那么这些物质的熔沸点和什么有关?
Br2、I2的熔化沸腾过程中,破坏了范德华力;它们的熔沸点取决于范德华力的大小,范德华力越大,熔沸点越高。
#0070C0
#00B0F0
一、范德华力
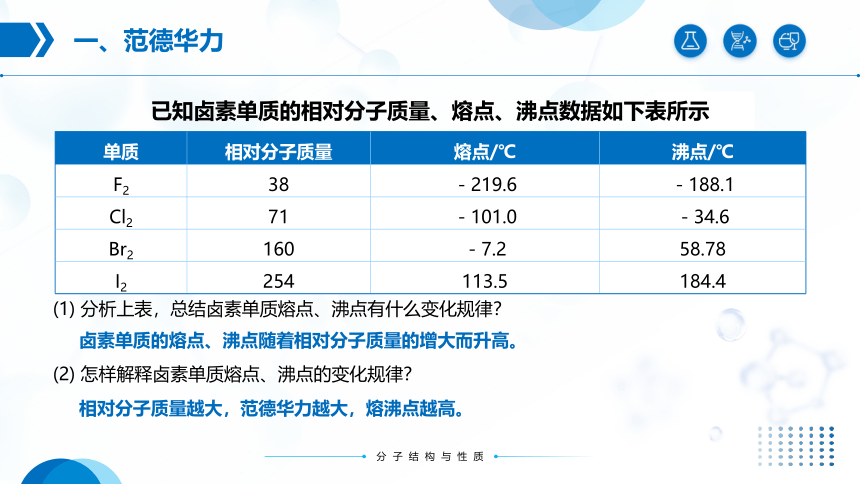
已知卤素单质的相对分子质量、熔点、沸点数据如下表所示
单质 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101.0 -34.6
Br2 160 -7.2 58.78
I2 254 113.5 184.4
(1) 分析上表,总结卤素单质熔点、沸点有什么变化规律?
卤素单质的熔点、沸点随着相对分子质量的增大而升高。
(2) 怎样解释卤素单质熔点、沸点的变化规律?
相对分子质量越大,范德华力越大,熔沸点越高。
#0070C0
#00B0F0
一、范德华力
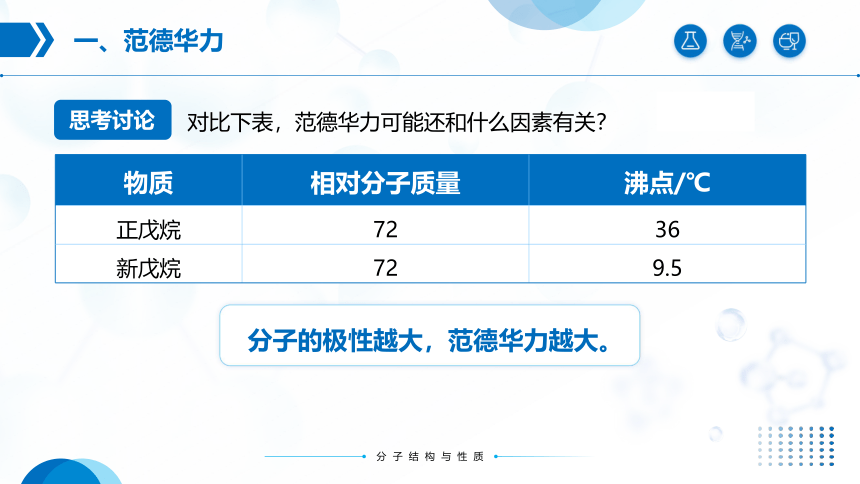
对比下表,范德华力可能还和什么因素有关?
物质 相对分子质量 沸点/℃
正戊烷 72 36
新戊烷 72 9.5
分子的极性越大,范德华力越大。
思考讨论
#0070C0
#00B0F0
一、范德华力
1. 范德华力的正确理解
特别提醒
范德华力很弱,比化学键的键能小1~2个数量级,分子间作用力的实质是电性引力,其主要特征有以下几个方面:
(1) 广泛存在于分子之间。
(2) 只有分子间充分接近时才有分子间的相互作用力(范德华力),如固体和液体
物质中。
(3) 范德华力无方向性和饱和性。只要分子周围空间允许,分子总是尽可能多地
吸引其他分子。
#0070C0
#00B0F0
一、范德华力
特别提醒
2. 键能大小影响分子的热稳定性,范德华力的大小影响物质的熔、沸点。
3. 相对分子质量接近时,分子的极性越大,范德华力越大。
4. 相对分子质量、极性相似的分子,分子的对称性越强,范德华力越弱,如
正丁烷>异丁烷,邻二甲苯>间二甲苯>对二甲苯。
#0070C0
#00B0F0
一、范德华力
思考讨论
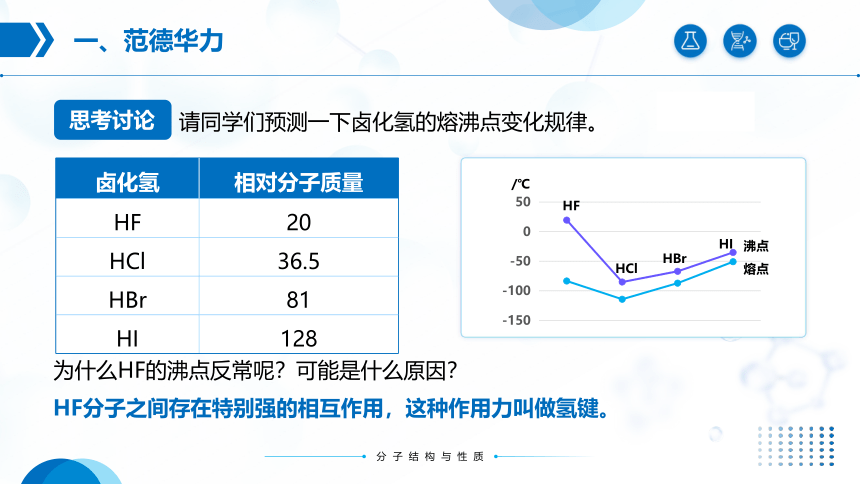
请同学们预测一下卤化氢的熔沸点变化规律。
卤化氢 相对分子质量
HF 20
HCl 36.5
HBr 81
HI 128
为什么HF的沸点反常呢?可能是什么原因?
HF分子之间存在特别强的相互作用,这种作用力叫做氢键。
HF
HCl
HBr
HI
沸点
熔点
/℃
#0070C0
#00B0F0
二、氢键
资料卡片
氢键的形成原理:
水分子间氢键实物模型
当H原子与电负性很大的原子(如N、O、F )形成共价键时,由于N、O、F的电负性很大,将共用电子对强烈地吸引过来,而使H原子带有较高的正电性(δ+)。此时,H原子与另一分子中的N、O、F(δ-)便存在了一种强烈的静电作用。这就是氢键。
#0070C0
#00B0F0
二、氢键
氢键的通式可用X—H…Y—表示。式中X和Y表示N、O、F,“—”表示共价键,“…”表示氢键。
H
F
H
F
H
F
H
F
* 氢键键长一般定义为X—H…Y的长度,而不是H…Y的长度。
表示方法
#0070C0
#00B0F0
二、氢键
思考讨论
根据氢键的形成原理,你认为最强的氢键是什么?
X—H…Y强弱与X和Y的电负性有关。电负性越大,则氢键越强,
如F原子电负性最大,因而F-H…F是最强的氢键。
氢键类型 F-H…F O-H…O
氢键键能(kJ.mol-1) 28.1 18.8
#0070C0
#00B0F0
二、氢键
思考讨论
已知F-H···F是最强的氢键,为什么H2O的沸点会高于HF?
氢键具有一定的方向性和饱和性。
物质的沸点与氢键的强弱和数目有关。
#0070C0
#00B0F0
二、氢键
思考讨论
对比下表,你对氢键的强度有怎样的认识?
氢键不是化学键,而是特殊的分子间作用力,其键能比化学键弱,比范德华力强。
#0070C0
#00B0F0
二、氢键
思考讨论
实验证实,氢键不仅存在于分子之间,也存在于分子内。观察以下两种氢键,推测这两种物质的熔沸点高低。
熔点:2℃
沸点:115℃
熔点:196.5℃
沸点:246.6℃
邻羟基苯甲醛
对羟基苯甲醛
当形成分子内氢键时,物质的熔、沸点将下降。
当形成分子间氢键时,物质的熔、沸点将升高。
#0070C0
#00B0F0
二、氢键
拓展视野
冰为什么浮在水面上?
一个水分子与周围的四个水分子呈正四面体构型,这一排列使冰晶体中水分子的空间利用率不高,留有较大的空隙。当冰刚熔化成液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。
冰中的四面体结构
冰晶体构型
#0070C0
#00B0F0
二、氢键
拓展视野
接近水沸点的水蒸气相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些。
接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成“缔合分子”,测定的相对分子质量会大一些。
#0070C0
#00B0F0
小结:范德华力、氢键、共价键的对比
范德华力 氢键 共价键
作用微粒 分子 H与N、O、F 原子
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
强度 共价键>氢键>范德华力 影响因素 ①相对分子质量 ②分子的极性 X—H···Y强弱与X和Y的电负性有关 成键原子半径和共用电子对数目。键长越小, 键能越大, 共价键越稳定
#0070C0
#00B0F0
实验探究
1. CCl4与水为什么分层?
2. I2为什么从水中转移到CCl4中?
在一个小试管里放入一小粒碘晶体,加入约5mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。
再向试管中加入1mL浓碘化钾(KI)水溶液,振荡试管,溶液的紫色变浅。这是由于在水溶液里可发生如下反应:
I2+I- I3-
#0070C0
#00B0F0
三、溶解性
1. 分子结构 ——“相似相溶”规律。
极性分子
碘和四氯化碳都是非极性分子,水是极性分子。非极性溶质(碘)一般能溶于非极性溶剂,而难溶于极性溶剂。后来碘单质又与KI生成可溶性盐KI3, 水溶性变强。
观察思考
影响物质溶解性的因素
非极性分子
#0070C0
#00B0F0
三、溶解性
观察思考
影响物质溶解性的因素
2. 氢键——如果溶质与溶剂之间能形成氢键,则溶解度增大。
水
甲醇
戊醇
——分子结构相似,“相似相溶”水和甲醇分子结构相似
#0070C0
#00B0F0
三、溶解性
观察思考
3. 反应——溶质与水发生可逆反应,如SO2与H2O反应生成H2SO3,CO2与H2O
反应生成H2CO3等,可增大其溶解度。
4. 外界条件——温度、压强等。
#0070C0
#00B0F0
四、分子的手性
观察思考
你的左右手能够完全重叠么?
这些互为镜像关系的物质能否完全重叠?
镜子里的“自己”和现实中的自己左右相反、完全对称。
互为镜像关系,但又不能重叠的现象,称之为“手性现象”。
#0070C0
#00B0F0
四、分子的手性
思考讨论
1. 互为镜像的分子可以是同一种分子,也可以是两种不同的分子。
2. 互为镜像,但不能重叠的两种分子,有什么结构特点?
同一个碳原子上连有四个不同的原子或基团
#0070C0
#00B0F0
四、分子的手性
思考讨论
手性碳原子
同一个碳原子上连有四个不同的原子或基团。
该碳原子称为手性碳原子(不对称碳原子)。
形成简单手性分子需满足的条件(结构特点):
#0070C0
#00B0F0
四、分子的手性
思考讨论
一对分子,他们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称手性异构体
有手性异构体的分子称为手性分子
#0070C0
#00B0F0
课堂练习
卤素单质从F2到I2在常温常压下的聚集态由气态、液态到固态的原因是( )
A. 原子间的化学键键能逐渐减小 B. 范德华力逐渐增大
C. 原子半径逐渐增大 D. 氧化性逐渐减弱
解析 卤素单质从F2到I2结构相似,相对分子质量依次增大,范德华力依次增大,分子的熔、沸点依次升高。
B
#0070C0
#00B0F0
课堂练习
2. 下列选项不能用学过的氢键知识进行解释的是( )
A. 相对分子质量小的醇与水互溶,而相对分子质量较大的醇则不溶于水
B. 氨易液化,而氮气不容易液化
C. 甲烷可以形成甲烷水合物,是因为甲烷分子与水分子之间形成了氢键
D.邻羟基苯甲醛( )的沸点比对羟基苯甲醛( )的沸点低
C
#0070C0
#00B0F0
课堂练习
3. 当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性
碳原子”。下列化合物中含有2个手性碳原子的是( )
C
A.
B.
C.
D.
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
第二章 分子结构与性质
第三节 分子空间作用力
第2课时 《分子间作用力1》
选修二
原子结构与性质
核心素养
掌握范德华力、氢键的概念。
通过范德华力、氢键对物质性质影响的探析,形成“结构决定性质”的认知模型。
3. 能从微观角度理解分子的手性,形成判断手性分子的思维模型。
#0070C0
#00B0F0
一、范德华力
研究表明分子之间普遍存在着相互作用力,
而荷兰物理学家范德华是最早研究这种作用力的科学家,因而把这种分子间作用力称为范德华力。
J.D.Van der Waals
#0070C0
#00B0F0
一、范德华力
① 创意菜中干冰除了制造烟雾效果外还
可以保持低温,为什么?
干冰汽化吸热。
② 干冰汽化有没有破坏化学键?为什么
会吸热呢?
说明干冰分子之间存在着相互作用力。
思考讨论
#0070C0
#00B0F0
一、范德华力
思考讨论
对比下表,你对范德华力的大小有怎样的认识?
范德华力很弱,比化学键的键能小1~2个数量级。
表1 共价键键能与范德华力
#0070C0
#00B0F0
一、范德华力
思考讨论
在某些物质如Br2、I2的熔化沸腾过程中,克服了什么作用力?
那么这些物质的熔沸点和什么有关?
Br2、I2的熔化沸腾过程中,破坏了范德华力;它们的熔沸点取决于范德华力的大小,范德华力越大,熔沸点越高。
#0070C0
#00B0F0
一、范德华力
已知卤素单质的相对分子质量、熔点、沸点数据如下表所示
单质 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101.0 -34.6
Br2 160 -7.2 58.78
I2 254 113.5 184.4
(1) 分析上表,总结卤素单质熔点、沸点有什么变化规律?
卤素单质的熔点、沸点随着相对分子质量的增大而升高。
(2) 怎样解释卤素单质熔点、沸点的变化规律?
相对分子质量越大,范德华力越大,熔沸点越高。
#0070C0
#00B0F0
一、范德华力
对比下表,范德华力可能还和什么因素有关?
物质 相对分子质量 沸点/℃
正戊烷 72 36
新戊烷 72 9.5
分子的极性越大,范德华力越大。
思考讨论
#0070C0
#00B0F0
一、范德华力
1. 范德华力的正确理解
特别提醒
范德华力很弱,比化学键的键能小1~2个数量级,分子间作用力的实质是电性引力,其主要特征有以下几个方面:
(1) 广泛存在于分子之间。
(2) 只有分子间充分接近时才有分子间的相互作用力(范德华力),如固体和液体
物质中。
(3) 范德华力无方向性和饱和性。只要分子周围空间允许,分子总是尽可能多地
吸引其他分子。
#0070C0
#00B0F0
一、范德华力
特别提醒
2. 键能大小影响分子的热稳定性,范德华力的大小影响物质的熔、沸点。
3. 相对分子质量接近时,分子的极性越大,范德华力越大。
4. 相对分子质量、极性相似的分子,分子的对称性越强,范德华力越弱,如
正丁烷>异丁烷,邻二甲苯>间二甲苯>对二甲苯。
#0070C0
#00B0F0
一、范德华力
思考讨论
请同学们预测一下卤化氢的熔沸点变化规律。
卤化氢 相对分子质量
HF 20
HCl 36.5
HBr 81
HI 128
为什么HF的沸点反常呢?可能是什么原因?
HF分子之间存在特别强的相互作用,这种作用力叫做氢键。
HF
HCl
HBr
HI
沸点
熔点
/℃
#0070C0
#00B0F0
二、氢键
资料卡片
氢键的形成原理:
水分子间氢键实物模型
当H原子与电负性很大的原子(如N、O、F )形成共价键时,由于N、O、F的电负性很大,将共用电子对强烈地吸引过来,而使H原子带有较高的正电性(δ+)。此时,H原子与另一分子中的N、O、F(δ-)便存在了一种强烈的静电作用。这就是氢键。
#0070C0
#00B0F0
二、氢键
氢键的通式可用X—H…Y—表示。式中X和Y表示N、O、F,“—”表示共价键,“…”表示氢键。
H
F
H
F
H
F
H
F
* 氢键键长一般定义为X—H…Y的长度,而不是H…Y的长度。
表示方法
#0070C0
#00B0F0
二、氢键
思考讨论
根据氢键的形成原理,你认为最强的氢键是什么?
X—H…Y强弱与X和Y的电负性有关。电负性越大,则氢键越强,
如F原子电负性最大,因而F-H…F是最强的氢键。
氢键类型 F-H…F O-H…O
氢键键能(kJ.mol-1) 28.1 18.8
#0070C0
#00B0F0
二、氢键
思考讨论
已知F-H···F是最强的氢键,为什么H2O的沸点会高于HF?
氢键具有一定的方向性和饱和性。
物质的沸点与氢键的强弱和数目有关。
#0070C0
#00B0F0
二、氢键
思考讨论
对比下表,你对氢键的强度有怎样的认识?
氢键不是化学键,而是特殊的分子间作用力,其键能比化学键弱,比范德华力强。
#0070C0
#00B0F0
二、氢键
思考讨论
实验证实,氢键不仅存在于分子之间,也存在于分子内。观察以下两种氢键,推测这两种物质的熔沸点高低。
熔点:2℃
沸点:115℃
熔点:196.5℃
沸点:246.6℃
邻羟基苯甲醛
对羟基苯甲醛
当形成分子内氢键时,物质的熔、沸点将下降。
当形成分子间氢键时,物质的熔、沸点将升高。
#0070C0
#00B0F0
二、氢键
拓展视野
冰为什么浮在水面上?
一个水分子与周围的四个水分子呈正四面体构型,这一排列使冰晶体中水分子的空间利用率不高,留有较大的空隙。当冰刚熔化成液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。
冰中的四面体结构
冰晶体构型
#0070C0
#00B0F0
二、氢键
拓展视野
接近水沸点的水蒸气相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些。
接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成“缔合分子”,测定的相对分子质量会大一些。
#0070C0
#00B0F0
小结:范德华力、氢键、共价键的对比
范德华力 氢键 共价键
作用微粒 分子 H与N、O、F 原子
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
强度 共价键>氢键>范德华力 影响因素 ①相对分子质量 ②分子的极性 X—H···Y强弱与X和Y的电负性有关 成键原子半径和共用电子对数目。键长越小, 键能越大, 共价键越稳定
#0070C0
#00B0F0
实验探究
1. CCl4与水为什么分层?
2. I2为什么从水中转移到CCl4中?
在一个小试管里放入一小粒碘晶体,加入约5mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。
再向试管中加入1mL浓碘化钾(KI)水溶液,振荡试管,溶液的紫色变浅。这是由于在水溶液里可发生如下反应:
I2+I- I3-
#0070C0
#00B0F0
三、溶解性
1. 分子结构 ——“相似相溶”规律。
极性分子
碘和四氯化碳都是非极性分子,水是极性分子。非极性溶质(碘)一般能溶于非极性溶剂,而难溶于极性溶剂。后来碘单质又与KI生成可溶性盐KI3, 水溶性变强。
观察思考
影响物质溶解性的因素
非极性分子
#0070C0
#00B0F0
三、溶解性
观察思考
影响物质溶解性的因素
2. 氢键——如果溶质与溶剂之间能形成氢键,则溶解度增大。
水
甲醇
戊醇
——分子结构相似,“相似相溶”水和甲醇分子结构相似
#0070C0
#00B0F0
三、溶解性
观察思考
3. 反应——溶质与水发生可逆反应,如SO2与H2O反应生成H2SO3,CO2与H2O
反应生成H2CO3等,可增大其溶解度。
4. 外界条件——温度、压强等。
#0070C0
#00B0F0
四、分子的手性
观察思考
你的左右手能够完全重叠么?
这些互为镜像关系的物质能否完全重叠?
镜子里的“自己”和现实中的自己左右相反、完全对称。
互为镜像关系,但又不能重叠的现象,称之为“手性现象”。
#0070C0
#00B0F0
四、分子的手性
思考讨论
1. 互为镜像的分子可以是同一种分子,也可以是两种不同的分子。
2. 互为镜像,但不能重叠的两种分子,有什么结构特点?
同一个碳原子上连有四个不同的原子或基团
#0070C0
#00B0F0
四、分子的手性
思考讨论
手性碳原子
同一个碳原子上连有四个不同的原子或基团。
该碳原子称为手性碳原子(不对称碳原子)。
形成简单手性分子需满足的条件(结构特点):
#0070C0
#00B0F0
四、分子的手性
思考讨论
一对分子,他们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称手性异构体
有手性异构体的分子称为手性分子
#0070C0
#00B0F0
课堂练习
卤素单质从F2到I2在常温常压下的聚集态由气态、液态到固态的原因是( )
A. 原子间的化学键键能逐渐减小 B. 范德华力逐渐增大
C. 原子半径逐渐增大 D. 氧化性逐渐减弱
解析 卤素单质从F2到I2结构相似,相对分子质量依次增大,范德华力依次增大,分子的熔、沸点依次升高。
B
#0070C0
#00B0F0
课堂练习
2. 下列选项不能用学过的氢键知识进行解释的是( )
A. 相对分子质量小的醇与水互溶,而相对分子质量较大的醇则不溶于水
B. 氨易液化,而氮气不容易液化
C. 甲烷可以形成甲烷水合物,是因为甲烷分子与水分子之间形成了氢键
D.邻羟基苯甲醛( )的沸点比对羟基苯甲醛( )的沸点低
C
#0070C0
#00B0F0
课堂练习
3. 当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性
碳原子”。下列化合物中含有2个手性碳原子的是( )
C
A.
B.
C.
D.
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
