3.3《金属晶体与离子晶体》课件(共29张PPT)
文档属性
| 名称 | 3.3《金属晶体与离子晶体》课件(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 00:00:00 | ||
图片预览





文档简介
(共29张PPT)
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
选修二
原子结构与性质
核心素养
能辨识常见的金属晶体,能从微观角度分析金属晶体中构成微粒及微粒间作用,并解
释金属的物理性质
能辨识常见的离子晶体,能从微观角度理解离子键对离子晶体性质的影响,能从宏观角度解释离子晶体性质的差异。
3. 通过对离子晶体模型的认识,理解离子晶体的结构特点,预测其性质。
4. 从化学键变化上认识过渡晶体,理解纯粹的典型晶体在自然界中是不多的。
5. 从结构和性质上认识典型的混合型晶体——石墨。
#0070C0
#00B0F0
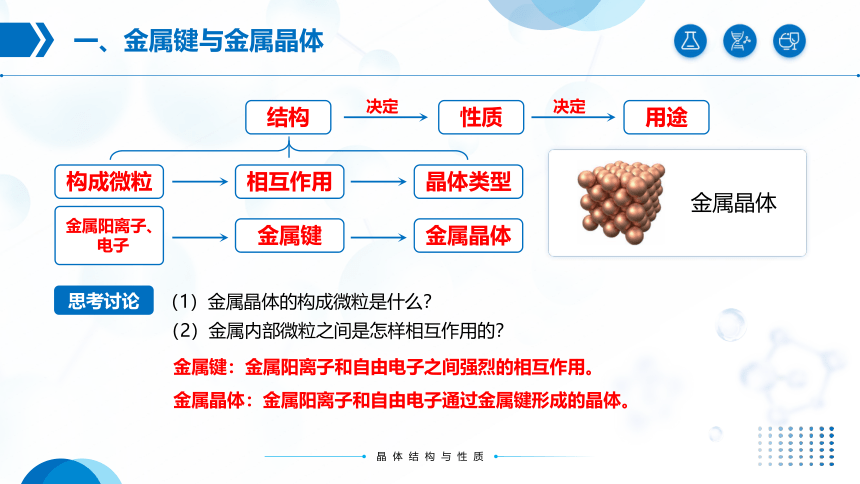
一、金属键与金属晶体
(1)金属晶体的构成微粒是什么?
金属键:金属阳离子和自由电子之间强烈的相互作用。
(2)金属内部微粒之间是怎样相互作用的?
金属晶体:金属阳离子和自由电子通过金属键形成的晶体。
结构
性质
用途
决定
决定
金属晶体
思考讨论
构成微粒
相互作用
晶体类型
金属阳离子、
电子
金属键
金属晶体
#0070C0
#00B0F0
一、金属键与金属晶体
金属键
(1) 成键粒子: 和 。
(2) 成键条件: 或 。
(3) 成键本质——电子气理论:
金属原子脱落下来的 形成遍布整块晶体的“电子气”, 被所有原子共用, 从而把 维系在一起, 形成像共价晶体一样的“巨分子”。
自由电子
金属阳离子
合金
金属单质
价电子
所有的金属原子
#0070C0
#00B0F0
一、金属键与金属晶体
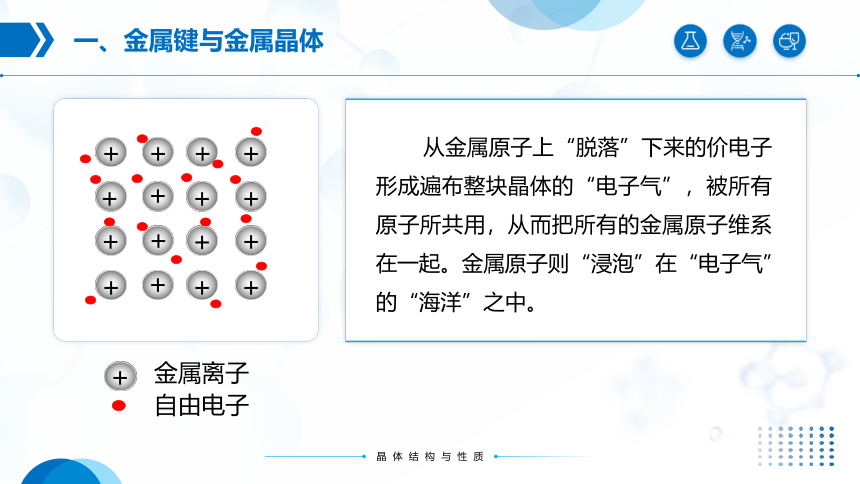
从金属原子上“脱落”下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起。金属原子则“浸泡”在“电子气”的“海洋”之中。
自由电子
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
金属离子
+
#0070C0
#00B0F0
一、金属键与金属晶体
金属键
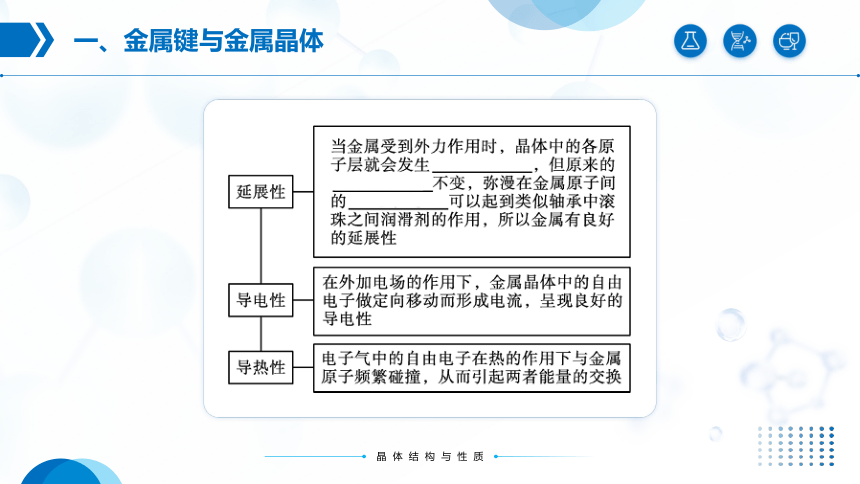
金属键无方向性和饱和性。金属晶体里的自由电子不专属于某几个特定的金属原子,而是几乎均匀地分布在整个晶体里,把所有金属原子维系在一起,所以金属键没有方向性和饱和性。
(4) 金属键的特征:
2. 金属晶体
(1) 金属(除汞外)在常温下都是晶体, 称其为金属晶体。
(2) 用电子气理论解释金属的物理性质:
#0070C0
#00B0F0
一、金属键与金属晶体
#0070C0
#00B0F0
二、合金
结构
性质
用途
决定
决定
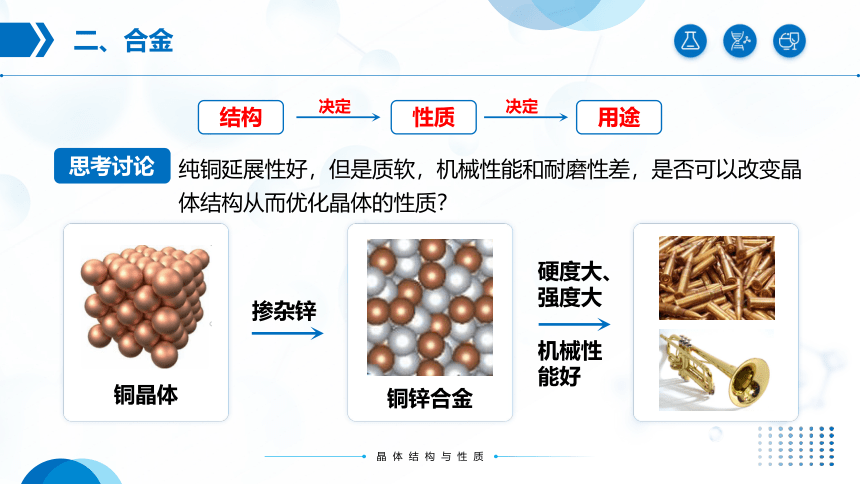
纯铜延展性好,但是质软,机械性能和耐磨性差,是否可以改变晶体结构从而优化晶体的性质?
铜晶体
铜锌合金
掺杂锌
机械性能好
硬度大、强度大
思考讨论
#0070C0
#00B0F0
二、合金
铜镍合金
资料卡片
强度高、硬度大,用于造船、化工设备等
银铝合金
耐高温、耐磨性好,用于航空耐热材料等
铁铬合金
耐腐蚀、耐高温,用于餐具、建筑材料等
#0070C0
#00B0F0
CsCl晶体的结构模型
① Cs+和Cl-的空间位置关系?
② Cs+周围等距离且最近的Cl-?Cl-周围等距离且最近的Cs+ ?
两种晶体结构中,为什么阳离子周围结合的氯离子数目不同?
阳离子半径大小不同
③ 每个晶胞含Cs+、Cl-个数?
8
CsCl晶体的微观结构
#0070C0
#00B0F0
CsCl晶体的结构模型
钠钾合金常温下为液态,可用作冷却剂、催化剂、干燥剂。其晶胞结构如图所示,观察晶体结构请回答:
(1)合金的化学式是什么?
K:8个顶角
Na:12个在棱心
Na原子数目=12× =3
K原子数目=8× =1
此钠钾合金的化学式为KNa3或Na3K
(2)晶胞中K 原子周围距离最近的Na原子数是多少?
6
观察思考
#0070C0
#00B0F0
NaCl晶体的结构模型
③ 在你截取的晶胞中含有的Na+和Cl-的数目各是多少?
① Na+和Cl-的空间位置关系?
② Na+周围等距离且最近的Cl-? Cl-周围等距离且最近的Na+ ?
6
④ 氯化钠的化学式用“NaCl”表示,原因何在?能否把NaCl称为分子式?
在氯化钠晶体中,并不存在单独的“NaCl”分子,用“NaCl”这一化学式仅表示氯化钠的组成。
#0070C0
#00B0F0
三、离子晶体
Na+和Cl-之间存在强烈的相互作用
离子键
请根据离子晶体的微观结构描述离子键的特征?
离子键特征:无方向性和饱和性
离子晶体:是阴、阳离子在空间呈现周期性重复排列所形成的晶体
(静电作用)
共价键特征:有方向性和饱和性
交流研讨
NaCl晶体中Na+和Cl-因为不能自由移动因而不能导电,但熔融的NaCl却能导电,这说明了什么?
#0070C0
#00B0F0
三、离子晶体
交流研讨
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
离子键强弱
熔点
影响
离子半径、所带电荷
影响
#0070C0
#00B0F0
三、离子晶体
交流研讨
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
耐火材料
离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。
离子晶体的熔点都很高吗?你的依据是什么吗?
#0070C0
#00B0F0
三、离子晶体
1. 离子键及其影响因素
(1) 概念:阴、阳离子之间通过 形成的化学键。
(2) 影响因素:离子所带电荷数 ,离子半径 ,离子键越强。
特别提醒 离子键没有方向性和饱和性。
静电作用
越多
越小
#0070C0
#00B0F0
三、离子晶体
2. 离子晶体及其物理性质
(1) 概念:由 和 相互作用而形成的晶体。
(2) 离子晶体的性质
① 熔、沸点较 ,硬度较 。
② 离子晶体不导电,但 或 后能导电。
③ 大多数离子晶体能溶于水,难溶于有机溶剂。
阳离子
阴离子
高
大
熔化
溶于水
#0070C0
#00B0F0
三、离子晶体
3.离子液体
(1) 定义: 在室温或稍高于室温时呈液态的离子化合物。
(2) 组成: 大多数离子液体含有体积很大的阴、阳离子。
(3) 性质与用途: 离子液体 挥发,可用作 。
难
溶剂
#0070C0
#00B0F0
四、过渡晶体
1. 四类典型的晶体是指 晶体、 晶体、 晶体和 晶体。
共价
金属
离子
分子
2.过渡晶体:介于典型晶体之间的晶体。
(1)几种氧化物的化学键中离子键成分的百分数:
从上表可知,表中4种氧化物晶体中的化学键既不是纯粹的离子键也不是纯粹的共价键,所以这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的 。
氧化物 Na2O MgO Al2O3 SiO2
离子键的百分数/% 62 50 41 33
过渡晶体
#0070C0
#00B0F0
四、过渡晶体
(2) 偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如 等。同样偏向共价晶体的过渡晶体当作共价晶体来处理,如 、 等。
Na2O
Al2O3
SiO2
#0070C0
#00B0F0
五、混合型晶体
1. 结构特点——层状结构。
(1)同层内碳原子采取 杂化,以共价键(σ键)结合,形成 。
(2)层与层之间靠 维系。
(3)石墨的二维结构内, 每个碳原子的配位数为3, 有一个未参与杂化的2p电子, 它
的原子轨道垂直于碳原子平面。
2. 晶体类型:属于 。
3. 性质:熔点 、质软、 导电等。
平面六元并环结构
范德华力
混合型晶体
很高
易
sp2
#0070C0
#00B0F0
六、纳米晶体
1. 含义:
晶体颗粒尺寸在 (10-9 m)量级的晶体。
2. 特性:
(1)纳米晶体在声、 、 、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
(2)当晶体颗粒小至纳米量级,熔点会 。
纳米
光
电
下降
#0070C0
#00B0F0
课堂练习
根据下列对四种物质的有关性质的叙述,判断其中可能属于金属晶
体的是( )
A. 由分子间作用力结合而成,熔点低
B. 固体或熔融后易导电,熔点在1 000 ℃左右
C. 具有共价键三维骨架结构,熔点高
D. 固体和熔融状态不导电,但溶于水后可能导电
B
#0070C0
#00B0F0
课堂练习
2. 在金属晶体中, 如果金属原子的价电子数越多, 原子半径越小, 自由
电子与金属阳离子间的作用力越大, 金属的熔、沸点越高。由此判
断下列各组金属的熔、沸点高低顺序,其中正确的是( )
A. Mg>Al>Ca B. Al>Na>Li
C. Al>Mg>Ca D. Mg>Ba>Al
C
#0070C0
#00B0F0
课堂练习
3. 下列性质适合于离子晶体的是( )。
①熔点1070 ℃, 易溶于水, 水溶液能导电
②熔点10.31 ℃, 液态不导电, 水溶液能导电
③能溶于CS2, 熔点112.8 ℃, 沸点444.6 ℃
④熔点97.81 ℃, 质软, 导电, 密度0.97 g·cm-3
⑤熔点-218 ℃, 难溶于水
⑥熔点3 900 ℃, 硬度很大, 不导电
⑦难溶于水, 固态时导电, 升温时导电能力减弱
⑧难溶于水, 熔点高, 固态时不导电,熔化时导电
A.①⑧ B.②③⑥ C.①④⑦ D.②⑤
A
#0070C0
#00B0F0
课堂练习
C
4. 氧化钙在2973K时熔化, 而氯化钠在1074K时熔化, 两者的离子间距离和晶体
结构都类似, 有关它们熔点差别较大的原因叙述不正确的是( )。
A. 氧化钙晶体中阴、阳离子所带的电荷数多
B. 氧化钙中氧离子与钙离子之间的作用力更强
C. 氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D. 在氧化钙与氯化钠的离子间距离类似的情况下, 熔点主要由阴、阳离子所
带电荷数的多少决定
#0070C0
#00B0F0
课堂练习
5. (1)石墨烯是一种由单层碳原子构成的平面结构新型碳材料, 如图所示1mol石墨烯中含有的六元环个数为 (设NA为阿伏加德罗常数的值)。
石墨烯
0.5NA
(2) 碳元素形成的单质所属晶体类型可能是
(填序号)。
①分子晶体 ②共价晶体 ③金属晶体
④离子晶体 ⑤混合型晶体
①②⑤
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
选修二
原子结构与性质
核心素养
能辨识常见的金属晶体,能从微观角度分析金属晶体中构成微粒及微粒间作用,并解
释金属的物理性质
能辨识常见的离子晶体,能从微观角度理解离子键对离子晶体性质的影响,能从宏观角度解释离子晶体性质的差异。
3. 通过对离子晶体模型的认识,理解离子晶体的结构特点,预测其性质。
4. 从化学键变化上认识过渡晶体,理解纯粹的典型晶体在自然界中是不多的。
5. 从结构和性质上认识典型的混合型晶体——石墨。
#0070C0
#00B0F0
一、金属键与金属晶体
(1)金属晶体的构成微粒是什么?
金属键:金属阳离子和自由电子之间强烈的相互作用。
(2)金属内部微粒之间是怎样相互作用的?
金属晶体:金属阳离子和自由电子通过金属键形成的晶体。
结构
性质
用途
决定
决定
金属晶体
思考讨论
构成微粒
相互作用
晶体类型
金属阳离子、
电子
金属键
金属晶体
#0070C0
#00B0F0
一、金属键与金属晶体
金属键
(1) 成键粒子: 和 。
(2) 成键条件: 或 。
(3) 成键本质——电子气理论:
金属原子脱落下来的 形成遍布整块晶体的“电子气”, 被所有原子共用, 从而把 维系在一起, 形成像共价晶体一样的“巨分子”。
自由电子
金属阳离子
合金
金属单质
价电子
所有的金属原子
#0070C0
#00B0F0
一、金属键与金属晶体
从金属原子上“脱落”下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起。金属原子则“浸泡”在“电子气”的“海洋”之中。
自由电子
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
金属离子
+
#0070C0
#00B0F0
一、金属键与金属晶体
金属键
金属键无方向性和饱和性。金属晶体里的自由电子不专属于某几个特定的金属原子,而是几乎均匀地分布在整个晶体里,把所有金属原子维系在一起,所以金属键没有方向性和饱和性。
(4) 金属键的特征:
2. 金属晶体
(1) 金属(除汞外)在常温下都是晶体, 称其为金属晶体。
(2) 用电子气理论解释金属的物理性质:
#0070C0
#00B0F0
一、金属键与金属晶体
#0070C0
#00B0F0
二、合金
结构
性质
用途
决定
决定
纯铜延展性好,但是质软,机械性能和耐磨性差,是否可以改变晶体结构从而优化晶体的性质?
铜晶体
铜锌合金
掺杂锌
机械性能好
硬度大、强度大
思考讨论
#0070C0
#00B0F0
二、合金
铜镍合金
资料卡片
强度高、硬度大,用于造船、化工设备等
银铝合金
耐高温、耐磨性好,用于航空耐热材料等
铁铬合金
耐腐蚀、耐高温,用于餐具、建筑材料等
#0070C0
#00B0F0
CsCl晶体的结构模型
① Cs+和Cl-的空间位置关系?
② Cs+周围等距离且最近的Cl-?Cl-周围等距离且最近的Cs+ ?
两种晶体结构中,为什么阳离子周围结合的氯离子数目不同?
阳离子半径大小不同
③ 每个晶胞含Cs+、Cl-个数?
8
CsCl晶体的微观结构
#0070C0
#00B0F0
CsCl晶体的结构模型
钠钾合金常温下为液态,可用作冷却剂、催化剂、干燥剂。其晶胞结构如图所示,观察晶体结构请回答:
(1)合金的化学式是什么?
K:8个顶角
Na:12个在棱心
Na原子数目=12× =3
K原子数目=8× =1
此钠钾合金的化学式为KNa3或Na3K
(2)晶胞中K 原子周围距离最近的Na原子数是多少?
6
观察思考
#0070C0
#00B0F0
NaCl晶体的结构模型
③ 在你截取的晶胞中含有的Na+和Cl-的数目各是多少?
① Na+和Cl-的空间位置关系?
② Na+周围等距离且最近的Cl-? Cl-周围等距离且最近的Na+ ?
6
④ 氯化钠的化学式用“NaCl”表示,原因何在?能否把NaCl称为分子式?
在氯化钠晶体中,并不存在单独的“NaCl”分子,用“NaCl”这一化学式仅表示氯化钠的组成。
#0070C0
#00B0F0
三、离子晶体
Na+和Cl-之间存在强烈的相互作用
离子键
请根据离子晶体的微观结构描述离子键的特征?
离子键特征:无方向性和饱和性
离子晶体:是阴、阳离子在空间呈现周期性重复排列所形成的晶体
(静电作用)
共价键特征:有方向性和饱和性
交流研讨
NaCl晶体中Na+和Cl-因为不能自由移动因而不能导电,但熔融的NaCl却能导电,这说明了什么?
#0070C0
#00B0F0
三、离子晶体
交流研讨
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
离子键强弱
熔点
影响
离子半径、所带电荷
影响
#0070C0
#00B0F0
三、离子晶体
交流研讨
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
耐火材料
离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。
离子晶体的熔点都很高吗?你的依据是什么吗?
#0070C0
#00B0F0
三、离子晶体
1. 离子键及其影响因素
(1) 概念:阴、阳离子之间通过 形成的化学键。
(2) 影响因素:离子所带电荷数 ,离子半径 ,离子键越强。
特别提醒 离子键没有方向性和饱和性。
静电作用
越多
越小
#0070C0
#00B0F0
三、离子晶体
2. 离子晶体及其物理性质
(1) 概念:由 和 相互作用而形成的晶体。
(2) 离子晶体的性质
① 熔、沸点较 ,硬度较 。
② 离子晶体不导电,但 或 后能导电。
③ 大多数离子晶体能溶于水,难溶于有机溶剂。
阳离子
阴离子
高
大
熔化
溶于水
#0070C0
#00B0F0
三、离子晶体
3.离子液体
(1) 定义: 在室温或稍高于室温时呈液态的离子化合物。
(2) 组成: 大多数离子液体含有体积很大的阴、阳离子。
(3) 性质与用途: 离子液体 挥发,可用作 。
难
溶剂
#0070C0
#00B0F0
四、过渡晶体
1. 四类典型的晶体是指 晶体、 晶体、 晶体和 晶体。
共价
金属
离子
分子
2.过渡晶体:介于典型晶体之间的晶体。
(1)几种氧化物的化学键中离子键成分的百分数:
从上表可知,表中4种氧化物晶体中的化学键既不是纯粹的离子键也不是纯粹的共价键,所以这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的 。
氧化物 Na2O MgO Al2O3 SiO2
离子键的百分数/% 62 50 41 33
过渡晶体
#0070C0
#00B0F0
四、过渡晶体
(2) 偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如 等。同样偏向共价晶体的过渡晶体当作共价晶体来处理,如 、 等。
Na2O
Al2O3
SiO2
#0070C0
#00B0F0
五、混合型晶体
1. 结构特点——层状结构。
(1)同层内碳原子采取 杂化,以共价键(σ键)结合,形成 。
(2)层与层之间靠 维系。
(3)石墨的二维结构内, 每个碳原子的配位数为3, 有一个未参与杂化的2p电子, 它
的原子轨道垂直于碳原子平面。
2. 晶体类型:属于 。
3. 性质:熔点 、质软、 导电等。
平面六元并环结构
范德华力
混合型晶体
很高
易
sp2
#0070C0
#00B0F0
六、纳米晶体
1. 含义:
晶体颗粒尺寸在 (10-9 m)量级的晶体。
2. 特性:
(1)纳米晶体在声、 、 、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
(2)当晶体颗粒小至纳米量级,熔点会 。
纳米
光
电
下降
#0070C0
#00B0F0
课堂练习
根据下列对四种物质的有关性质的叙述,判断其中可能属于金属晶
体的是( )
A. 由分子间作用力结合而成,熔点低
B. 固体或熔融后易导电,熔点在1 000 ℃左右
C. 具有共价键三维骨架结构,熔点高
D. 固体和熔融状态不导电,但溶于水后可能导电
B
#0070C0
#00B0F0
课堂练习
2. 在金属晶体中, 如果金属原子的价电子数越多, 原子半径越小, 自由
电子与金属阳离子间的作用力越大, 金属的熔、沸点越高。由此判
断下列各组金属的熔、沸点高低顺序,其中正确的是( )
A. Mg>Al>Ca B. Al>Na>Li
C. Al>Mg>Ca D. Mg>Ba>Al
C
#0070C0
#00B0F0
课堂练习
3. 下列性质适合于离子晶体的是( )。
①熔点1070 ℃, 易溶于水, 水溶液能导电
②熔点10.31 ℃, 液态不导电, 水溶液能导电
③能溶于CS2, 熔点112.8 ℃, 沸点444.6 ℃
④熔点97.81 ℃, 质软, 导电, 密度0.97 g·cm-3
⑤熔点-218 ℃, 难溶于水
⑥熔点3 900 ℃, 硬度很大, 不导电
⑦难溶于水, 固态时导电, 升温时导电能力减弱
⑧难溶于水, 熔点高, 固态时不导电,熔化时导电
A.①⑧ B.②③⑥ C.①④⑦ D.②⑤
A
#0070C0
#00B0F0
课堂练习
C
4. 氧化钙在2973K时熔化, 而氯化钠在1074K时熔化, 两者的离子间距离和晶体
结构都类似, 有关它们熔点差别较大的原因叙述不正确的是( )。
A. 氧化钙晶体中阴、阳离子所带的电荷数多
B. 氧化钙中氧离子与钙离子之间的作用力更强
C. 氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D. 在氧化钙与氯化钠的离子间距离类似的情况下, 熔点主要由阴、阳离子所
带电荷数的多少决定
#0070C0
#00B0F0
课堂练习
5. (1)石墨烯是一种由单层碳原子构成的平面结构新型碳材料, 如图所示1mol石墨烯中含有的六元环个数为 (设NA为阿伏加德罗常数的值)。
石墨烯
0.5NA
(2) 碳元素形成的单质所属晶体类型可能是
(填序号)。
①分子晶体 ②共价晶体 ③金属晶体
④离子晶体 ⑤混合型晶体
①②⑤
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
