3.4《配合物与超分子》课件(共30张PPT)
文档属性
| 名称 | 3.4《配合物与超分子》课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 06:58:49 | ||
图片预览










文档简介
(共30张PPT)
第三章 晶体结构与性质
第四节 配合物和超分子
选修二
原子结构与性质
素养目标
知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物 的存在与应用。认识配位键的特点与配位化合物某些性质的关系。
3. 了解人类探索物质结构的过程,认同“物质结构的探索是无止境的”观点,
了解从原子、分子、超分子等不同尺度认识物质结构的意义。
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
无水CuSO4是 色的,CuSO4·5H2O晶体是 色,
CuSO4 溶液是 色的。
FeCl3溶液是 色的,向溶液中滴加KSCN溶液,溶液变为 色。
白
蓝
蓝
棕黄
红
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
一、配合物
1.配位键
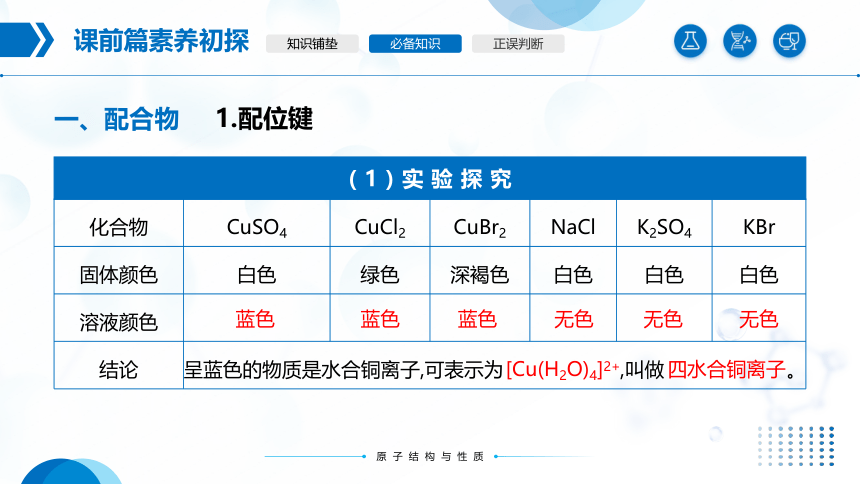
化合物 CuSO4 CuCl2 CuBr2 NaCl K2SO4 KBr
固体颜色 白色 绿色 深褐色 白色 白色 白色
溶液颜色
结论 呈蓝色的物质是水合铜离子,可表示为 ,叫做 。
(1)实验探究
四水合铜离子
[Cu(H2O)4]2+
无色
无色
无色
蓝色
蓝色
蓝色
孤电子对
配位键
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
(2)配位键
由一个原子单方面提供 而另一个原子接受孤电子对形成的共价键,即“电子对给予 —— 接受”键被称为 。
[Cu(H2O)4]2+可表示为:
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
(3)形成条件
形成配位键的一方(如A)是能够提供孤电子对的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。
①孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子
对。如 、 、 分子中中心原子分别有1、2、3对孤电子对。含有孤电子对的微粒:分子如CO、NH3、H2O等,离子如Cl-、CN-等。
②含有空轨道的微粒:过渡金属的原子或离子。一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固定的,如Ag+形成2个配位键,Cu2+形成4个配位键等。
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
深化拓展:配位键与非极性键、极性键的区别与联系
比较 共价键类型 非极性键 极性键 配位键
本质 相邻原子间的共用电子对(电子云重叠)与原子核间的静电作用 成键条件 (元素种类) 成键原子得、失电子 能力相同(同种元素) 成键原子得、失电子能力差别较小 (不同元素) 成键原子一方有孤电子对(配体),
另一方有空轨道(中心离子或原子)
特征 有方向性、饱和性 #0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
一、配合物
(1)概念
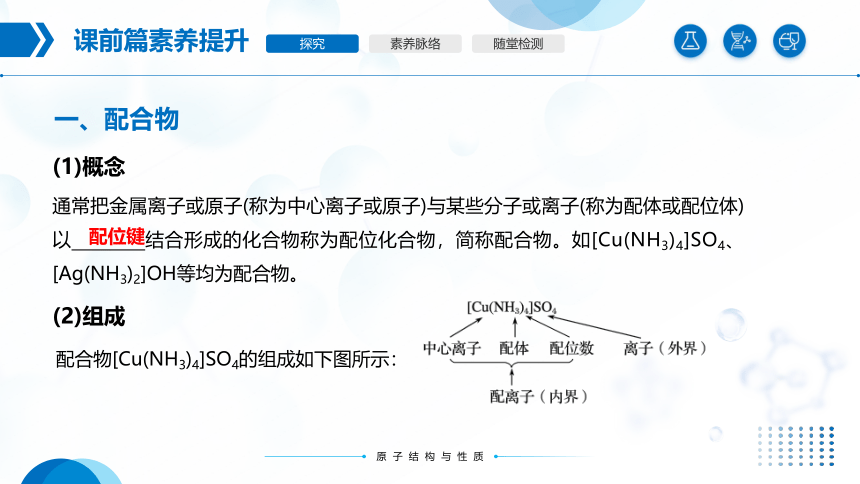
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
配合物[Cu(NH3)4]SO4的组成如下图所示:
(2)组成
配位键
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
①中心原子: 的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
②配体: 的阴离子或分子,如Cl-、NH3、H2O等。配体中
的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子等。
③配位数:直接与中心原子形成的 的数目。如[Fe(CN)6]4-中Fe2+的配位数为 。
提供空轨道接受孤电子对
提供孤电子对
直接同中心原子配位
配位键
6
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
(3)形成条3.配合物的形成实验件
实验 操作
实验 现象 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,滴加乙醇后析出深蓝色晶体 溶液颜色变成 红色 先产生白色沉淀,滴加氨水后白色沉淀溶解
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
有关离子方程式或化学方程式
Cu2++2NH3·H2O===Cu(OH)2↓+2
Cu(OH)2+4NH3=== [Cu(NH3)4](OH)2
[Cu(NH3)4]2++ +H2O=== [Cu(NH3)4]SO4·H2O↓
Fe3++3SCN-===Fe(SCN)3
Ag++Cl-===AgCl↓
AgCl+2NH3=== [Ag(NH3)2]Cl-
(1) 中的配位键与其他三个N—H键的键参数是否相同
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
提示: 相同。 可看成NH3分子结合1个H+后形成的,在NH3分子中中心原子氮采取sp3杂化,孤电子对占据一个杂化轨道,3个未成对电子分别占据另3个杂化轨道,分别结合3个H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当遇到H+时,N原子的孤电子对会进入H+的空轨道,以配位键形成 ,这样N原子就不再存在孤电子对,键角恢复至109°28',故 为正四面体形,4个N—H键完全相同,配位键与普通共价键形成过程不同,但各种键参数完全相同。
问题思考:
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
(2)配合物 [Cu(NH3)4]SO4 中含有的化学键类型有哪些
提示: [Cu(NH3)4]SO4 中含有的化学键有离子键、共价键和配位键。
(3)NH3 和 BF3 可以通过配位键形成 NH3·BF3 ,试分析提供孤电子对、空轨道的分别是哪种原子
提示: N 原子提供孤电子对,B 原子提供空轨道。
(4)配制银氨溶液时,向 AgNO3 溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么
提示: 氨水呈弱碱性,滴入 AgNO3 溶液中会生成 AgOH 白色沉淀;继续滴加氨水时,NH3 分子与 Ag+ 形成 [Ag(NH3)2]+ 配合离子,使 AgOH 逐渐溶解,反应过程如下:
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-。
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
4.配合物的形成对性质的影响
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
配合物广泛存在于自然界中,跟人类生活有密切关系。例如,在人和动物体内起输送氧气作用的血红素,是 Fe2+ 的配合物。配合物在生产和科学技术方面的应用也很广泛。
5.配合物的用途
#0070C0
#00B0F0
二、超分子
由两种或两种以上的分子(包括离子)通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
1. 概念
2. 微粒间作用力—非共价键
主要是静电作用、范德华力和氢键等
3. 大小
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——分子识别:
a. 分离 C60 和 C70
C60
C70
这个例子反映出来的超分子的特性被称为“分子识别”。
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——分子识别:
b. 冠醚识别碱金属离子
C 原子:2×5 = 10 O 原子:5
10 + 5 = 15
15-冠-5 12-冠-4
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——分子识别:
冠醚环的大小与金属离子匹配,才能识别
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152) Na+(204) K+(276) Rb+(304) Cs+(334) 例如:冠醚识别钾离子
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——分子识别:
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——超分子组装:
自组装
超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
细胞外部
磷脂分子
双分子层
细胞质
疏水端
亲水端
亲水端
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
小结
#0070C0
#00B0F0
随堂练习
1. 下列各种说法中错误的是( )
A. 形成配位键的条件是一方有空轨道,一方有孤电子对
B. 配位键是一种特殊的共价键
C. 配位化合物中的配体可以是分子也可以是阴离子
D. 共价键的形成条件是成键原子必须有未成对电子
D
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
2.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
B
解析:配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
3.下列微粒中含配位键的是( )
A.①②④⑦⑧
B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧
D.①②③④⑤⑥⑦⑧
解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子)有空轨道。
C
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
4. 某物质的结构如图所示:
下列有关该物质的分析中正确的是( )
A. 该物质分子中不存在σ键
B. 该物质的分子内只存在共价键和配位键两种作用力
C. 该物质是一种配合物,其中Ni为中心原子
D. 该物质的分子中C、N、O均存在孤电子对
C
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
5.胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图所示,下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化
B. 氧原子存在配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1
D. 胆矾中的水在不同温度下会分步失去
D
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
第三章 晶体结构与性质
第四节 配合物和超分子
选修二
原子结构与性质
素养目标
知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物 的存在与应用。认识配位键的特点与配位化合物某些性质的关系。
3. 了解人类探索物质结构的过程,认同“物质结构的探索是无止境的”观点,
了解从原子、分子、超分子等不同尺度认识物质结构的意义。
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
无水CuSO4是 色的,CuSO4·5H2O晶体是 色,
CuSO4 溶液是 色的。
FeCl3溶液是 色的,向溶液中滴加KSCN溶液,溶液变为 色。
白
蓝
蓝
棕黄
红
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
一、配合物
1.配位键
化合物 CuSO4 CuCl2 CuBr2 NaCl K2SO4 KBr
固体颜色 白色 绿色 深褐色 白色 白色 白色
溶液颜色
结论 呈蓝色的物质是水合铜离子,可表示为 ,叫做 。
(1)实验探究
四水合铜离子
[Cu(H2O)4]2+
无色
无色
无色
蓝色
蓝色
蓝色
孤电子对
配位键
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
(2)配位键
由一个原子单方面提供 而另一个原子接受孤电子对形成的共价键,即“电子对给予 —— 接受”键被称为 。
[Cu(H2O)4]2+可表示为:
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
(3)形成条件
形成配位键的一方(如A)是能够提供孤电子对的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。
①孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子
对。如 、 、 分子中中心原子分别有1、2、3对孤电子对。含有孤电子对的微粒:分子如CO、NH3、H2O等,离子如Cl-、CN-等。
②含有空轨道的微粒:过渡金属的原子或离子。一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固定的,如Ag+形成2个配位键,Cu2+形成4个配位键等。
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
深化拓展:配位键与非极性键、极性键的区别与联系
比较 共价键类型 非极性键 极性键 配位键
本质 相邻原子间的共用电子对(电子云重叠)与原子核间的静电作用 成键条件 (元素种类) 成键原子得、失电子 能力相同(同种元素) 成键原子得、失电子能力差别较小 (不同元素) 成键原子一方有孤电子对(配体),
另一方有空轨道(中心离子或原子)
特征 有方向性、饱和性 #0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
一、配合物
(1)概念
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
配合物[Cu(NH3)4]SO4的组成如下图所示:
(2)组成
配位键
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
①中心原子: 的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
②配体: 的阴离子或分子,如Cl-、NH3、H2O等。配体中
的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子等。
③配位数:直接与中心原子形成的 的数目。如[Fe(CN)6]4-中Fe2+的配位数为 。
提供空轨道接受孤电子对
提供孤电子对
直接同中心原子配位
配位键
6
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
(3)形成条3.配合物的形成实验件
实验 操作
实验 现象 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,滴加乙醇后析出深蓝色晶体 溶液颜色变成 红色 先产生白色沉淀,滴加氨水后白色沉淀溶解
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
有关离子方程式或化学方程式
Cu2++2NH3·H2O===Cu(OH)2↓+2
Cu(OH)2+4NH3=== [Cu(NH3)4](OH)2
[Cu(NH3)4]2++ +H2O=== [Cu(NH3)4]SO4·H2O↓
Fe3++3SCN-===Fe(SCN)3
Ag++Cl-===AgCl↓
AgCl+2NH3=== [Ag(NH3)2]Cl-
(1) 中的配位键与其他三个N—H键的键参数是否相同
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
提示: 相同。 可看成NH3分子结合1个H+后形成的,在NH3分子中中心原子氮采取sp3杂化,孤电子对占据一个杂化轨道,3个未成对电子分别占据另3个杂化轨道,分别结合3个H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当遇到H+时,N原子的孤电子对会进入H+的空轨道,以配位键形成 ,这样N原子就不再存在孤电子对,键角恢复至109°28',故 为正四面体形,4个N—H键完全相同,配位键与普通共价键形成过程不同,但各种键参数完全相同。
问题思考:
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
(2)配合物 [Cu(NH3)4]SO4 中含有的化学键类型有哪些
提示: [Cu(NH3)4]SO4 中含有的化学键有离子键、共价键和配位键。
(3)NH3 和 BF3 可以通过配位键形成 NH3·BF3 ,试分析提供孤电子对、空轨道的分别是哪种原子
提示: N 原子提供孤电子对,B 原子提供空轨道。
(4)配制银氨溶液时,向 AgNO3 溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么
提示: 氨水呈弱碱性,滴入 AgNO3 溶液中会生成 AgOH 白色沉淀;继续滴加氨水时,NH3 分子与 Ag+ 形成 [Ag(NH3)2]+ 配合离子,使 AgOH 逐渐溶解,反应过程如下:
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-。
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
4.配合物的形成对性质的影响
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
#0070C0
#00B0F0
课前篇素养初探
知识铺垫
必备知识
正误判断
配合物广泛存在于自然界中,跟人类生活有密切关系。例如,在人和动物体内起输送氧气作用的血红素,是 Fe2+ 的配合物。配合物在生产和科学技术方面的应用也很广泛。
5.配合物的用途
#0070C0
#00B0F0
二、超分子
由两种或两种以上的分子(包括离子)通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
1. 概念
2. 微粒间作用力—非共价键
主要是静电作用、范德华力和氢键等
3. 大小
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——分子识别:
a. 分离 C60 和 C70
C60
C70
这个例子反映出来的超分子的特性被称为“分子识别”。
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——分子识别:
b. 冠醚识别碱金属离子
C 原子:2×5 = 10 O 原子:5
10 + 5 = 15
15-冠-5 12-冠-4
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——分子识别:
冠醚环的大小与金属离子匹配,才能识别
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152) Na+(204) K+(276) Rb+(304) Cs+(334) 例如:冠醚识别钾离子
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——分子识别:
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
#0070C0
#00B0F0
二、超分子
4. 重要特征及其应用——超分子组装:
自组装
超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
细胞外部
磷脂分子
双分子层
细胞质
疏水端
亲水端
亲水端
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
小结
#0070C0
#00B0F0
随堂练习
1. 下列各种说法中错误的是( )
A. 形成配位键的条件是一方有空轨道,一方有孤电子对
B. 配位键是一种特殊的共价键
C. 配位化合物中的配体可以是分子也可以是阴离子
D. 共价键的形成条件是成键原子必须有未成对电子
D
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
2.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
B
解析:配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
3.下列微粒中含配位键的是( )
A.①②④⑦⑧
B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧
D.①②③④⑤⑥⑦⑧
解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子)有空轨道。
C
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
4. 某物质的结构如图所示:
下列有关该物质的分析中正确的是( )
A. 该物质分子中不存在σ键
B. 该物质的分子内只存在共价键和配位键两种作用力
C. 该物质是一种配合物,其中Ni为中心原子
D. 该物质的分子中C、N、O均存在孤电子对
C
#0070C0
#00B0F0
课前篇素养提升
探究
素养脉络
随堂检测
5.胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图所示,下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化
B. 氧原子存在配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1
D. 胆矾中的水在不同温度下会分步失去
D
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
