1.1《有机化合物的结构特点》(第2课时)课件(共32张PPT)
文档属性
| 名称 | 1.1《有机化合物的结构特点》(第2课时)课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 07:05:49 | ||
图片预览









文档简介
(共32张PPT)
第一章第一节
选修三
有机化合物的
结构特点
第2课时
课程目标
1、进一步认识碳原子的成键特点;
2、掌握同分异构现象的含义,会判断同分异构体;
3、初步学会同分异构体的书写。
有机化合物的成键特点;有机化合物的同分异构现象。
有机化合物同分异构体的书写。
教学重点
教学难点
新课导入
在有机化合物分子中,碳原子通过共用电子对与其他原子相连接形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大的影响。
选修三
新高 新理念 新标准
有机化合物中
的共价键
01
有机化合物中的共价键
1、共价键的类型
原子轨道沿着两个原子核间的 ,以“ ”的形式相互重叠,形成σ键。
通过σ键连接的原子或原子团 绕键轴旋转而不会导致化学键的破坏。
①σ键
(1)类型
键轴
头碰头
可
形成
特点
有机化合物中的共价键
1、共价键的类型
(1)类型
形成
特点
②π键
原子轨道以“ ”的形式从 重叠,形成了π键。
特点:π键的轨道重叠程度比σ键的 , σ键牢固,比较
断裂而发生化学反应。通过π键连接的原子或原子团 绕键轴旋转。
肩并肩
侧面
小
不如
容易
不能
有机化合物中的共价键
1、共价键的类型
(1)实例
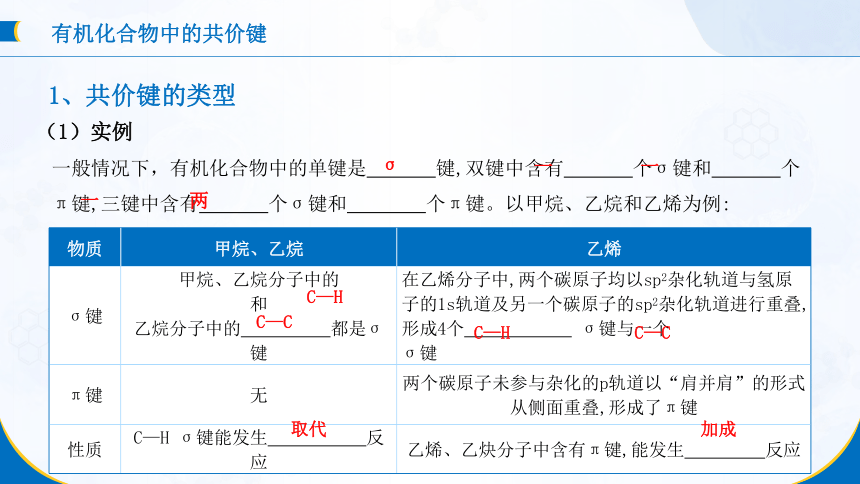
一般情况下,有机化合物中的单键是 键,双键中含有 个σ键和 个π键,三键中含有 个σ键和 个π键。以甲烷、乙烷和乙烯为例:
物质 甲烷、乙烷 乙烯
σ键 甲烷、乙烷分子中的 和 乙烷分子中的 都是σ键 在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的sp2杂化轨道进行重叠,形成4个 σ键与一个 σ键
π键 无 两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键
性质 C—H σ键能发生 反应 乙烯、乙炔分子中含有π键,能发生 反应
σ
一
一
一
两
C—H
C—C
C—H
C—C
加成
取代
有机化合物中的共价键
2、共价键的极性与有机反应
(1)电负性与共价键极性的关系
原子间电负性的差异越大→共用电子对偏移的程度 →共价键极性 ,在反应中越 发生断裂→ 及其邻近的化学键往往是发生化学反应的活性部位。
越大
越强
容易
官能团
有机化合物中的共价键
2、共价键的极性与有机反应
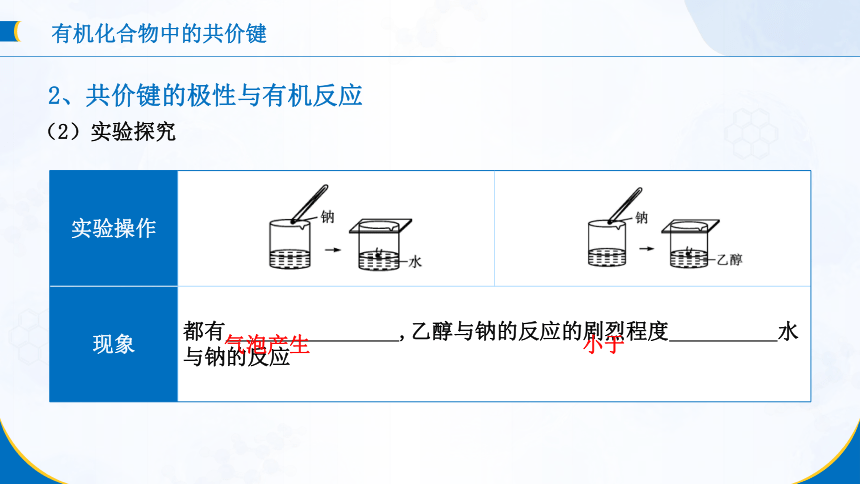
(2)实验探究
实验操作
现象 都有 ,乙醇与钠的反应的剧烈程度 水与钠的反应 气泡产生
小于
有机化合物中的共价键
2、共价键的极性与有机反应
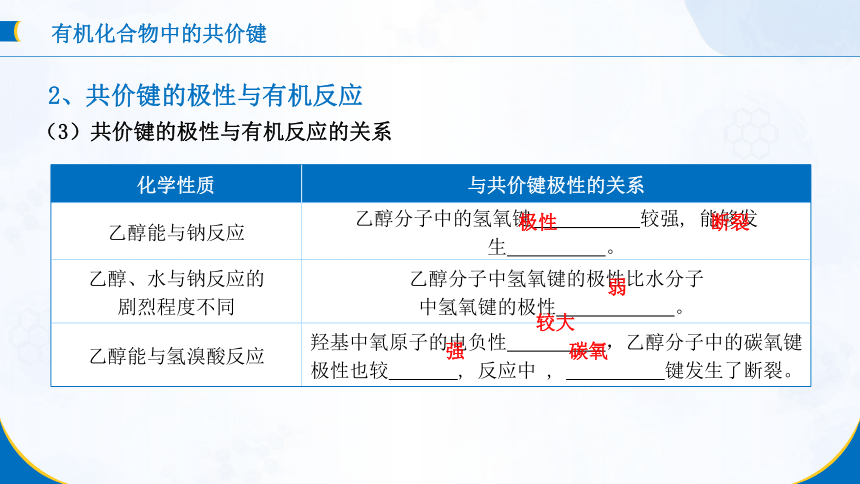
(3)共价键的极性与有机反应的关系
化学性质 与共价键极性的关系
乙醇能与钠反应 乙醇分子中的氢氧键 较强, 能够发生 。
乙醇、水与钠反应的 剧烈程度不同 乙醇分子中氢氧键的极性比水分子
中氢氧键的极性 。
乙醇能与氢溴酸反应 羟基中氧原子的电负性 ,乙醇分子中的碳氧键
极性也较 , 反应中 , 键发生了断裂。
极性
断裂
弱
较大
强
碳氧
有机化合物中的共价键
2、共价键的极性与有机反应
(4)有机反应的特点
共价键的断裂需要 能量,而且有机化合物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率 ,副反应 ,产物比较复杂。
吸收
较小
较多
有机化合物中的共价键
(1)σ键比π键牢固,所以不会断裂( )
(2)甲烷分子中只有C—H σ键,只能发生取代反应( )
(3)乙烯分子中含有π键,所以化学性质比甲烷活泼( )
(4)乙酸与钠反应比水与钠反应更剧烈,是因为乙酸分子中氢氧键的极性更强( )
正误判断
×
×
√
√
_______________________________________________________________。
有机化合物中的共价键
深度思考
1.某有机物分子的结构简式为 ,该分子中有 个σ键, 个π键,
(填“有”或“没有”)非极性键。根据共价键的类型和极性可推测该物质可发生 反应和 反应,与钠反应的剧烈程度比水与钠反应的 。原因是
8
2
有
加成
取代
大
CH2==CHCOOH中 中的氢氧键受酮羰基影响,极性更强,更易断裂
C
OH
O
有机化合物中的共价键
深度思考
2. (1)在CH4+Cl2 CH3Cl+HCl反应中,CH4断裂的化学键是 ,具有
性,可断裂,所以能够发生 反应。
C—H
极
取代
5
1
π
加成
(2)在CH2==CH2+Br2―→CH2Br—CH2Br反应中,CH2==CH2分子中含有__个σ键, 个π键, 键更易断裂,所以乙烯与Br2发生的是 反应。
选修三
有机化合物的
同分异构现象
02
有机化合物的同分异构现象
1、同分异构体
思考与讨论
物质名称 正戊烷 异戊烷 新戊烷
结构简式
相同点 不同点 戊烷(C5H12)的三种同分异构体的结构如图所示,回忆同分异构体的知识,完成下表。
CH3CH2CH2CH2CH3
CH3 CH(CH3)CH2CH3
CH3 C(CH3)2 CH3
分子式相同
碳架异构
有机化合物的同分异构现象
1、同分异构体
(1)同分异构现象:化合物具有相同的分子式 ,但具有不同结构的现象。
(2)同分异构体:具有同分异构现象的化合物。
(3)同分异构现象分类
有机化合物中碳原子数目越多,其同分异构体的数目越多。
学生活动
阅读教材p9 表1-2,总结同分异构体的书写
有机化合物的同分异构现象
2、烷烃同分异构体的书写
(1)遵循的原则:主链由长到短,支链由整到散;位置由心到边,排列由对到邻、间。
(2)书写的步骤(以书写C5H12同分异构体为例)
a. 将分子中全部碳原子连成直链作为主链。
C—C—C—C—C
b. 从主链一端取下一个碳原子作为支链(即甲基),依次连在主链中心对称线(虚线)一侧的各个碳原子上,此时碳骨架只有一种。
有机化合物的同分异构现象
2、烷烃同分异构体的书写
注意 甲基不能连在①位和④位上,否则会使碳链变长,②位和③位等效,只能用一个,否则重复。
c.从主链上取下两个碳原子作为一个支链(即乙基)或两个支链(即2个甲基)依次连在主链中心对称线一侧或两侧的各个碳原子上,此时碳骨架结构只有一种。
注意 ②位上不能连乙基,否则会使主链上有4个碳原子,使主链变长。
有机化合物的同分异构现象
2、烷烃同分异构体的书写
综上所述,C5H12共有3种同分异构体,分别为CH3CH2CH2CH2CH3、
和 。
练一练
写出C6H14所有有机物的结构简式:___________________________________
__________________________________________________________________________
_______________________。
CH3CH2CH2CH2CH2CH3、
练一练
提示
第一步:写出最长碳链(只写出了碳,氢原子根据“碳满四价”补足),得到1种异构体:
C—C—C—C—C—C;
第二步:去掉最长碳链中1个碳原子作为支链(取代基),余下碳原子作为主链,依次找出支链在主链中的可能位置(*表示取代基连接在主链上碳的位置)。注意主链结构的对称性和等同性:
和 ;
练一练
第三步:去掉最长链中两个碳原子作为支链(两个—CH3),采用“定一移二”法依次书写
第四步:最后用氢原子补足碳原子的四个价键。
故C6H14的同分异构体有CH3CH2CH2CH2CH2CH3、
和 ;
练一练
在表示有机化合物的组成和结构时,将 元素符号省略,只表示分子中键的连接情况和 ,每个拐点或终点均表示有一个 ,这样得到的式子称为键线式。例如:丙烯可表示为 ,乙醇可表示为 。
3、键线式
碳、氢
官能团
碳原子
总结归纳
1、有机化合物键线式书写时的注意事项
(1) 一般表示含有3个及3个以上碳原子的有机化合物。
(2) 只忽略C—H,其余的化学键不能忽略。
(3) 碳、氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中的氢原子)。
(4) 由键线式写分子式时不能忘记两端的碳原子。
总结归纳
2、有机化合物组成和结构的几种表达式转换关系
随堂演练
1. 下列有关物质的表达式正确的是
A. 乙炔分子的球棍模型:
B. 羟基的电子式:
C. 2-氯丙烷的结构简式:CH3CHClCH3
D. 丙烯的键线式:
√
课堂练习
2. 下列分子中,既有非极性键又含有π键的分子是
A. C2H4Cl2 B. HCHO
C. H2O D. CH2==CH—CH3
√
CH2==CH—CH3中存在C==C、C—C非极性键,C==C中含有π键。
解析
随堂演练
3. 下列各组物质中,互为同分异构体的是
A. 与
B. HC≡C—(CH2)3CH3 与
C. CH3CH2OCH2CH3 与
D. 与
√
随堂演练
4. 下列属于官能团异构的是
A. CH3CH2CH2CH3 和 CH3CH(CH3)2
B. CH2==C(CH3)2 和 CH3CH==CHCH3
C. CH3CH2OH 和 CH3OCH3
D. CH3CH2CH2COOH 和 CH3COOCH2CH2CH3
√
选修三
感谢您的观看
THANK
第一章第一节
选修三
有机化合物的
结构特点
第2课时
课程目标
1、进一步认识碳原子的成键特点;
2、掌握同分异构现象的含义,会判断同分异构体;
3、初步学会同分异构体的书写。
有机化合物的成键特点;有机化合物的同分异构现象。
有机化合物同分异构体的书写。
教学重点
教学难点
新课导入
在有机化合物分子中,碳原子通过共用电子对与其他原子相连接形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大的影响。
选修三
新高 新理念 新标准
有机化合物中
的共价键
01
有机化合物中的共价键
1、共价键的类型
原子轨道沿着两个原子核间的 ,以“ ”的形式相互重叠,形成σ键。
通过σ键连接的原子或原子团 绕键轴旋转而不会导致化学键的破坏。
①σ键
(1)类型
键轴
头碰头
可
形成
特点
有机化合物中的共价键
1、共价键的类型
(1)类型
形成
特点
②π键
原子轨道以“ ”的形式从 重叠,形成了π键。
特点:π键的轨道重叠程度比σ键的 , σ键牢固,比较
断裂而发生化学反应。通过π键连接的原子或原子团 绕键轴旋转。
肩并肩
侧面
小
不如
容易
不能
有机化合物中的共价键
1、共价键的类型
(1)实例
一般情况下,有机化合物中的单键是 键,双键中含有 个σ键和 个π键,三键中含有 个σ键和 个π键。以甲烷、乙烷和乙烯为例:
物质 甲烷、乙烷 乙烯
σ键 甲烷、乙烷分子中的 和 乙烷分子中的 都是σ键 在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的sp2杂化轨道进行重叠,形成4个 σ键与一个 σ键
π键 无 两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键
性质 C—H σ键能发生 反应 乙烯、乙炔分子中含有π键,能发生 反应
σ
一
一
一
两
C—H
C—C
C—H
C—C
加成
取代
有机化合物中的共价键
2、共价键的极性与有机反应
(1)电负性与共价键极性的关系
原子间电负性的差异越大→共用电子对偏移的程度 →共价键极性 ,在反应中越 发生断裂→ 及其邻近的化学键往往是发生化学反应的活性部位。
越大
越强
容易
官能团
有机化合物中的共价键
2、共价键的极性与有机反应
(2)实验探究
实验操作
现象 都有 ,乙醇与钠的反应的剧烈程度 水与钠的反应 气泡产生
小于
有机化合物中的共价键
2、共价键的极性与有机反应
(3)共价键的极性与有机反应的关系
化学性质 与共价键极性的关系
乙醇能与钠反应 乙醇分子中的氢氧键 较强, 能够发生 。
乙醇、水与钠反应的 剧烈程度不同 乙醇分子中氢氧键的极性比水分子
中氢氧键的极性 。
乙醇能与氢溴酸反应 羟基中氧原子的电负性 ,乙醇分子中的碳氧键
极性也较 , 反应中 , 键发生了断裂。
极性
断裂
弱
较大
强
碳氧
有机化合物中的共价键
2、共价键的极性与有机反应
(4)有机反应的特点
共价键的断裂需要 能量,而且有机化合物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率 ,副反应 ,产物比较复杂。
吸收
较小
较多
有机化合物中的共价键
(1)σ键比π键牢固,所以不会断裂( )
(2)甲烷分子中只有C—H σ键,只能发生取代反应( )
(3)乙烯分子中含有π键,所以化学性质比甲烷活泼( )
(4)乙酸与钠反应比水与钠反应更剧烈,是因为乙酸分子中氢氧键的极性更强( )
正误判断
×
×
√
√
_______________________________________________________________。
有机化合物中的共价键
深度思考
1.某有机物分子的结构简式为 ,该分子中有 个σ键, 个π键,
(填“有”或“没有”)非极性键。根据共价键的类型和极性可推测该物质可发生 反应和 反应,与钠反应的剧烈程度比水与钠反应的 。原因是
8
2
有
加成
取代
大
CH2==CHCOOH中 中的氢氧键受酮羰基影响,极性更强,更易断裂
C
OH
O
有机化合物中的共价键
深度思考
2. (1)在CH4+Cl2 CH3Cl+HCl反应中,CH4断裂的化学键是 ,具有
性,可断裂,所以能够发生 反应。
C—H
极
取代
5
1
π
加成
(2)在CH2==CH2+Br2―→CH2Br—CH2Br反应中,CH2==CH2分子中含有__个σ键, 个π键, 键更易断裂,所以乙烯与Br2发生的是 反应。
选修三
有机化合物的
同分异构现象
02
有机化合物的同分异构现象
1、同分异构体
思考与讨论
物质名称 正戊烷 异戊烷 新戊烷
结构简式
相同点 不同点 戊烷(C5H12)的三种同分异构体的结构如图所示,回忆同分异构体的知识,完成下表。
CH3CH2CH2CH2CH3
CH3 CH(CH3)CH2CH3
CH3 C(CH3)2 CH3
分子式相同
碳架异构
有机化合物的同分异构现象
1、同分异构体
(1)同分异构现象:化合物具有相同的分子式 ,但具有不同结构的现象。
(2)同分异构体:具有同分异构现象的化合物。
(3)同分异构现象分类
有机化合物中碳原子数目越多,其同分异构体的数目越多。
学生活动
阅读教材p9 表1-2,总结同分异构体的书写
有机化合物的同分异构现象
2、烷烃同分异构体的书写
(1)遵循的原则:主链由长到短,支链由整到散;位置由心到边,排列由对到邻、间。
(2)书写的步骤(以书写C5H12同分异构体为例)
a. 将分子中全部碳原子连成直链作为主链。
C—C—C—C—C
b. 从主链一端取下一个碳原子作为支链(即甲基),依次连在主链中心对称线(虚线)一侧的各个碳原子上,此时碳骨架只有一种。
有机化合物的同分异构现象
2、烷烃同分异构体的书写
注意 甲基不能连在①位和④位上,否则会使碳链变长,②位和③位等效,只能用一个,否则重复。
c.从主链上取下两个碳原子作为一个支链(即乙基)或两个支链(即2个甲基)依次连在主链中心对称线一侧或两侧的各个碳原子上,此时碳骨架结构只有一种。
注意 ②位上不能连乙基,否则会使主链上有4个碳原子,使主链变长。
有机化合物的同分异构现象
2、烷烃同分异构体的书写
综上所述,C5H12共有3种同分异构体,分别为CH3CH2CH2CH2CH3、
和 。
练一练
写出C6H14所有有机物的结构简式:___________________________________
__________________________________________________________________________
_______________________。
CH3CH2CH2CH2CH2CH3、
练一练
提示
第一步:写出最长碳链(只写出了碳,氢原子根据“碳满四价”补足),得到1种异构体:
C—C—C—C—C—C;
第二步:去掉最长碳链中1个碳原子作为支链(取代基),余下碳原子作为主链,依次找出支链在主链中的可能位置(*表示取代基连接在主链上碳的位置)。注意主链结构的对称性和等同性:
和 ;
练一练
第三步:去掉最长链中两个碳原子作为支链(两个—CH3),采用“定一移二”法依次书写
第四步:最后用氢原子补足碳原子的四个价键。
故C6H14的同分异构体有CH3CH2CH2CH2CH2CH3、
和 ;
练一练
在表示有机化合物的组成和结构时,将 元素符号省略,只表示分子中键的连接情况和 ,每个拐点或终点均表示有一个 ,这样得到的式子称为键线式。例如:丙烯可表示为 ,乙醇可表示为 。
3、键线式
碳、氢
官能团
碳原子
总结归纳
1、有机化合物键线式书写时的注意事项
(1) 一般表示含有3个及3个以上碳原子的有机化合物。
(2) 只忽略C—H,其余的化学键不能忽略。
(3) 碳、氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中的氢原子)。
(4) 由键线式写分子式时不能忘记两端的碳原子。
总结归纳
2、有机化合物组成和结构的几种表达式转换关系
随堂演练
1. 下列有关物质的表达式正确的是
A. 乙炔分子的球棍模型:
B. 羟基的电子式:
C. 2-氯丙烷的结构简式:CH3CHClCH3
D. 丙烯的键线式:
√
课堂练习
2. 下列分子中,既有非极性键又含有π键的分子是
A. C2H4Cl2 B. HCHO
C. H2O D. CH2==CH—CH3
√
CH2==CH—CH3中存在C==C、C—C非极性键,C==C中含有π键。
解析
随堂演练
3. 下列各组物质中,互为同分异构体的是
A. 与
B. HC≡C—(CH2)3CH3 与
C. CH3CH2OCH2CH3 与
D. 与
√
随堂演练
4. 下列属于官能团异构的是
A. CH3CH2CH2CH3 和 CH3CH(CH3)2
B. CH2==C(CH3)2 和 CH3CH==CHCH3
C. CH3CH2OH 和 CH3OCH3
D. CH3CH2CH2COOH 和 CH3COOCH2CH2CH3
√
选修三
感谢您的观看
THANK
