1.2《研究有机化合物的一般方法》(第1课时)课件(共28张PPT)
文档属性
| 名称 | 1.2《研究有机化合物的一般方法》(第1课时)课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 07:45:11 | ||
图片预览




文档简介
(共28张PPT)
选修三
STRUCTURAL CHARACTERISTICS
有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第1课时
第一章
1.通过对蒸馏法、萃取法、重结晶法实验原理和基本操作的学习,认
识科学探究过程的步骤,学会设计科学探究方案,培养严谨的科学
态度和科学的思维方式。
2.结合常见有机化合物分离、提纯方法的学习,能根据有机化合物性
质的差异选择有机化合物分离、提纯的正确方法。
核心素养
青蒿素的
提取
葛洪《肘后备急方》 “青蒿一握,以水升渍,绞取汁,尽服之。
采用低沸点的乙醚提取青蒿中的提取物,得到了对疟原虫抑制率可达百分之百的提取物,被命名为青蒿素。
确定青蒿素分子量分子式
确定结构
成功合成了青蒿素
新课导入
分离提纯
确定实验室
确定分子式
确定分子结构
一、研究有机化合物的一般方法
分离、提纯原则
不增加新的杂质
不减少被提纯的物质
被提纯物质和杂质易分离
被提纯物质易恢复原状态
分离、提纯方法
蒸馏
萃取
重结晶
二、分离、提纯
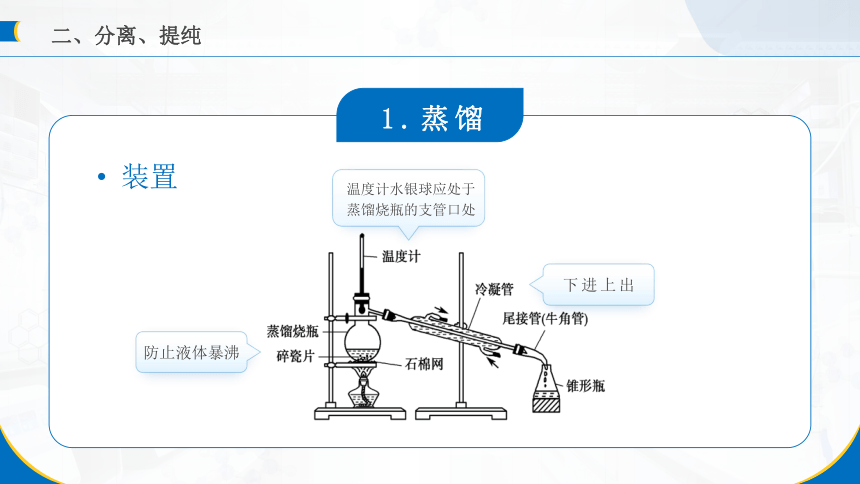
1.蒸馏
蒸馏原理
在一定温度和压强下,加热液态混合物,利用物质沸点差异进行物质分离的方法,使沸点低的物质汽化,然后冷凝、收集,从而达到与沸点高的物质相分离的目的。
适用条件
①有机物稳定性较强;
②有机物与杂质的沸点相差较大(一般约大于30 ℃)。
二、分离、提纯
1.蒸馏
装置
温度计水银球应处于蒸馏烧瓶的支管口处
下进上出
防止液体暴沸
二、分离、提纯
1.蒸馏
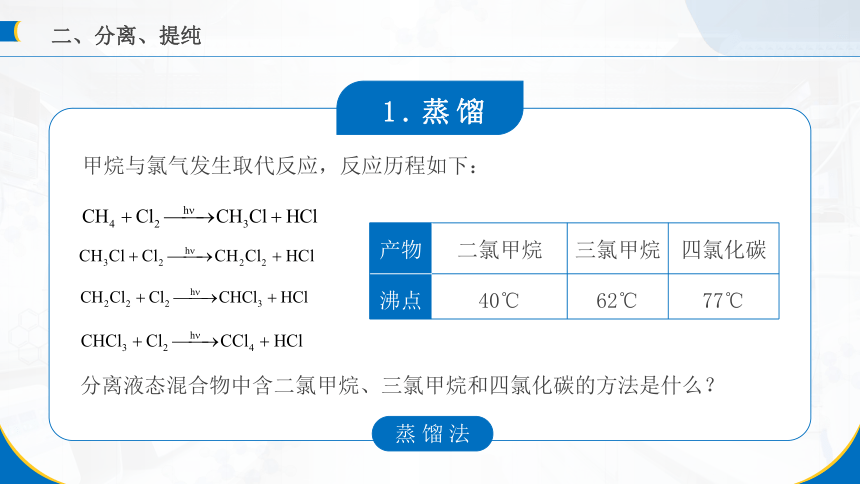
产物 二氯甲烷 三氯甲烷 四氯化碳
沸点 40℃ 62℃ 77℃
甲烷与氯气发生取代反应,反应历程如下:
分离液态混合物中含二氯甲烷、三氯甲烷和四氯化碳的方法是什么?
蒸馏法
二、分离、提纯
含有杂质的工业乙醇的蒸馏
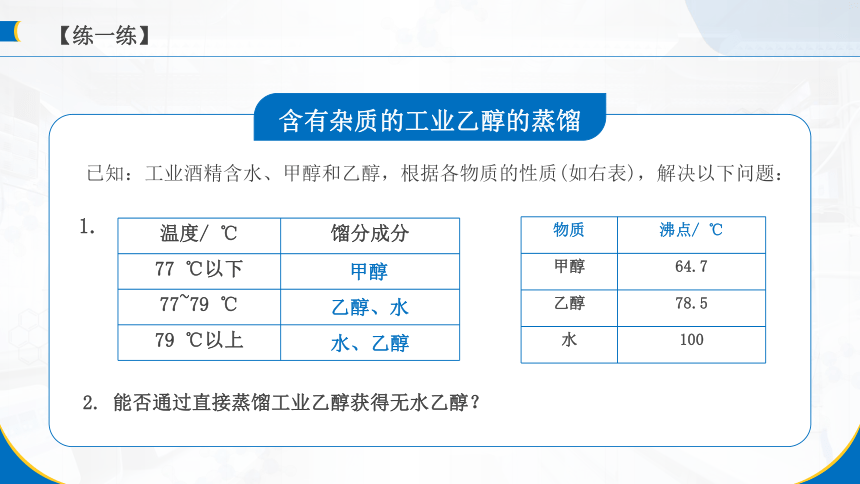
物质 沸点/ ℃
甲醇 64.7
乙醇 78.5
水 100
温度/ ℃ 馏分成分
77 ℃以下
77~79 ℃
79 ℃以上
已知:工业酒精含水、甲醇和乙醇,根据各物质的性质(如右表),解决以下问题:
1.
2. 能否通过直接蒸馏工业乙醇获得无水乙醇?
甲醇
乙醇、水
水、乙醇
【练一练】
固液混合物分离为什么用蒸馏而不用过滤?
工业酒精
蒸馏
95.6%乙醇
无水乙醇
CaO
蒸馏
原因:
①CaO与水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔;
②少量Ca2+、OH— 等离子会透过滤纸使乙醇不纯。
【练一练】
2.萃取
液-液萃取
利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂中的过程
固-液萃取
用有机溶剂从固体混合物中溶解出有机物的过程
二、分离、提纯
2.萃取
分液漏斗
烧杯
对分液漏斗进行检漏
检漏
关闭活塞,把原溶液漏斗中,加萃取剂后,盖上分液漏斗的玻璃塞,充分振荡,静置分层
萃取
把玻璃塞取下,打开分液漏斗活塞,下口将下层液体放出,及时关闭活塞,上层液体从上口倒出
分液
装置
二、分离、提纯
2.萃取
常见的萃取剂
乙醚(C2H5OC2H5)、乙酸乙酯、二氯甲烷
萃取剂的选择条件
萃取剂与原溶剂互不相溶
溶质在萃取剂中的溶解度大、
萃取剂与溶液中的成分不发生反应
二、分离、提纯
分液:
将萃取后两种互不相溶的液体分开的操作。
注意事项:
1.取下分液漏斗上方的玻璃塞;
2.旋转下方的活塞,使塞上的凹槽对准漏斗口上的小孔;
3.分液漏斗下端紧靠烧杯内壁;
4.下层液体从下口放出,上层液体从上口倒出。
二、分离、提纯
1. 以下关于萃取操作的叙述中,正确的是
√
A. 把混合液体转移至分液漏斗,塞上玻璃塞,如图用力振荡
B. 振荡几次后需打开分液漏斗上口的玻璃塞放气
C. 经几次振荡并放气后,手持分液漏斗静置待液体分层
D. 分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏
斗上的小孔,再打开活塞
二、分离、提纯
在洗涤、分液操作中,应充分振荡,然后静置,待分层后操作正确的是
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
√
解析 乙酸异戊酯的密度比水的密度小,分液时在上层,应先将水层从分液漏斗的
下口放出,再将乙酸异戊酯从上口倒出。
物质 相对分子质量 密度/(g·cm-3) 沸点/℃ 水中溶解度
乙酸异戊酯 130 0.867 0 142 难溶
2. 实验室制备乙酸异戊酯的有关信息如下:
二、分离、提纯
3.重结晶
二、分离、提纯
重结晶常用于分离、提纯固态有机物。
⑴提纯原理:
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
⑵溶剂选择:
如果重结晶所得的晶体纯度不能达到要求,可以再次重结晶以提高纯度。
①选择适当的溶剂,要求杂质在此溶剂中溶解度很小或很大,易于除去。
②被提纯的有机物在此溶剂中的溶解度受温度影响较大,能够进行冷却结晶。
③溶剂毒性小,容易获得,不与被提纯物质反应。
【探究】
重结晶法提纯苯甲酸
【探究】
重结晶法提纯苯甲酸
【探究】
重结晶法提纯苯甲酸
【讨论】(1)重结晶法提纯苯甲酸的原理是什么 有哪些主要操作步骤
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,过滤,洗涤
加热溶解→趁热过滤→冷却结晶→过滤、洗涤→干燥→称重
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
滤液
残渣(不溶性杂质)
不纯固体物质
【探究】
重结晶法提纯苯甲酸
加热
溶解
趁热过滤
冷却结晶
所需仪器:
玻璃棒、烧杯、石棉网、三脚架、酒精灯、漏斗、铁架台
【探究】
重结晶法提纯苯甲酸
(1) 重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
(2) 溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
原理:泥沙难溶于水,氯化钠易溶于水,苯甲酸在水中的溶解度受温度影响较大。
步骤:加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤,洗涤,干燥。
加热:促进苯甲酸溶解。
趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出。
【探究】
重结晶法提纯苯甲酸
(3)实验中多次使用了玻璃棒,分别起到哪些作用?
(4)如何检验提纯后的苯甲酸中氯化钠已被除净?
①溶解时搅拌,加快溶解速度;②过滤、洗涤时引流;③干燥时用于转移晶体。
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,证明氯化钠已被除净。
课堂小结
分离、提纯
蒸馏
萃取
重结晶
随堂演练
1.下列方法可用于提纯液态有机化合物的是
A.过滤 B.蒸馏
C.重结晶 D.萃取
√
随堂演练
2.下列操作中选择的仪器正确的是
①分离汽油和氯化钠溶液
②从含Fe3+的自来水中得到蒸馏水
③分离氯化钾和二氧化锰混合物
④从食盐水中提取溶质
A.①—丁 ②—丙 ③—甲 ④—乙
B.①—乙 ②—丙 ③—甲 ④—丁
C.①—丁 ②—丙 ③—乙 ④—甲
D.①—丙 ②—乙 ③—丁 ④—甲
√
随堂演练
3.下列有关实验的说法错误的是
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和硝基苯的混合物
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大
√
感谢您的观看
THANK YOU FOR WATCHING
选修三
第二节 研究有机化合物的一般方法
第1课时
第一章
选修三
STRUCTURAL CHARACTERISTICS
有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第1课时
第一章
1.通过对蒸馏法、萃取法、重结晶法实验原理和基本操作的学习,认
识科学探究过程的步骤,学会设计科学探究方案,培养严谨的科学
态度和科学的思维方式。
2.结合常见有机化合物分离、提纯方法的学习,能根据有机化合物性
质的差异选择有机化合物分离、提纯的正确方法。
核心素养
青蒿素的
提取
葛洪《肘后备急方》 “青蒿一握,以水升渍,绞取汁,尽服之。
采用低沸点的乙醚提取青蒿中的提取物,得到了对疟原虫抑制率可达百分之百的提取物,被命名为青蒿素。
确定青蒿素分子量分子式
确定结构
成功合成了青蒿素
新课导入
分离提纯
确定实验室
确定分子式
确定分子结构
一、研究有机化合物的一般方法
分离、提纯原则
不增加新的杂质
不减少被提纯的物质
被提纯物质和杂质易分离
被提纯物质易恢复原状态
分离、提纯方法
蒸馏
萃取
重结晶
二、分离、提纯
1.蒸馏
蒸馏原理
在一定温度和压强下,加热液态混合物,利用物质沸点差异进行物质分离的方法,使沸点低的物质汽化,然后冷凝、收集,从而达到与沸点高的物质相分离的目的。
适用条件
①有机物稳定性较强;
②有机物与杂质的沸点相差较大(一般约大于30 ℃)。
二、分离、提纯
1.蒸馏
装置
温度计水银球应处于蒸馏烧瓶的支管口处
下进上出
防止液体暴沸
二、分离、提纯
1.蒸馏
产物 二氯甲烷 三氯甲烷 四氯化碳
沸点 40℃ 62℃ 77℃
甲烷与氯气发生取代反应,反应历程如下:
分离液态混合物中含二氯甲烷、三氯甲烷和四氯化碳的方法是什么?
蒸馏法
二、分离、提纯
含有杂质的工业乙醇的蒸馏
物质 沸点/ ℃
甲醇 64.7
乙醇 78.5
水 100
温度/ ℃ 馏分成分
77 ℃以下
77~79 ℃
79 ℃以上
已知:工业酒精含水、甲醇和乙醇,根据各物质的性质(如右表),解决以下问题:
1.
2. 能否通过直接蒸馏工业乙醇获得无水乙醇?
甲醇
乙醇、水
水、乙醇
【练一练】
固液混合物分离为什么用蒸馏而不用过滤?
工业酒精
蒸馏
95.6%乙醇
无水乙醇
CaO
蒸馏
原因:
①CaO与水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔;
②少量Ca2+、OH— 等离子会透过滤纸使乙醇不纯。
【练一练】
2.萃取
液-液萃取
利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂中的过程
固-液萃取
用有机溶剂从固体混合物中溶解出有机物的过程
二、分离、提纯
2.萃取
分液漏斗
烧杯
对分液漏斗进行检漏
检漏
关闭活塞,把原溶液漏斗中,加萃取剂后,盖上分液漏斗的玻璃塞,充分振荡,静置分层
萃取
把玻璃塞取下,打开分液漏斗活塞,下口将下层液体放出,及时关闭活塞,上层液体从上口倒出
分液
装置
二、分离、提纯
2.萃取
常见的萃取剂
乙醚(C2H5OC2H5)、乙酸乙酯、二氯甲烷
萃取剂的选择条件
萃取剂与原溶剂互不相溶
溶质在萃取剂中的溶解度大、
萃取剂与溶液中的成分不发生反应
二、分离、提纯
分液:
将萃取后两种互不相溶的液体分开的操作。
注意事项:
1.取下分液漏斗上方的玻璃塞;
2.旋转下方的活塞,使塞上的凹槽对准漏斗口上的小孔;
3.分液漏斗下端紧靠烧杯内壁;
4.下层液体从下口放出,上层液体从上口倒出。
二、分离、提纯
1. 以下关于萃取操作的叙述中,正确的是
√
A. 把混合液体转移至分液漏斗,塞上玻璃塞,如图用力振荡
B. 振荡几次后需打开分液漏斗上口的玻璃塞放气
C. 经几次振荡并放气后,手持分液漏斗静置待液体分层
D. 分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏
斗上的小孔,再打开活塞
二、分离、提纯
在洗涤、分液操作中,应充分振荡,然后静置,待分层后操作正确的是
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
√
解析 乙酸异戊酯的密度比水的密度小,分液时在上层,应先将水层从分液漏斗的
下口放出,再将乙酸异戊酯从上口倒出。
物质 相对分子质量 密度/(g·cm-3) 沸点/℃ 水中溶解度
乙酸异戊酯 130 0.867 0 142 难溶
2. 实验室制备乙酸异戊酯的有关信息如下:
二、分离、提纯
3.重结晶
二、分离、提纯
重结晶常用于分离、提纯固态有机物。
⑴提纯原理:
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
⑵溶剂选择:
如果重结晶所得的晶体纯度不能达到要求,可以再次重结晶以提高纯度。
①选择适当的溶剂,要求杂质在此溶剂中溶解度很小或很大,易于除去。
②被提纯的有机物在此溶剂中的溶解度受温度影响较大,能够进行冷却结晶。
③溶剂毒性小,容易获得,不与被提纯物质反应。
【探究】
重结晶法提纯苯甲酸
【探究】
重结晶法提纯苯甲酸
【探究】
重结晶法提纯苯甲酸
【讨论】(1)重结晶法提纯苯甲酸的原理是什么 有哪些主要操作步骤
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,过滤,洗涤
加热溶解→趁热过滤→冷却结晶→过滤、洗涤→干燥→称重
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
滤液
残渣(不溶性杂质)
不纯固体物质
【探究】
重结晶法提纯苯甲酸
加热
溶解
趁热过滤
冷却结晶
所需仪器:
玻璃棒、烧杯、石棉网、三脚架、酒精灯、漏斗、铁架台
【探究】
重结晶法提纯苯甲酸
(1) 重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
(2) 溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
原理:泥沙难溶于水,氯化钠易溶于水,苯甲酸在水中的溶解度受温度影响较大。
步骤:加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤,洗涤,干燥。
加热:促进苯甲酸溶解。
趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出。
【探究】
重结晶法提纯苯甲酸
(3)实验中多次使用了玻璃棒,分别起到哪些作用?
(4)如何检验提纯后的苯甲酸中氯化钠已被除净?
①溶解时搅拌,加快溶解速度;②过滤、洗涤时引流;③干燥时用于转移晶体。
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,证明氯化钠已被除净。
课堂小结
分离、提纯
蒸馏
萃取
重结晶
随堂演练
1.下列方法可用于提纯液态有机化合物的是
A.过滤 B.蒸馏
C.重结晶 D.萃取
√
随堂演练
2.下列操作中选择的仪器正确的是
①分离汽油和氯化钠溶液
②从含Fe3+的自来水中得到蒸馏水
③分离氯化钾和二氧化锰混合物
④从食盐水中提取溶质
A.①—丁 ②—丙 ③—甲 ④—乙
B.①—乙 ②—丙 ③—甲 ④—丁
C.①—丁 ②—丙 ③—乙 ④—甲
D.①—丙 ②—乙 ③—丁 ④—甲
√
随堂演练
3.下列有关实验的说法错误的是
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和硝基苯的混合物
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大
√
感谢您的观看
THANK YOU FOR WATCHING
选修三
第二节 研究有机化合物的一般方法
第1课时
第一章
