2.1《烷烃》课件(共31张PPT)
文档属性
| 名称 | 2.1《烷烃》课件(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 07:47:16 | ||
图片预览







文档简介
(共31张PPT)
第二章
选修三
第一节 烷烃
SECTION 3 AROMATIC HYDROCARBONS
第1课时
新高考 新理念 新标准
核心素养
1. 知道烷烃的物理性质的变化与分子中碳原子数目的关系。
2. 认识烷烃的结构特征,能以典型代表物为例,理解烷烃的化学性质。
生活中常见的烃
新课导入
新课导入
烃
定义
分类
仅含碳和氢两种元素的有机化合物
烷烃
烯烃
炔烃
芳香烃
结构不同
新课导入
预测
烃分子可能的断键部位与相应反应类型的主要依据
碳原子的饱和程度和化学键的类型
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷
乙烷
丙烷
正丁烷
正戊烷
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH4
C2H6
C3H8
C4H10
C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
一、烷烃的结构
一、烷烃的结构
烷烃的结构与甲烷的相似,其分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。
烷烃分子中的共价键全部是单键
烷烃同系物的通式:CnH2n+2
同系物:像甲烷、乙烷、丙烷这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物
一、烷烃的结构
学生活动
烷烃的结构决定了其性质与甲烷的相似。最简单的烷烃——甲烷是烷烃的代表物。甲烷具有哪些性质?
物理性质:纯净的甲烷是无色、无味的气体,难溶于水,密度比空气的小
化学性质:化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化,也
不与强酸强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)和能在光照下与氯气发生取代反应
二、烷烃的化学性质
颜色 溶解性 可燃性 与酸性高锰 酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶于水
空气中可燃
不反应
取代反应
不反应
不反应
【思考与讨论】
(1)根据甲烷的性质推测烷烃可能具有的性质,填写下表。
二、烷烃的化学性质
(2)根据甲烷的燃烧反应,写出汽油的成分之一辛烷(C8H18)
完全燃烧的化学方程式。
2C8H18+25O2 16CO2+18H2O
点燃
庚烷
辛烷
二、烷烃的化学性质
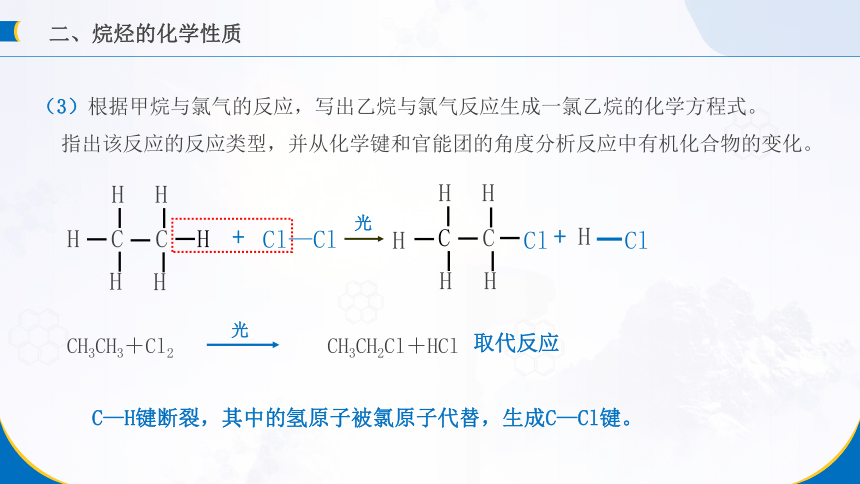
(3)根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。
指出该反应的反应类型,并从化学键和官能团的角度分析反应中有机化合物的变化。
+
Cl—Cl
光
C
C
H
H
H
H
H
H
C
C
Cl
H
H
H
H
H
Cl
H
+
C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键。
取代反应
CH3CH3+Cl2 CH3CH2Cl+HCl
光
二、烷烃的化学性质
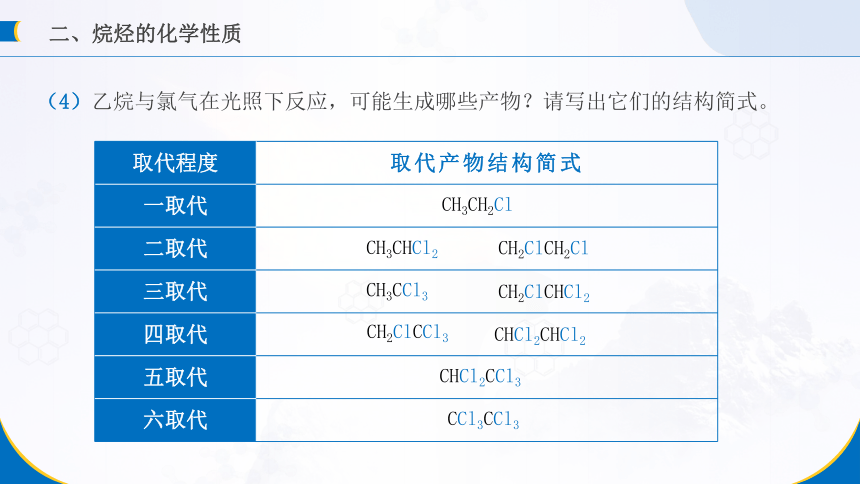
(4)乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
取代程度 取代产物结构简式
一取代
二取代
三取代
四取代
五取代
六取代
CH3CH2Cl
CH3CHCl2
CH2ClCH2Cl
CH3CCl3
CH2ClCHCl2
CH2ClCCl3
CHCl2CHCl2
CHCl2CCl3
CCl3CCl3
正误判断
(1) 在烷烃分子中,所有的化学键都是碳碳单键( )
(2) 烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去( )
(3) 分子通式为CnH2n+2的烃不一定是烷烃( )
(4) 所有的烷烃在光照条件下都能与氯气发生取代反应( )
(5) 丙烷分子中所有碳原子在一条直线上( )
(6) 光照条件下,1 mol Cl2与2 mol CH4充分反应后可得到1 mol CH3Cl( )
(7) 标况下,11.2 L己烷所含共价键的数目为9.5NA( )
×
×
×
√
×
×
×
深度思考
有4种碳骨架如下的烃,下列说法正确的是
①a和d是同分异构体 ②b和c是同系物 ③a和b都能发生加成反应
④只有b和c能发生取代反应
A.①② B.①④
C.②③ D.②④
√
深度思考
北京奥运会火炬选择了丙烷作为燃料,为什么选择丙烷而不是其他的烷烃呢?
名称 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 -182 -164 0.423
【思考与讨论】已知甲烷的密度、熔点、沸点如下表,预测乙烷、丙烷等烷烃的密度、熔点、沸点与甲烷的差异,并说明预测依据。
一般来说,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高。
三、烷烃的物理性质
三、烷烃的物理性质
部分烷烃的熔点、沸点和密度
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 液体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 液体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 液体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 液体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 固体 28 308 0.777
三、烷烃的物理性质
物理性质 变化规律
状态
溶解性
熔、沸点
密度
C1~C4气态;
C5~C16液态;
C17以上为固态
都不溶于水,易溶于有机溶剂
随碳原子数的增加,沸点逐渐升高。
随碳原子数的增加,相对密度逐渐增密度小于水的密度
奥运火炬选择丙烷作为燃料的原因
三、烷烃的物理性质
丙烷能适应比较宽的温度范围,在零下 40℃时仍能产生 1 个以上饱和蒸气压,高于外界大气压,形成燃烧。
丙烷含碳量高,燃烧的火焰呈明亮的黄色,有良好的可视性,便于识别和电视转播、新闻摄影的需要。
三、烷烃的物理性质
天然气多组分
天然气的运输
天然气的开采
造成管道冻堵
三、烷烃的物理性质
甲烷 乙烷 丙烷 正丁烷 正戊烷 正己烷
熔点/℃ -182 -172 -187 -138 -129 -94
沸点/℃ -164 -89 -42 -0.5 36 69
-100 ℃的状态 气 液 液 液 液 固
几种烷烃的熔点、沸点
三、烷烃的物理性质
-100 ℃
C2H6、
C3H8、
C4H10、C5H12…
CH4
天然气深冷分离
净化天然气
天然气凝液
三、烷烃的物理性质
天然气净化
天然气的运输
天然气的开采
深度冷却
1.几种烷烃的沸点如下:
根据以上数据推断丙烷的沸点可能是
A.约-40 ℃ B.低于-162 ℃
C.低于-89 ℃ D.高于36 ℃
解析 烷烃同系物的沸点随分子中碳原子个数的增加而升高,因此丙烷的沸点介于乙烷和丁烷之间,故选A。
物质 甲烷 乙烷 丁烷 戊烷
沸点/℃ -162 -89 -1 36
√
练一练
练一练
2.下列关于烷烃性质的叙述中,不正确的是
A.烷烃随相对分子质量的增大,熔、沸点逐渐升高,常温下的状 由气态递变到液态,相对分子质量大的则为固态
B.烷烃的密度随相对分子质量的增大而逐渐增大
C.烷烃与卤素单质在光照条件下能发生取代反应
D.烷烃能使溴水、KMnO4酸性溶液褪色
√
归纳总结
(1) 判断两种有机物互为同系物的关键:一看是否是同类物质;二看是否结构相似;三看是否至少相差一个CH2原子团。
(2) 比较烷烃的熔、沸点的思路
(3) 烷烃的主要化学性质:①取代反应(光照)、②氧化反应(点燃)。
课堂小结
定义
烷烃
物理性质
化学性质
同系物
难溶于水
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高,密度逐渐增大
密度均小于1
易燃
与酸性高猛钾溶液不反应
与溴的四氧化碳溶液不反应
与强酸、强碱溶液不反应
取代反应
课堂练习
1.乙烷在光照条件下与氯气发生取代反应,理论上得到的氯代物最多有
A.5种 B.6种
C.8种 D.9种
解析 乙烷的分子式为C2H6,若分子上的所有的H原子依次被氯原子取代,则可得氯代物6种。但考虑同分异构现象,其中二氯代物、三氯代物、四氯代物各有2种同分异构体,而一氯代物、五氯代物、六氯代物只有1种结构,所以最多共有9种氯代物。
√
课堂练习
2. 下列有关烷烃的叙述中,正确的是
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色
⑥所有的烷烃都可以在空气中燃烧
A.①②③⑥ B.①④⑥
C.②③④ D.①②③④
√
课堂练习
3.液化气的主要成分是丙烷,下列有关丙烷的叙述不正确的是
A.丙烷是链状烷烃,但分子中碳原子不在同一直线上
B.在光照条件下能与Cl2发生取代反应
C.丙烷比其同分异构体丁烷易液化
D.1 mol丙烷完全燃烧消耗5 mol O2
解析 丙烷是链状烷烃,其中碳原子为饱和碳原子,3个碳原子构成锯齿状的链状结构,故3个碳原子不在同一直线上,A正确;丙烷在光照条件下能与Cl2发生取代反应,B正确;丙烷与丁烷互为同系物,且丁烷比丙烷易液化,C错误;1 mol丙烷完全燃烧消耗5 mol O2,D正确。
√
选修三
新高考 新理念 新标准
感谢您的观看
THANK
第二章
选修三
第一节 烷烃
SECTION 3 AROMATIC HYDROCARBONS
第1课时
新高考 新理念 新标准
核心素养
1. 知道烷烃的物理性质的变化与分子中碳原子数目的关系。
2. 认识烷烃的结构特征,能以典型代表物为例,理解烷烃的化学性质。
生活中常见的烃
新课导入
新课导入
烃
定义
分类
仅含碳和氢两种元素的有机化合物
烷烃
烯烃
炔烃
芳香烃
结构不同
新课导入
预测
烃分子可能的断键部位与相应反应类型的主要依据
碳原子的饱和程度和化学键的类型
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷
乙烷
丙烷
正丁烷
正戊烷
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH4
C2H6
C3H8
C4H10
C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
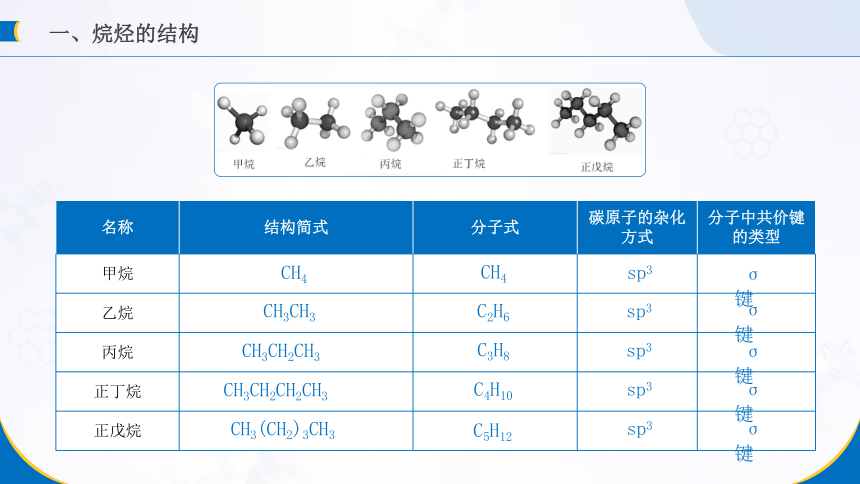
一、烷烃的结构
一、烷烃的结构
烷烃的结构与甲烷的相似,其分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。
烷烃分子中的共价键全部是单键
烷烃同系物的通式:CnH2n+2
同系物:像甲烷、乙烷、丙烷这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物
一、烷烃的结构
学生活动
烷烃的结构决定了其性质与甲烷的相似。最简单的烷烃——甲烷是烷烃的代表物。甲烷具有哪些性质?
物理性质:纯净的甲烷是无色、无味的气体,难溶于水,密度比空气的小
化学性质:化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化,也
不与强酸强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)和能在光照下与氯气发生取代反应
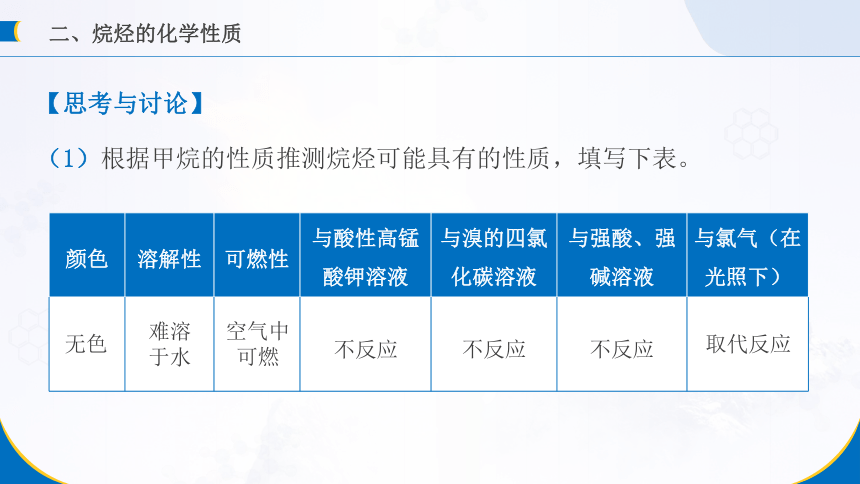
二、烷烃的化学性质
颜色 溶解性 可燃性 与酸性高锰 酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶于水
空气中可燃
不反应
取代反应
不反应
不反应
【思考与讨论】
(1)根据甲烷的性质推测烷烃可能具有的性质,填写下表。
二、烷烃的化学性质
(2)根据甲烷的燃烧反应,写出汽油的成分之一辛烷(C8H18)
完全燃烧的化学方程式。
2C8H18+25O2 16CO2+18H2O
点燃
庚烷
辛烷
二、烷烃的化学性质
(3)根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。
指出该反应的反应类型,并从化学键和官能团的角度分析反应中有机化合物的变化。
+
Cl—Cl
光
C
C
H
H
H
H
H
H
C
C
Cl
H
H
H
H
H
Cl
H
+
C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键。
取代反应
CH3CH3+Cl2 CH3CH2Cl+HCl
光
二、烷烃的化学性质
(4)乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
取代程度 取代产物结构简式
一取代
二取代
三取代
四取代
五取代
六取代
CH3CH2Cl
CH3CHCl2
CH2ClCH2Cl
CH3CCl3
CH2ClCHCl2
CH2ClCCl3
CHCl2CHCl2
CHCl2CCl3
CCl3CCl3
正误判断
(1) 在烷烃分子中,所有的化学键都是碳碳单键( )
(2) 烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去( )
(3) 分子通式为CnH2n+2的烃不一定是烷烃( )
(4) 所有的烷烃在光照条件下都能与氯气发生取代反应( )
(5) 丙烷分子中所有碳原子在一条直线上( )
(6) 光照条件下,1 mol Cl2与2 mol CH4充分反应后可得到1 mol CH3Cl( )
(7) 标况下,11.2 L己烷所含共价键的数目为9.5NA( )
×
×
×
√
×
×
×
深度思考
有4种碳骨架如下的烃,下列说法正确的是
①a和d是同分异构体 ②b和c是同系物 ③a和b都能发生加成反应
④只有b和c能发生取代反应
A.①② B.①④
C.②③ D.②④
√
深度思考
北京奥运会火炬选择了丙烷作为燃料,为什么选择丙烷而不是其他的烷烃呢?
名称 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 -182 -164 0.423
【思考与讨论】已知甲烷的密度、熔点、沸点如下表,预测乙烷、丙烷等烷烃的密度、熔点、沸点与甲烷的差异,并说明预测依据。
一般来说,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高。
三、烷烃的物理性质
三、烷烃的物理性质
部分烷烃的熔点、沸点和密度
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 液体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 液体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 液体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 液体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 固体 28 308 0.777
三、烷烃的物理性质
物理性质 变化规律
状态
溶解性
熔、沸点
密度
C1~C4气态;
C5~C16液态;
C17以上为固态
都不溶于水,易溶于有机溶剂
随碳原子数的增加,沸点逐渐升高。
随碳原子数的增加,相对密度逐渐增密度小于水的密度
奥运火炬选择丙烷作为燃料的原因
三、烷烃的物理性质
丙烷能适应比较宽的温度范围,在零下 40℃时仍能产生 1 个以上饱和蒸气压,高于外界大气压,形成燃烧。
丙烷含碳量高,燃烧的火焰呈明亮的黄色,有良好的可视性,便于识别和电视转播、新闻摄影的需要。
三、烷烃的物理性质
天然气多组分
天然气的运输
天然气的开采
造成管道冻堵
三、烷烃的物理性质
甲烷 乙烷 丙烷 正丁烷 正戊烷 正己烷
熔点/℃ -182 -172 -187 -138 -129 -94
沸点/℃ -164 -89 -42 -0.5 36 69
-100 ℃的状态 气 液 液 液 液 固
几种烷烃的熔点、沸点
三、烷烃的物理性质
-100 ℃
C2H6、
C3H8、
C4H10、C5H12…
CH4
天然气深冷分离
净化天然气
天然气凝液
三、烷烃的物理性质
天然气净化
天然气的运输
天然气的开采
深度冷却
1.几种烷烃的沸点如下:
根据以上数据推断丙烷的沸点可能是
A.约-40 ℃ B.低于-162 ℃
C.低于-89 ℃ D.高于36 ℃
解析 烷烃同系物的沸点随分子中碳原子个数的增加而升高,因此丙烷的沸点介于乙烷和丁烷之间,故选A。
物质 甲烷 乙烷 丁烷 戊烷
沸点/℃ -162 -89 -1 36
√
练一练
练一练
2.下列关于烷烃性质的叙述中,不正确的是
A.烷烃随相对分子质量的增大,熔、沸点逐渐升高,常温下的状 由气态递变到液态,相对分子质量大的则为固态
B.烷烃的密度随相对分子质量的增大而逐渐增大
C.烷烃与卤素单质在光照条件下能发生取代反应
D.烷烃能使溴水、KMnO4酸性溶液褪色
√
归纳总结
(1) 判断两种有机物互为同系物的关键:一看是否是同类物质;二看是否结构相似;三看是否至少相差一个CH2原子团。
(2) 比较烷烃的熔、沸点的思路
(3) 烷烃的主要化学性质:①取代反应(光照)、②氧化反应(点燃)。
课堂小结
定义
烷烃
物理性质
化学性质
同系物
难溶于水
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高,密度逐渐增大
密度均小于1
易燃
与酸性高猛钾溶液不反应
与溴的四氧化碳溶液不反应
与强酸、强碱溶液不反应
取代反应
课堂练习
1.乙烷在光照条件下与氯气发生取代反应,理论上得到的氯代物最多有
A.5种 B.6种
C.8种 D.9种
解析 乙烷的分子式为C2H6,若分子上的所有的H原子依次被氯原子取代,则可得氯代物6种。但考虑同分异构现象,其中二氯代物、三氯代物、四氯代物各有2种同分异构体,而一氯代物、五氯代物、六氯代物只有1种结构,所以最多共有9种氯代物。
√
课堂练习
2. 下列有关烷烃的叙述中,正确的是
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色
⑥所有的烷烃都可以在空气中燃烧
A.①②③⑥ B.①④⑥
C.②③④ D.①②③④
√
课堂练习
3.液化气的主要成分是丙烷,下列有关丙烷的叙述不正确的是
A.丙烷是链状烷烃,但分子中碳原子不在同一直线上
B.在光照条件下能与Cl2发生取代反应
C.丙烷比其同分异构体丁烷易液化
D.1 mol丙烷完全燃烧消耗5 mol O2
解析 丙烷是链状烷烃,其中碳原子为饱和碳原子,3个碳原子构成锯齿状的链状结构,故3个碳原子不在同一直线上,A正确;丙烷在光照条件下能与Cl2发生取代反应,B正确;丙烷与丁烷互为同系物,且丁烷比丙烷易液化,C错误;1 mol丙烷完全燃烧消耗5 mol O2,D正确。
√
选修三
新高考 新理念 新标准
感谢您的观看
THANK
