人教版(2019)必修 第二册第五章 化工生产中的重要非金属元素第二课时硫酸(共23张PPT)
文档属性
| 名称 | 人教版(2019)必修 第二册第五章 化工生产中的重要非金属元素第二课时硫酸(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 31.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 11:08:46 | ||
图片预览








文档简介
(共23张PPT)
第1节 硫及其化合物
第2课时 硫 酸
课程学习目标
认识硫酸在相关反应中体现的性质
3
掌握浓硫酸的吸水性、脱水性、强氧化性
2
了解硫酸的生产原理
1
实验室里常用Fe、Zn等与稀硫酸、稀盐酸反应制取H2。而在工业上浓硫酸都是用铁罐或铝罐来储存和运输。这是为什么?浓硫酸有何特性?今天我们一起来学习。
新课导入
新课展示
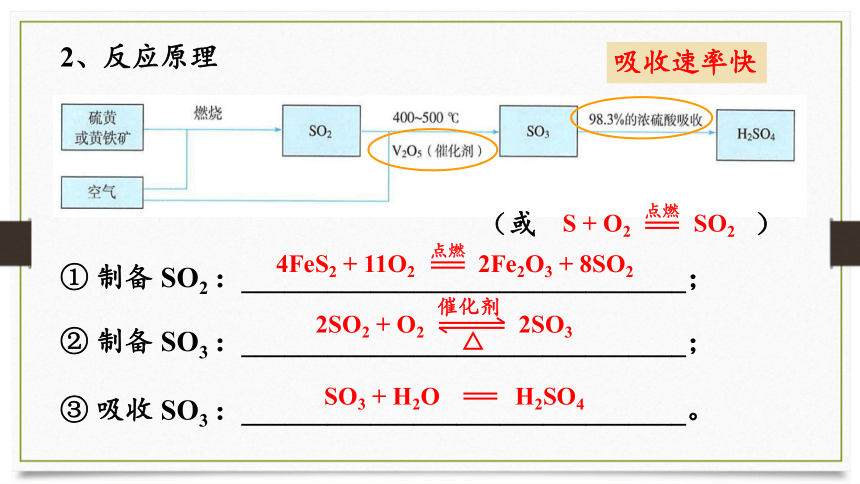
硫酸的工业制备
1、原料:硫黄或硫矿物(黄铁矿)
FeS2
2、反应原理
① 制备 SO2 :_______________________________;
② 制备 SO3 :_______________________________;
③ 吸收 SO3 :_______________________________。
4FeS2 + 11O2 2Fe2O3 + 8SO2
点燃
(或 )
S + O2 SO2
点燃
催化剂
2SO2 + O2 2SO3
SO3 + H2O H2SO4
吸收速率快
硫酸的性质
(1)纯硫酸是一种无色油状液体。
(2)沸点:338 ℃ (难挥性发酸),沸点高,难挥发。
密度:1.84 g / cm3 (比水大)
(3)溶解性:浓 H2SO4 与水以任意比互溶,
溶解时可放出大量的热。
1、物理性质
同学们还记得浓硫酸稀释的实验操作吗
2、化学性质
1) 稀硫酸的化学性质
硫酸属于二元强酸,具有酸的通性。
① 稀硫酸发生完全电离:
H2SO4 = 2H+ + SO42-
② 酸的通性:
a、使酸碱指示剂显色; b、跟活泼金属反应;
c、跟碱性氧化物反应; d、跟碱起中和反应;
e、跟某些盐反应。
试一试:写出下列反应的化学方程式:
a、稀硫酸能使紫色石蕊试液变____ 色。
b、稀硫酸与活泼金属反应,如 Zn :____________________。
c、稀硫酸与金属氧化物反应,如 CuO :_______________________。
d、稀硫酸与碱反应,如 NaOH :__________________________。
e、稀硫酸与部分盐反应,如 Na2CO3 : ________________________。
红
2) 浓硫酸的化学性质
浓硫酸:主要以分子形式存在,所以具有稀硫酸不
具有的化学特性。
① 吸水性:浓硫酸能吸收物质周围环境中的水分,
常用做干燥剂。
可干燥
中性气体:H2、O2、N2、CO
酸性气体:CO2、SO2、SO3、NO2、HCl...
不能干燥:碱性气体:NH3 ,还原性气体:H2S、
HI、HBr等。
② 脱水性:浓硫酸能将有机物中的氢、氧元素
按水的组成比(2:1)脱去。
如:蔗糖脱水
C12H22O11 (蔗糖)
浓硫酸
12C + 11H2O
现象:蔗糖变黑,黑色物质急剧膨胀,变成疏松多孔的海绵状,并放出有刺激性气味的气体。
[问题探讨]黑色物质急剧膨胀,变成疏松多孔的海绵状的原因是什么?
C + 2H2SO4 (浓) CO2↑ + 2SO2↑ + 2H2O
体现了浓硫酸的强氧化性,浓硫酸在加热的条件下能与某些非金属单质反应(C, S)。
浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性
思考讨论
吸水性
③ 强氧化性:
a、加热时,浓硫酸与不活泼金属(Cu)反应,常温不反应。
实验展示
【实验5-3】仔细观察实验现象并分析
实验现象
a、试管中铜丝____________________________
b、试管中的品红溶液逐渐变为________
c、试管中的紫色石蕊溶液逐渐变为________
逐渐溶解,有气泡产生
无色
红色
蓝色
d、将a试管里的溶液慢慢倒入水中,溶液变为_____
实验原理
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
答一答:
1、在上述反应中,硫酸表现出了_________和______。
2、若铜过量,硫酸能否完全反应 为什么
强氧化性
酸性
答:不能完全反应,
浓硫酸因反应消耗变成稀硫酸,反应停止。
③ 强氧化性:
b、加热时,浓硫酸与非金属单质反应
C + 2H2SO4 (浓) CO2↑ + 2SO2↑ + 2H2O
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
c、浓硫酸与具有还原性的物质反应,如 H2S、HI、HBr、 FeCl2等。
还原产物一般是SO2
③ 强氧化性:
d、常温下,浓硫酸能使较活泼金属(Al、Fe)
发生钝化。
冷的浓硫酸使金属表面形成一层致密的氧化膜,阻止内层金属被进一步腐蚀。
加热下,浓硫酸与较活泼金属(Al、Fe)反应。
常温下,浓硫酸可以用铁制或铝制容器来储存和运输。
钝化的化学变化
【例1】下列现象反映了硫酸的哪些主要性质?
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)浓硫酸不能用来干燥硫化氢气体。
(6)碳酸钠跟稀硫酸反应生成二氧化碳气体。
脱水性
吸水性
酸性
酸性和强氧化性
强氧化性
酸性
典例精讲
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
硫酸的消费量被视为一个国家无机工业发展水平的标志。
3.硫酸的用途:
设计一个实验检验C和浓硫酸反应产生的气体成分
品红溶液褪色检验SO2的存在
KMnO4颜色变浅除去SO2气体
不褪色
检验SO2是否除尽
浑浊
检验CO2
白色变为蓝色检验H2O的存在
深度思考
下列关于浓硫酸的叙述正确的是 ( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
课堂练习
D
第1节 硫及其化合物
第2课时 硫 酸
课程学习目标
认识硫酸在相关反应中体现的性质
3
掌握浓硫酸的吸水性、脱水性、强氧化性
2
了解硫酸的生产原理
1
实验室里常用Fe、Zn等与稀硫酸、稀盐酸反应制取H2。而在工业上浓硫酸都是用铁罐或铝罐来储存和运输。这是为什么?浓硫酸有何特性?今天我们一起来学习。
新课导入
新课展示
硫酸的工业制备
1、原料:硫黄或硫矿物(黄铁矿)
FeS2
2、反应原理
① 制备 SO2 :_______________________________;
② 制备 SO3 :_______________________________;
③ 吸收 SO3 :_______________________________。
4FeS2 + 11O2 2Fe2O3 + 8SO2
点燃
(或 )
S + O2 SO2
点燃
催化剂
2SO2 + O2 2SO3
SO3 + H2O H2SO4
吸收速率快
硫酸的性质
(1)纯硫酸是一种无色油状液体。
(2)沸点:338 ℃ (难挥性发酸),沸点高,难挥发。
密度:1.84 g / cm3 (比水大)
(3)溶解性:浓 H2SO4 与水以任意比互溶,
溶解时可放出大量的热。
1、物理性质
同学们还记得浓硫酸稀释的实验操作吗
2、化学性质
1) 稀硫酸的化学性质
硫酸属于二元强酸,具有酸的通性。
① 稀硫酸发生完全电离:
H2SO4 = 2H+ + SO42-
② 酸的通性:
a、使酸碱指示剂显色; b、跟活泼金属反应;
c、跟碱性氧化物反应; d、跟碱起中和反应;
e、跟某些盐反应。
试一试:写出下列反应的化学方程式:
a、稀硫酸能使紫色石蕊试液变____ 色。
b、稀硫酸与活泼金属反应,如 Zn :____________________。
c、稀硫酸与金属氧化物反应,如 CuO :_______________________。
d、稀硫酸与碱反应,如 NaOH :__________________________。
e、稀硫酸与部分盐反应,如 Na2CO3 : ________________________。
红
2) 浓硫酸的化学性质
浓硫酸:主要以分子形式存在,所以具有稀硫酸不
具有的化学特性。
① 吸水性:浓硫酸能吸收物质周围环境中的水分,
常用做干燥剂。
可干燥
中性气体:H2、O2、N2、CO
酸性气体:CO2、SO2、SO3、NO2、HCl...
不能干燥:碱性气体:NH3 ,还原性气体:H2S、
HI、HBr等。
② 脱水性:浓硫酸能将有机物中的氢、氧元素
按水的组成比(2:1)脱去。
如:蔗糖脱水
C12H22O11 (蔗糖)
浓硫酸
12C + 11H2O
现象:蔗糖变黑,黑色物质急剧膨胀,变成疏松多孔的海绵状,并放出有刺激性气味的气体。
[问题探讨]黑色物质急剧膨胀,变成疏松多孔的海绵状的原因是什么?
C + 2H2SO4 (浓) CO2↑ + 2SO2↑ + 2H2O
体现了浓硫酸的强氧化性,浓硫酸在加热的条件下能与某些非金属单质反应(C, S)。
浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性
思考讨论
吸水性
③ 强氧化性:
a、加热时,浓硫酸与不活泼金属(Cu)反应,常温不反应。
实验展示
【实验5-3】仔细观察实验现象并分析
实验现象
a、试管中铜丝____________________________
b、试管中的品红溶液逐渐变为________
c、试管中的紫色石蕊溶液逐渐变为________
逐渐溶解,有气泡产生
无色
红色
蓝色
d、将a试管里的溶液慢慢倒入水中,溶液变为_____
实验原理
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
答一答:
1、在上述反应中,硫酸表现出了_________和______。
2、若铜过量,硫酸能否完全反应 为什么
强氧化性
酸性
答:不能完全反应,
浓硫酸因反应消耗变成稀硫酸,反应停止。
③ 强氧化性:
b、加热时,浓硫酸与非金属单质反应
C + 2H2SO4 (浓) CO2↑ + 2SO2↑ + 2H2O
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
c、浓硫酸与具有还原性的物质反应,如 H2S、HI、HBr、 FeCl2等。
还原产物一般是SO2
③ 强氧化性:
d、常温下,浓硫酸能使较活泼金属(Al、Fe)
发生钝化。
冷的浓硫酸使金属表面形成一层致密的氧化膜,阻止内层金属被进一步腐蚀。
加热下,浓硫酸与较活泼金属(Al、Fe)反应。
常温下,浓硫酸可以用铁制或铝制容器来储存和运输。
钝化的化学变化
【例1】下列现象反映了硫酸的哪些主要性质?
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)浓硫酸不能用来干燥硫化氢气体。
(6)碳酸钠跟稀硫酸反应生成二氧化碳气体。
脱水性
吸水性
酸性
酸性和强氧化性
强氧化性
酸性
典例精讲
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
硫酸的消费量被视为一个国家无机工业发展水平的标志。
3.硫酸的用途:
设计一个实验检验C和浓硫酸反应产生的气体成分
品红溶液褪色检验SO2的存在
KMnO4颜色变浅除去SO2气体
不褪色
检验SO2是否除尽
浑浊
检验CO2
白色变为蓝色检验H2O的存在
深度思考
下列关于浓硫酸的叙述正确的是 ( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
课堂练习
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
