江西省宜春市重点中学2022-2023学年高二上学期期末考试化学试卷(含答案)
文档属性
| 名称 | 江西省宜春市重点中学2022-2023学年高二上学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 926.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 18:12:45 | ||
图片预览

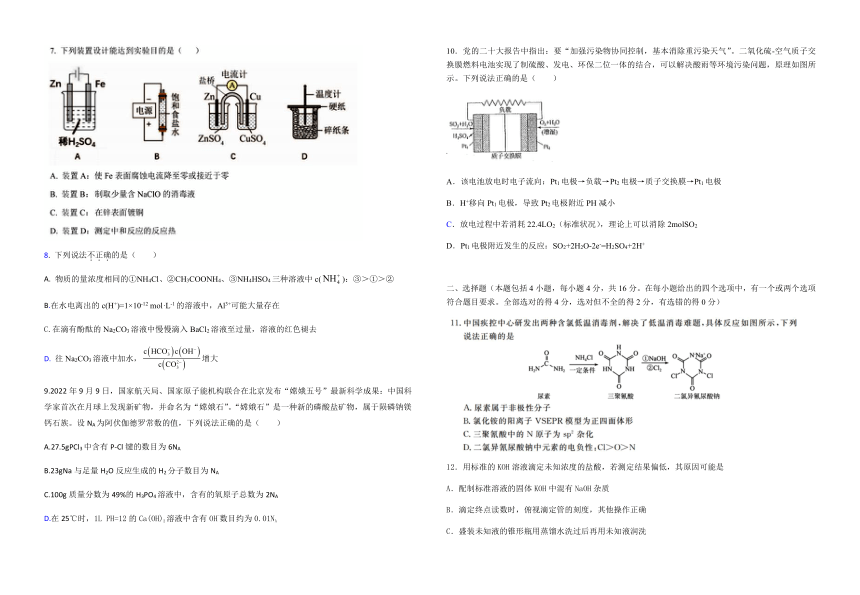

文档简介
宜春市重点中学2022-2023学年高二上学期期末考试
化学试卷
可能用到的相对原子质量:H: 1 C: 12 O: 16 Cu: 64 Na: 23 P: 31 Cl: 35.5
一、选择题(本题包括10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.2022年3月,神州十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
A.醋酸钠溶液中c(Na+)=c(CH3COO-) B.醋酸钠是强电解质
C.常温下,醋酸钠溶液的pH>7 D.醋酸钠晶体中含有共价键
2.对可逆反应,有关反应条件改变使反应速率增大的原因分析不正确的是( )
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大,活化分子百分数增大,有效碰撞几率增加
D.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
3. 下列事实不能证明是弱电解质的是( )
A. 时溶液的
B. 与反应放出气体
C. 滴入酚酞,溶液显红色
D. 时的溶液稀释至1000倍,
4. 俄乌冲突爆发以来,许多西方国家宣布制裁俄罗斯,制裁范围涵盖俄罗斯的猫、树以及该国的文艺作品等,但俄罗斯的石油和天然气目前并不在制裁之列。天然气的主要成分是甲烷,下列能正确表示甲烷燃烧热的热化学方程式是( )
A.
B.
C.
D.
5. 下列叙述中正确的是( )
A.向饱和的AgCl、AgBr混合液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
B.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
C. 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
D. 反应2A(g)+B(s)=C(g)+D(s)在一定条件下可自发进行,则
6.现有三种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p63s23p5,
下列排序正确的是( )
A.含氧酸的酸性:③>①>② B.原子半径:③>②>①
C.第一电离能:③>②>① D.电负性:③>②>①
8. 下列说法不正确的是( )
A. 物质的量浓度相同的①NH4Cl、②CH3COONH4、③NH4HSO4三种溶液中c():③>①>②
B.在水电离出的c(H+)=1×10-12 mol·L-1的溶液中,Al3+可能大量存在
C.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液至过量,溶液的红色褪去
D. 往Na2CO3溶液中加水,增大
9.2022年9月9日,国家航天局、国家原子能机构联合在北京发布“嫦娥五号”最新科学成果:中国科学家首次在月球上发现新矿物,并命名为“嫦娥石”。“嫦娥石”是一种新的磷酸盐矿物,属于陨磷钠镁钙石族。设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.27.5gPCl3中含有P-Cl键的数目为6NA
B.23gNa与足量H2O反应生成的H2分子数目为NA
C.100g质量分数为49%的H3PO4溶液中,含有的氧原子总数为2NA
D.在25℃时,1L PH=12的Ca(OH)2溶液中含有OH-数目约为0.01NA
10.党的二十大报告中指出:要“加强污染物协同控制,基本消除重污染天气”。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保二位一体的结合,可以解决酸雨等环境污染问题,原理如图所示。下列说法正确的是( )
该电池放电时电子流向:Pt1电极→负载→Pt2电极→质子交换膜→Pt1电极
B.H+移向Pt1电极,导致Pt2电极附近PH减小
C.放电过程中若消耗22.4LO2(标准状况),理论上可以消除2molSO2
D.Pt1电极附近发生的反应:SO2+2H2O-2e-=H2SO4+2H+
二、选择题(本题包括4小题,每小题4分,共16分。在每小題给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分)
12.用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
A.配制标准溶液的固体KOH中混有NaOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
13. 下列关于各图像的解释或得出的结论不正确的是( )
A. 由甲图可知,反应时刻一定是使用了催化剂
B. 由乙图可知,反应在m点可能达到了平衡状态
C. 由丙图可知,反应过程中的点可能是A点
D. 由丁图可知,交点A表示反应一定处于平衡状态,此时
14.25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是
A.a点溶液满足:c(NH)>c(NH3·H2O)>c(Mg2+)>c(OH-)
B.b点溶液中无Mg(OH)2沉淀产生
C.c点溶液满足:2c(Mg2+)+c()>c(Cl-)
D.Ksp[Mg(OH)2]的数量级是10-12
三、非选择题(本题包括4小题,共54分)
15.(14分)现有属于前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。A元素基态原子的价电子排布式为;C元素为周期表中最活泼的非金属元素;D元素形成的正三价离子的3d轨道为半充满状态;E元素基态原子的M层全充满,N层只有一个电子;F元素与A元素位于同一主族,其某种氧化物有剧毒,俗称砒霜。
(1) A的原子核外有 种运动状态的电子;B、C两种元素可按原子比1:1组成一种化合物,其电子式可表示为 (用元素符号表示)。
(2)D元素原子结构示意图为 。
(3) E元素位于元素周期表的 区,其基态原子的价电子排布式为 。
(4) F元素不可能的性质是 (填序号)。
A.其单质可作为半导体材料 B.其电负性小于磷
C.其原子半径小于锗 D.其氢化物稳定性强于
(5)E元素的单质晶体的晶胞如图所示:
已知图中表示E原子,正方体的边长为acm,求该晶体的密度=_________g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)
16. (14分)滴定实验是化学学科中最重要的定量实验之一、常见的滴定实验有酸碱中和滴定、氧化还原反应滴定、沉淀滴定等等。
I.获取安全的饮用水一直以来都是人们关注的重要问题,自来水厂经常用氯气进行杀菌,某化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量,实验如下:
①取水样50.00mL于锥形瓶中,加入溶液(足量),滴入2~3滴淀粉溶液
②将自己配制的标准溶液(显碱性)装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为。
试回答下列问题:
(1)①滴定前装有标准液的滴定管排气泡时,应选择下图中的_______(填标号,下同)。
②若用25.00L滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积_______。
a.=10.00mL B.=15.00mL C.<10.00mL D.>15.00mL
(2)步骤①发生反应的离子方程式为_______。
(3)达到滴定终点的现象是_______。
(4)实验中消耗了标准溶液4.00mL,所测水样中游离态氯的含量为_______。
(5)实验测得游离态氯的浓度比实际浓度偏大,造成误差的原因可能是_______(填标号)。
A.配制标准溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测水样
C.装标准溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
E.装标准溶液的滴定管滴定前尖嘴部分有气泡,滴定后气泡消失
II.沉淀滴定——滴定剂与被滴定物生成的沉淀比滴定剂与指示剂生成的沉淀更难溶;且二者之间,有明显的颜色差别。
(6)参考表中的数据,若用滴定NaSCN溶液,可选用的指示剂是_______(填标号)。
难溶物
颜色 白 浅黄 白 砖红 白
A. B. NaBr C. NaCN D. NaCl
17. (14分)某工厂产生的废渣中主要含有ZnO,另含有少量FeO、CuO、SiO2等,某科研人员设计的用废渣制取高纯ZnO的工艺流程图如图所示。
已知:25℃时,部分物质的Ksp相关信息如表所示:
CuS ZnS
(1)按照核外电子排布,把元素周期表划分为5个区。Zn位于________区,基态铁原子价层电子的轨道表示式为_____________
(2)“氧化”时发生反应的离子方程式为_______。
(3)“除铁”时除了加ZnO,还可以加入_______(写出一种物质的化学式)。
(4)若“氧化”后所得滤液中C(Zn2+)=1.2mol/L,C(Cu2+)=0.022mol/L,“除铁”操作中为了使铁元素完全除去(C(Fe3+)<10-5mol/L除去完全),又不影响高纯ZnO的产量,可以调节pH的范围是_______,滤渣B的主要成分为_______(填化学式)。
(5)有同学认为各步骤中加入的试剂不变,将该工艺流程设计为“酸浸”→“氧化”→“除铜”→“除铁”也可以除去和,并回收CuS和,该设计是否合理_______(填“是”或“否”),理由是_______。
(6)写出溶液D的主要溶质的电子式_______。
18.(12分)我国力争2030年前实现碳达峰,2060年前实现碳中和,CO2的综合利用是实现碳中和的有效措施之一。
(1)用反应Ⅰ可以在一定条件下合成CH3OH,该过程存在副反应Ⅱ
(2)2021年我国科学家首先实现了从CO2到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将CO2转化为CH3COOH.写出该过程中阴极的电极反应式:________________________。
宜春市重点中学2022-2023学年高二上学期期末考试
化学试卷
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A C B D A C B D D C B AB AD CD
15(14分每空2分)
(1)7; (2) (3)ds; 3d104s1 (4)D
(5)256/NAa3
16.(14分每空2分)
(1) ①. c ②. D
(2)
(3)滴入最后半滴时,溶液蓝色褪去,且半分钟内不恢复颜色
(4)2.84 (5)ACE (6)A
17.(14分除注明外每空2分)
(1) d (1分)略(1分)
(2)
(3)或 (1分)
(4) ①. 3(5) ①. 否(1分) ②. 加入ZnS会将还原为,使铁元素难以除去
(6)
18.(12分每空2分)
(1)①+41.2
②温度升高,CO2的反应速率加快,反应Ⅱ为吸热反应,温度升高有利于反应正向进行且以反应2为主,CO2转化率增大 a 0.031
(2)
化学试卷
可能用到的相对原子质量:H: 1 C: 12 O: 16 Cu: 64 Na: 23 P: 31 Cl: 35.5
一、选择题(本题包括10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.2022年3月,神州十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
A.醋酸钠溶液中c(Na+)=c(CH3COO-) B.醋酸钠是强电解质
C.常温下,醋酸钠溶液的pH>7 D.醋酸钠晶体中含有共价键
2.对可逆反应,有关反应条件改变使反应速率增大的原因分析不正确的是( )
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大,活化分子百分数增大,有效碰撞几率增加
D.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
3. 下列事实不能证明是弱电解质的是( )
A. 时溶液的
B. 与反应放出气体
C. 滴入酚酞,溶液显红色
D. 时的溶液稀释至1000倍,
4. 俄乌冲突爆发以来,许多西方国家宣布制裁俄罗斯,制裁范围涵盖俄罗斯的猫、树以及该国的文艺作品等,但俄罗斯的石油和天然气目前并不在制裁之列。天然气的主要成分是甲烷,下列能正确表示甲烷燃烧热的热化学方程式是( )
A.
B.
C.
D.
5. 下列叙述中正确的是( )
A.向饱和的AgCl、AgBr混合液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
B.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
C. 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
D. 反应2A(g)+B(s)=C(g)+D(s)在一定条件下可自发进行,则
6.现有三种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p63s23p5,
下列排序正确的是( )
A.含氧酸的酸性:③>①>② B.原子半径:③>②>①
C.第一电离能:③>②>① D.电负性:③>②>①
8. 下列说法不正确的是( )
A. 物质的量浓度相同的①NH4Cl、②CH3COONH4、③NH4HSO4三种溶液中c():③>①>②
B.在水电离出的c(H+)=1×10-12 mol·L-1的溶液中,Al3+可能大量存在
C.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液至过量,溶液的红色褪去
D. 往Na2CO3溶液中加水,增大
9.2022年9月9日,国家航天局、国家原子能机构联合在北京发布“嫦娥五号”最新科学成果:中国科学家首次在月球上发现新矿物,并命名为“嫦娥石”。“嫦娥石”是一种新的磷酸盐矿物,属于陨磷钠镁钙石族。设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.27.5gPCl3中含有P-Cl键的数目为6NA
B.23gNa与足量H2O反应生成的H2分子数目为NA
C.100g质量分数为49%的H3PO4溶液中,含有的氧原子总数为2NA
D.在25℃时,1L PH=12的Ca(OH)2溶液中含有OH-数目约为0.01NA
10.党的二十大报告中指出:要“加强污染物协同控制,基本消除重污染天气”。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保二位一体的结合,可以解决酸雨等环境污染问题,原理如图所示。下列说法正确的是( )
该电池放电时电子流向:Pt1电极→负载→Pt2电极→质子交换膜→Pt1电极
B.H+移向Pt1电极,导致Pt2电极附近PH减小
C.放电过程中若消耗22.4LO2(标准状况),理论上可以消除2molSO2
D.Pt1电极附近发生的反应:SO2+2H2O-2e-=H2SO4+2H+
二、选择题(本题包括4小题,每小题4分,共16分。在每小題给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分)
12.用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
A.配制标准溶液的固体KOH中混有NaOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
13. 下列关于各图像的解释或得出的结论不正确的是( )
A. 由甲图可知,反应时刻一定是使用了催化剂
B. 由乙图可知,反应在m点可能达到了平衡状态
C. 由丙图可知,反应过程中的点可能是A点
D. 由丁图可知,交点A表示反应一定处于平衡状态,此时
14.25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是
A.a点溶液满足:c(NH)>c(NH3·H2O)>c(Mg2+)>c(OH-)
B.b点溶液中无Mg(OH)2沉淀产生
C.c点溶液满足:2c(Mg2+)+c()>c(Cl-)
D.Ksp[Mg(OH)2]的数量级是10-12
三、非选择题(本题包括4小题,共54分)
15.(14分)现有属于前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。A元素基态原子的价电子排布式为;C元素为周期表中最活泼的非金属元素;D元素形成的正三价离子的3d轨道为半充满状态;E元素基态原子的M层全充满,N层只有一个电子;F元素与A元素位于同一主族,其某种氧化物有剧毒,俗称砒霜。
(1) A的原子核外有 种运动状态的电子;B、C两种元素可按原子比1:1组成一种化合物,其电子式可表示为 (用元素符号表示)。
(2)D元素原子结构示意图为 。
(3) E元素位于元素周期表的 区,其基态原子的价电子排布式为 。
(4) F元素不可能的性质是 (填序号)。
A.其单质可作为半导体材料 B.其电负性小于磷
C.其原子半径小于锗 D.其氢化物稳定性强于
(5)E元素的单质晶体的晶胞如图所示:
已知图中表示E原子,正方体的边长为acm,求该晶体的密度=_________g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)
16. (14分)滴定实验是化学学科中最重要的定量实验之一、常见的滴定实验有酸碱中和滴定、氧化还原反应滴定、沉淀滴定等等。
I.获取安全的饮用水一直以来都是人们关注的重要问题,自来水厂经常用氯气进行杀菌,某化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量,实验如下:
①取水样50.00mL于锥形瓶中,加入溶液(足量),滴入2~3滴淀粉溶液
②将自己配制的标准溶液(显碱性)装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为。
试回答下列问题:
(1)①滴定前装有标准液的滴定管排气泡时,应选择下图中的_______(填标号,下同)。
②若用25.00L滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积_______。
a.=10.00mL B.=15.00mL C.<10.00mL D.>15.00mL
(2)步骤①发生反应的离子方程式为_______。
(3)达到滴定终点的现象是_______。
(4)实验中消耗了标准溶液4.00mL,所测水样中游离态氯的含量为_______。
(5)实验测得游离态氯的浓度比实际浓度偏大,造成误差的原因可能是_______(填标号)。
A.配制标准溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测水样
C.装标准溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
E.装标准溶液的滴定管滴定前尖嘴部分有气泡,滴定后气泡消失
II.沉淀滴定——滴定剂与被滴定物生成的沉淀比滴定剂与指示剂生成的沉淀更难溶;且二者之间,有明显的颜色差别。
(6)参考表中的数据,若用滴定NaSCN溶液,可选用的指示剂是_______(填标号)。
难溶物
颜色 白 浅黄 白 砖红 白
A. B. NaBr C. NaCN D. NaCl
17. (14分)某工厂产生的废渣中主要含有ZnO,另含有少量FeO、CuO、SiO2等,某科研人员设计的用废渣制取高纯ZnO的工艺流程图如图所示。
已知:25℃时,部分物质的Ksp相关信息如表所示:
CuS ZnS
(1)按照核外电子排布,把元素周期表划分为5个区。Zn位于________区,基态铁原子价层电子的轨道表示式为_____________
(2)“氧化”时发生反应的离子方程式为_______。
(3)“除铁”时除了加ZnO,还可以加入_______(写出一种物质的化学式)。
(4)若“氧化”后所得滤液中C(Zn2+)=1.2mol/L,C(Cu2+)=0.022mol/L,“除铁”操作中为了使铁元素完全除去(C(Fe3+)<10-5mol/L除去完全),又不影响高纯ZnO的产量,可以调节pH的范围是_______,滤渣B的主要成分为_______(填化学式)。
(5)有同学认为各步骤中加入的试剂不变,将该工艺流程设计为“酸浸”→“氧化”→“除铜”→“除铁”也可以除去和,并回收CuS和,该设计是否合理_______(填“是”或“否”),理由是_______。
(6)写出溶液D的主要溶质的电子式_______。
18.(12分)我国力争2030年前实现碳达峰,2060年前实现碳中和,CO2的综合利用是实现碳中和的有效措施之一。
(1)用反应Ⅰ可以在一定条件下合成CH3OH,该过程存在副反应Ⅱ
(2)2021年我国科学家首先实现了从CO2到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将CO2转化为CH3COOH.写出该过程中阴极的电极反应式:________________________。
宜春市重点中学2022-2023学年高二上学期期末考试
化学试卷
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A C B D A C B D D C B AB AD CD
15(14分每空2分)
(1)7; (2) (3)ds; 3d104s1 (4)D
(5)256/NAa3
16.(14分每空2分)
(1) ①. c ②. D
(2)
(3)滴入最后半滴时,溶液蓝色褪去,且半分钟内不恢复颜色
(4)2.84 (5)ACE (6)A
17.(14分除注明外每空2分)
(1) d (1分)略(1分)
(2)
(3)或 (1分)
(4) ①. 3
(6)
18.(12分每空2分)
(1)①+41.2
②温度升高,CO2的反应速率加快,反应Ⅱ为吸热反应,温度升高有利于反应正向进行且以反应2为主,CO2转化率增大 a 0.031
(2)
同课章节目录
