化学(科粤版)九下参考课件:6.4 金属珍惜和保护金属资源(共19张PPT)
文档属性
| 名称 | 化学(科粤版)九下参考课件:6.4 金属珍惜和保护金属资源(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第六章 金属
6.4 珍惜和保护金属资源
1.了解铁锈蚀的条件,并能根据铁锈蚀的条件正确选择防锈措施;
2.知道金属资源保护方法。
教学目标
PART 01
探究钢铁锈蚀的原因
这些金属表面都有锈迹,这些金属为什么会生锈呢?
观察图片
链接课本P183探究活动
【提出问题】:钢铁锈蚀的因素有哪些?
【提出假设】:铁在空气中容易氧化,据此推断,铁的生锈必然跟氧气有关。另外,在潮湿环境或在海水浸泡下,铁锈蚀的现象更加严重,由此推测:
(3)铁与水和氧气同时接触
(2)铁只与水接触
(1)铁只与氧气接触
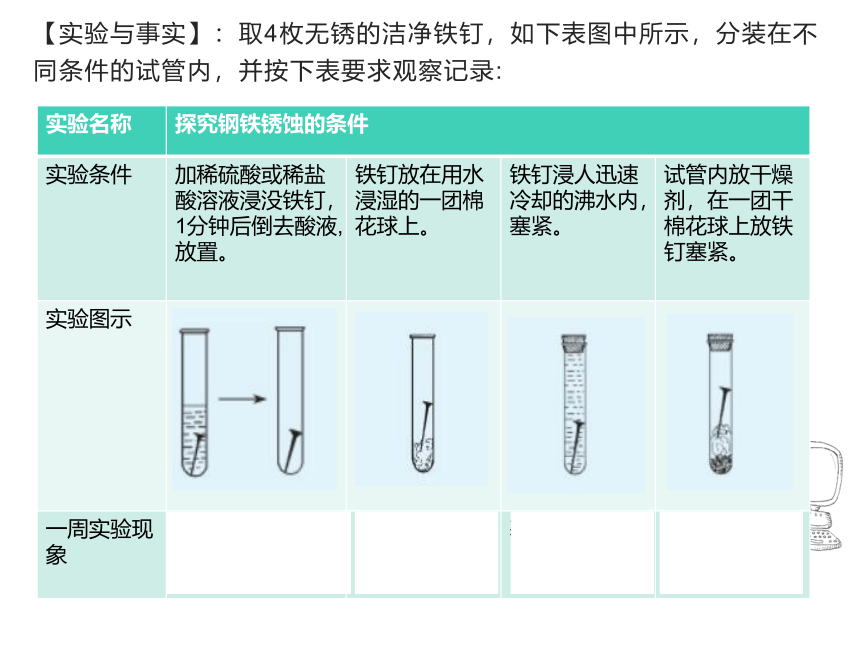
【实验与事实】:取4枚无锈的洁净铁钉,如下表图中所示,分装在不同条件的试管内,并按下表要求观察记录:
实验名称 探究钢铁锈蚀的条件 实验条件 加稀硫酸或稀盐酸溶液浸没铁钉,1分钟后倒去酸液,放置。 铁钉放在用水浸湿的一团棉花球上。 铁钉浸人迅速冷却的沸水内,塞紧。 试管内放干燥剂,在一团干棉花球上放铁钉塞紧。
实验图示
一周实验现象 锈蚀严重 有锈蚀 基本没现象 基本没现象
【分析】
铁钉只与水接触不生锈,
在干燥的空气中与氧气接触不生锈,与水和氧气同时接触生锈了
【解释与结论】
铁在有氧气和水等物质存在的条件下,发生复杂的化学反应,生成铁锈,其主要成分是氧化铁。
由于铁锈是一种疏松多孔的物质,水分子和氧分子能穿过它的空隙,不断向里层渗透,继续跟铁反应,直至全部被锈蚀。当铁接触易跟它发生反应的化学物质(如酸溶液等)时,就更容易被锈蚀了。
【反思与应用】
(1)在温度高,有食盐和酸等物质存在的环境下,铁生锈的速率会加快。如夏天做汤的铁锅,如不及时清洗干净,会很快生锈。
(2)铁生锈的利用:因为铁生锈能同时消耗空气中的氧气和水分,所以可以用铁粉作“双吸剂”,即食品中的防腐剂和干燥剂:铁生锈是缓慢氧化,会放出热量,将铁粉、食盐、活性炭等混合可以制作“暖身贴”。
PART 02
金属保护
世界上每年因锈蚀二报废的金属设备和材料高达产量的20%~40%,金属锈蚀一方面会导致资源浪费,另一方面也会污染环境,请观察下面几幅图片,你能说出为什么这些金属制品没有生锈吗?应当从哪些方面去保护金属资源呢?
保护金属资源,从两方面进行:一是金属资源的采掘与开发方面,二是从保护金属材料和制品方面——防止锈蚀
结论
从资源采掘和开发方面方面
有计划、合理地开采金属资源;
积极进行金属代用品的开发和研究,利用特殊性能的塑料去替代金属材料;
加强废旧金属的回收和再利用
从保护金属材料和制品方面——防止锈蚀
课堂练习
1.保护资源、合理利用资源是每个公民不可推卸的责任,下列做法不利于保护金属资源的是( )
A.用油漆、搪瓷等涂覆在金属表面形成保护层
B.用塑料等代替金属制造管道
C.铝制品经常用砂纸擦拭,保持光亮
D.有计划、合理开采矿物资源
C
2.如图是探究铁器锈蚀条件的装置。调节L端与R端的液面高度使之相同,塞紧橡皮塞,一周后观察。下列说法错误的是( )
A.a管中在靠近水面上方且近水面处铁钉上有明显的锈迹
B.L端液面低于R端
C.a管中铁钉明显生锈,b管中铁钉几乎不生锈
D.若将a管中的水改为海水则铁钉生锈更严重
B
3.铜及其化合物在生产、生活中都有广泛的应用。
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。
(1)青铜器属于_____(填“金属材料”或“合成材料”)。
(2)铜绿中铜元素的化合价为____,铜绿受热分解反应的化学方程式为____。
(3)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示
实验较长时间后,发现____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和____(写出试管中需要的物质)。
【答案】(1)金属材料
(2) +2
(3)D CO2、O2
【解析】
(1)青铜是一种铜合金,属于金属材料;
(2)铜绿中,氢氧根显﹣1价,碳酸根显﹣2价,设铜元素的化合价为x,则2x+(﹣1)×2+(﹣2)=0,x=+2;
铜绿受热后分解生成氧化铜、水和二氧化碳,化学方程式为:
(3)D试管中铜片与二氧化碳、氧气和水同时接触,故实验较长时间后,发现D试管中铜片最先生锈;
小组讨论后发现实验还不够完善,要得出正确的结论,实验缺少了把铜片置于装有干燥空气(或氧气和二氧化碳)的试管中,所以要补充的一个实验是Cu和CO2、O2充分接触。
感谢聆听
第六章 金属
6.4 珍惜和保护金属资源
1.了解铁锈蚀的条件,并能根据铁锈蚀的条件正确选择防锈措施;
2.知道金属资源保护方法。
教学目标
PART 01
探究钢铁锈蚀的原因
这些金属表面都有锈迹,这些金属为什么会生锈呢?
观察图片
链接课本P183探究活动
【提出问题】:钢铁锈蚀的因素有哪些?
【提出假设】:铁在空气中容易氧化,据此推断,铁的生锈必然跟氧气有关。另外,在潮湿环境或在海水浸泡下,铁锈蚀的现象更加严重,由此推测:
(3)铁与水和氧气同时接触
(2)铁只与水接触
(1)铁只与氧气接触
【实验与事实】:取4枚无锈的洁净铁钉,如下表图中所示,分装在不同条件的试管内,并按下表要求观察记录:
实验名称 探究钢铁锈蚀的条件 实验条件 加稀硫酸或稀盐酸溶液浸没铁钉,1分钟后倒去酸液,放置。 铁钉放在用水浸湿的一团棉花球上。 铁钉浸人迅速冷却的沸水内,塞紧。 试管内放干燥剂,在一团干棉花球上放铁钉塞紧。
实验图示
一周实验现象 锈蚀严重 有锈蚀 基本没现象 基本没现象
【分析】
铁钉只与水接触不生锈,
在干燥的空气中与氧气接触不生锈,与水和氧气同时接触生锈了
【解释与结论】
铁在有氧气和水等物质存在的条件下,发生复杂的化学反应,生成铁锈,其主要成分是氧化铁。
由于铁锈是一种疏松多孔的物质,水分子和氧分子能穿过它的空隙,不断向里层渗透,继续跟铁反应,直至全部被锈蚀。当铁接触易跟它发生反应的化学物质(如酸溶液等)时,就更容易被锈蚀了。
【反思与应用】
(1)在温度高,有食盐和酸等物质存在的环境下,铁生锈的速率会加快。如夏天做汤的铁锅,如不及时清洗干净,会很快生锈。
(2)铁生锈的利用:因为铁生锈能同时消耗空气中的氧气和水分,所以可以用铁粉作“双吸剂”,即食品中的防腐剂和干燥剂:铁生锈是缓慢氧化,会放出热量,将铁粉、食盐、活性炭等混合可以制作“暖身贴”。
PART 02
金属保护
世界上每年因锈蚀二报废的金属设备和材料高达产量的20%~40%,金属锈蚀一方面会导致资源浪费,另一方面也会污染环境,请观察下面几幅图片,你能说出为什么这些金属制品没有生锈吗?应当从哪些方面去保护金属资源呢?
保护金属资源,从两方面进行:一是金属资源的采掘与开发方面,二是从保护金属材料和制品方面——防止锈蚀
结论
从资源采掘和开发方面方面
有计划、合理地开采金属资源;
积极进行金属代用品的开发和研究,利用特殊性能的塑料去替代金属材料;
加强废旧金属的回收和再利用
从保护金属材料和制品方面——防止锈蚀
课堂练习
1.保护资源、合理利用资源是每个公民不可推卸的责任,下列做法不利于保护金属资源的是( )
A.用油漆、搪瓷等涂覆在金属表面形成保护层
B.用塑料等代替金属制造管道
C.铝制品经常用砂纸擦拭,保持光亮
D.有计划、合理开采矿物资源
C
2.如图是探究铁器锈蚀条件的装置。调节L端与R端的液面高度使之相同,塞紧橡皮塞,一周后观察。下列说法错误的是( )
A.a管中在靠近水面上方且近水面处铁钉上有明显的锈迹
B.L端液面低于R端
C.a管中铁钉明显生锈,b管中铁钉几乎不生锈
D.若将a管中的水改为海水则铁钉生锈更严重
B
3.铜及其化合物在生产、生活中都有广泛的应用。
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。
(1)青铜器属于_____(填“金属材料”或“合成材料”)。
(2)铜绿中铜元素的化合价为____,铜绿受热分解反应的化学方程式为____。
(3)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示
实验较长时间后,发现____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和____(写出试管中需要的物质)。
【答案】(1)金属材料
(2) +2
(3)D CO2、O2
【解析】
(1)青铜是一种铜合金,属于金属材料;
(2)铜绿中,氢氧根显﹣1价,碳酸根显﹣2价,设铜元素的化合价为x,则2x+(﹣1)×2+(﹣2)=0,x=+2;
铜绿受热后分解生成氧化铜、水和二氧化碳,化学方程式为:
(3)D试管中铜片与二氧化碳、氧气和水同时接触,故实验较长时间后,发现D试管中铜片最先生锈;
小组讨论后发现实验还不够完善,要得出正确的结论,实验缺少了把铜片置于装有干燥空气(或氧气和二氧化碳)的试管中,所以要补充的一个实验是Cu和CO2、O2充分接触。
感谢聆听
