2.3.2分子结构与物质的性质(第2课时 键的极性对化学性质的影响)(共27张PPT)含视频 高二化学同步课件(人教版2019选择性必修2)
文档属性
| 名称 | 2.3.2分子结构与物质的性质(第2课时 键的极性对化学性质的影响)(共27张PPT)含视频 高二化学同步课件(人教版2019选择性必修2) |

|
|
| 格式 | zip | ||
| 文件大小 | 95.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-24 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第三节 分子结构与物质的性质
第2课时:键的极性对化学性质的影响
第二章 分子结构与性质
学习
目标
PART
01
PART
02
酸性强弱判断方法
键的极性对化学性质的影响
乙醇、H2O与Na反应
水和钠 无水乙醇和钠
实验原理
实验现象
剧烈程度 2Na+2H2O=2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
浮、熔、游、响、红
钠沉入底部,有气体产生,最终钠粒消失,液体仍为无色透明。
剧烈程度:H2O>CH3CH2OH
受乙基的影响,乙醇分子中氢氧键的极性比水分子氢氧键的极性弱,乙醇比水更难电离出氢离子
乙醇、H2O与Na反应
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
【思考与讨论】
1、试从乙醇的结构分析乙醇为什么能和金属钠反应?
乙醇分子中氢氧键极性强,能够发生断裂
2、为什么乙醇和钠反应不如水与钠反应剧烈?
这是由于乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱。
基团之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
【思考与讨论】
01
键的极性对化学性质的影响
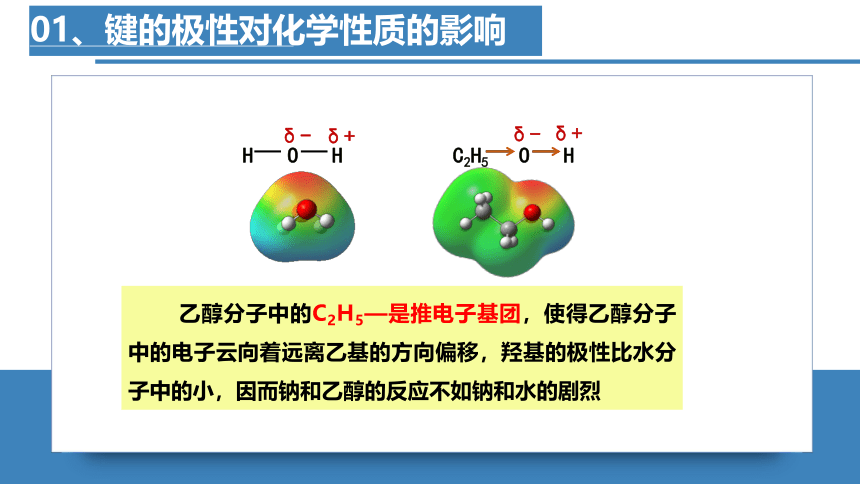
01、键的极性对化学性质的影响
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
01、键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
01、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考与讨论】
数值逐渐减小
01、键的极性对化学性质的影响
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
01、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考与讨论】
数值逐渐减小
01、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考与讨论】
由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸中的羧基的极性最大,更易电离出氢离子
01、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考与讨论】
数值逐渐减小
01、键的极性对化学性质的影响
三氟乙酸的酸性大于三氯乙酸
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大,更易电离出氢离子。
据此,酸性关系:CCl3COOH>CHCl2COOH>CH2ClCOOH
01、键的极性对化学性质的影响
1、键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大。
2、与羧基相邻的共价键的极性越大,过传导作用使羧基中羟基的极性越大,则羧酸的酸性越大。
1.试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
①>②>③>④>⑤>⑥
02
酸性强弱判断方法
02、酸性强弱判断方法
S
O
O
OH
HO
H2SO4
S
O
OH
HO
H2SO3
HClO4
Cl
O
O
O
HO
HClO3
Cl
O
O
HO
HClO2
Cl
O
HO
HClO
Cl
HO
H3PO4
P
OH
O
OH
HO
HNO2
HNO3
N
O
HO
N
O
HO
O
1、无机含氧酸的结构
(HO)Cl
(HO)ClO
(HO)ClO2
(HO)ClO3
(HO)NO
(HO)NO2
(HO)2SO2
(HO)2SO
(HO)3PO
通式:(HO)mROn
拓展:无机含氧酸
02、酸性强弱判断方法
弱酸 中强酸 强酸
(HO)Cl (HO)NO (HO)2SO (HO)3PO (HO)ClO (HO)NO2
(HO)2SO2
(HO)ClO2
(HO)ClO3
n=0 n=1 n=2或3
如果成酸元素R相同,非羟基氧越多,导致O-H极性越大,越容易电离出H+,酸性越强。弱酸 n=0;中强酸 n=1;强酸n=2或3。
(1)根据通式(HO)mROn判断
无机含氧酸分子的酸性强弱判断方法
02、酸性强弱判断方法
(1)根据元素周期律判断。
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如HF②同一周期元素的非金属氢化物的酸性从左向右逐渐增强,如H2S02、酸性强弱判断方法
③同一主族元素最高价氧化物对应水化物的酸性从上到下逐渐减弱,如HClO4>HBrO4>HIO4;HNO3>H3PO4;H2CO3>H2SiO3。
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如H3PO4简要回答表面活性剂的去污原理
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
表面活性剂
表面活性剂
1.下列物质中,酸性最强的是( )
A.HCOOH
B.HOCOOH
C.CH3COOH
D.C6H13COOH
A
(1)H2SiO3 H3PO4 H2SO4 HClO4
(2)HClO HClO3 HClO4
2、比较下列含氧酸酸性的强弱
<
<
<
<
<
第三节 分子结构与物质的性质
第2课时:键的极性对化学性质的影响
第二章 分子结构与性质
学习
目标
PART
01
PART
02
酸性强弱判断方法
键的极性对化学性质的影响
乙醇、H2O与Na反应
水和钠 无水乙醇和钠
实验原理
实验现象
剧烈程度 2Na+2H2O=2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
浮、熔、游、响、红
钠沉入底部,有气体产生,最终钠粒消失,液体仍为无色透明。
剧烈程度:H2O>CH3CH2OH
受乙基的影响,乙醇分子中氢氧键的极性比水分子氢氧键的极性弱,乙醇比水更难电离出氢离子
乙醇、H2O与Na反应
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
【思考与讨论】
1、试从乙醇的结构分析乙醇为什么能和金属钠反应?
乙醇分子中氢氧键极性强,能够发生断裂
2、为什么乙醇和钠反应不如水与钠反应剧烈?
这是由于乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱。
基团之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
【思考与讨论】
01
键的极性对化学性质的影响
01、键的极性对化学性质的影响
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
01、键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
01、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考与讨论】
数值逐渐减小
01、键的极性对化学性质的影响
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
01、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考与讨论】
数值逐渐减小
01、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考与讨论】
由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸中的羧基的极性最大,更易电离出氢离子
01、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考与讨论】
数值逐渐减小
01、键的极性对化学性质的影响
三氟乙酸的酸性大于三氯乙酸
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大,更易电离出氢离子。
据此,酸性关系:CCl3COOH>CHCl2COOH>CH2ClCOOH
01、键的极性对化学性质的影响
1、键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大。
2、与羧基相邻的共价键的极性越大,过传导作用使羧基中羟基的极性越大,则羧酸的酸性越大。
1.试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
①>②>③>④>⑤>⑥
02
酸性强弱判断方法
02、酸性强弱判断方法
S
O
O
OH
HO
H2SO4
S
O
OH
HO
H2SO3
HClO4
Cl
O
O
O
HO
HClO3
Cl
O
O
HO
HClO2
Cl
O
HO
HClO
Cl
HO
H3PO4
P
OH
O
OH
HO
HNO2
HNO3
N
O
HO
N
O
HO
O
1、无机含氧酸的结构
(HO)Cl
(HO)ClO
(HO)ClO2
(HO)ClO3
(HO)NO
(HO)NO2
(HO)2SO2
(HO)2SO
(HO)3PO
通式:(HO)mROn
拓展:无机含氧酸
02、酸性强弱判断方法
弱酸 中强酸 强酸
(HO)Cl (HO)NO (HO)2SO (HO)3PO (HO)ClO (HO)NO2
(HO)2SO2
(HO)ClO2
(HO)ClO3
n=0 n=1 n=2或3
如果成酸元素R相同,非羟基氧越多,导致O-H极性越大,越容易电离出H+,酸性越强。弱酸 n=0;中强酸 n=1;强酸n=2或3。
(1)根据通式(HO)mROn判断
无机含氧酸分子的酸性强弱判断方法
02、酸性强弱判断方法
(1)根据元素周期律判断。
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如HF
③同一主族元素最高价氧化物对应水化物的酸性从上到下逐渐减弱,如HClO4>HBrO4>HIO4;HNO3>H3PO4;H2CO3>H2SiO3。
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如H3PO4
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
表面活性剂
表面活性剂
1.下列物质中,酸性最强的是( )
A.HCOOH
B.HOCOOH
C.CH3COOH
D.C6H13COOH
A
(1)H2SiO3 H3PO4 H2SO4 HClO4
(2)HClO HClO3 HClO4
2、比较下列含氧酸酸性的强弱
<
<
<
<
<
