第十一单元 课题1 第1课时 生活中常见的盐-课件(共19张PPT)(人教版)
文档属性
| 名称 | 第十一单元 课题1 第1课时 生活中常见的盐-课件(共19张PPT)(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第十一单元 生活中常见的盐
课题1 生活中常见的盐
第1课时 氯化钠、碳酸钠、碳酸氢钠和碳酸钙
原从水中来,不敢水中行。
人人都要我,无我食不成。
打一物质
导入新课
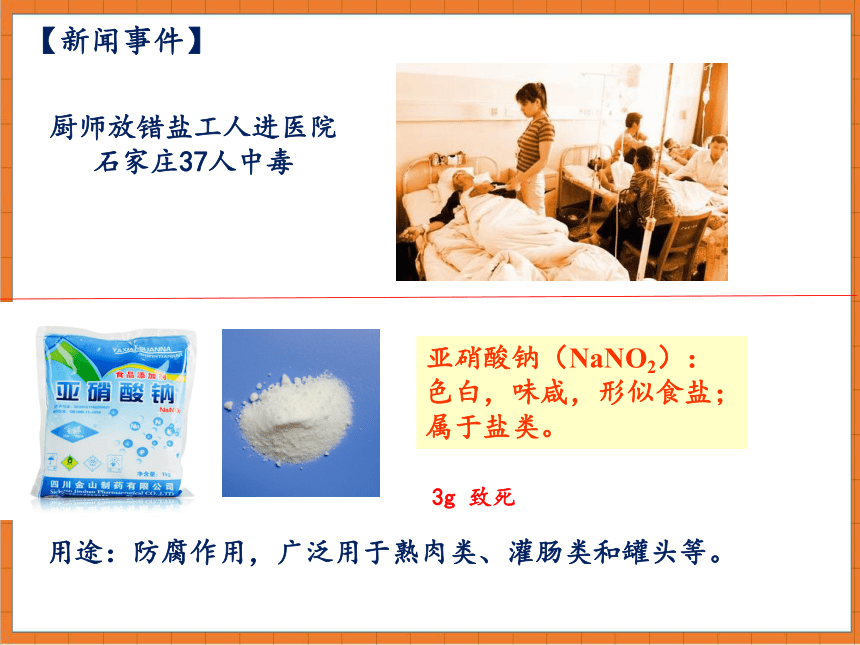
厨师放错盐工人进医院石家庄37人中毒
【新闻事件】
亚硝酸钠(NaNO2):色白,味咸,形似食盐;属于盐类。
3g 致死
用途:防腐作用,广泛用于熟肉类、灌肠类和罐头等。
知识点 1 盐和食盐
盐(结构):金属离子(铵根) + 酸根
K+
Ca2+
Na+
NH4+
+
Cl-
SO42-
CO32-
HCO3-
常见的盐:
NaCl 食盐(中性) 、 NH4Cl 氯化铵(中性) ;
Na2CO3 碳酸钠(碱性) 、NaHCO3 碳酸氢钠(碱性);CuSO4 硫酸铜(酸性)。
(1)俗称:食盐;
(2)化学式:NaCl;
(3)性状:白色晶体,易溶于水, 有咸味,溶液呈中性;
(4)主要来源:海水、盐湖、盐井、盐矿。
氯化钠
生活—调味、腌渍食品
氯化钠NaCl的用途
医疗—生理盐水NaCl
农业—选种
交通—融雪
氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
氯化钠在自然界中的分布
通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到粗盐。
氯化钠的获取
粗盐(含杂质)
蒸发池
结晶池
海水
海水晒盐
水分
蒸发
粗盐
母液
饱和溶液
NaCl及杂质
粗盐提纯—去除粗盐中的难溶性杂质
粗盐
可溶性杂质
难溶性杂质
√
难溶性杂质去除的思路:
加水,食盐溶解,而难溶性杂质不溶解;过滤,去渣,将食盐溶液蒸干水分,即可除去难溶杂质。
①溶解
②过滤
③蒸发
④转移
操作步骤:
溶解 过滤 蒸发 转移
玻璃棒:搅拌,加速溶解
玻璃棒:引流
玻璃棒:防止液体飞溅
·出现较多固体时,停止加热,用余热蒸干。
(蒸发皿)
化学式: Na2CO3;
俗名:纯碱、苏打;
物理性质:白色固体,易溶于水;
物质类别:盐(水溶液显碱性)。
1.碳酸钠
知识点 2 碳酸钠、碳酸氢钠和碳酸钙
用途:
工业原料,用于生产玻璃、造纸、纺织、洗涤剂等。
2NaCl + CO2 + H2O
碳酸钠Na2CO3的化学性质:
能使指示剂变色:水溶液呈碱性,可使紫色石蕊变蓝,酚酞试剂变红
能与酸反应:
CO32- + 2H+ = CO2 + H2O
能与某些可溶性碱反应:
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
Na2CO3 + 2HCl =
化学式: NaHCO3;
俗名:小苏打;
物理性质:白色固体,易溶于水;
物质类别:盐(水溶液显碱性)。
2.碳酸氢钠
用途:
用作发酵粉,烘焙糕点;制作苏打水、苏打饼干;还可以治疗胃酸过多。
碳酸氢钠NaHCO3的化学性质:
NaHCO3 + HCl =
水溶液呈碱性;
能与酸反应:
HCO3- + H+ = CO2 + H2O
受热易分解:
2NaHCO3 Na2CO3 + CO2 + H2O
NaCl + CO2 + H2O
3.碳酸钙
大理石、石灰石主要成分;
化学式: CaCO3;
物理性质:白色固体,难溶于水。
用途:
建筑材料;补钙剂;牙膏摩擦剂等。
碳酸钙CaCO3的化学性质:
CaCO3 + 2HCl =
能与酸反应:
CO32- + 2H+ = CO2 + H2O
高温能分解:
CaCO3 CaO + CO2
高温
CaCl2 + CO2 + H2O
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
NaHCO3 + HCl = NaCl + CO2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
用酸可检验出CO32-/HCO3-:
加稀盐酸/稀硫酸,产生气泡,将气体通入澄清石灰水,石灰水变浑浊,则证物质结构中含有CO32-或HCO3-。
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗 称 大理石、石灰石主要成分
颜色状态
溶解性
用 途
NaCl
食盐
白色固体
易溶
调味品、
生理盐水
Na2CO3
纯碱、
苏打
白色固体
易溶
玻璃、
造纸
NaHCO3
小苏打
白色固体
易溶
发酵粉、治
疗胃酸过多
CaCO3
白色固体
难溶
建筑材料、
补钙剂
课堂小结
第十一单元 生活中常见的盐
课题1 生活中常见的盐
第1课时 氯化钠、碳酸钠、碳酸氢钠和碳酸钙
原从水中来,不敢水中行。
人人都要我,无我食不成。
打一物质
导入新课
厨师放错盐工人进医院石家庄37人中毒
【新闻事件】
亚硝酸钠(NaNO2):色白,味咸,形似食盐;属于盐类。
3g 致死
用途:防腐作用,广泛用于熟肉类、灌肠类和罐头等。
知识点 1 盐和食盐
盐(结构):金属离子(铵根) + 酸根
K+
Ca2+
Na+
NH4+
+
Cl-
SO42-
CO32-
HCO3-
常见的盐:
NaCl 食盐(中性) 、 NH4Cl 氯化铵(中性) ;
Na2CO3 碳酸钠(碱性) 、NaHCO3 碳酸氢钠(碱性);CuSO4 硫酸铜(酸性)。
(1)俗称:食盐;
(2)化学式:NaCl;
(3)性状:白色晶体,易溶于水, 有咸味,溶液呈中性;
(4)主要来源:海水、盐湖、盐井、盐矿。
氯化钠
生活—调味、腌渍食品
氯化钠NaCl的用途
医疗—生理盐水NaCl
农业—选种
交通—融雪
氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
氯化钠在自然界中的分布
通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到粗盐。
氯化钠的获取
粗盐(含杂质)
蒸发池
结晶池
海水
海水晒盐
水分
蒸发
粗盐
母液
饱和溶液
NaCl及杂质
粗盐提纯—去除粗盐中的难溶性杂质
粗盐
可溶性杂质
难溶性杂质
√
难溶性杂质去除的思路:
加水,食盐溶解,而难溶性杂质不溶解;过滤,去渣,将食盐溶液蒸干水分,即可除去难溶杂质。
①溶解
②过滤
③蒸发
④转移
操作步骤:
溶解 过滤 蒸发 转移
玻璃棒:搅拌,加速溶解
玻璃棒:引流
玻璃棒:防止液体飞溅
·出现较多固体时,停止加热,用余热蒸干。
(蒸发皿)
化学式: Na2CO3;
俗名:纯碱、苏打;
物理性质:白色固体,易溶于水;
物质类别:盐(水溶液显碱性)。
1.碳酸钠
知识点 2 碳酸钠、碳酸氢钠和碳酸钙
用途:
工业原料,用于生产玻璃、造纸、纺织、洗涤剂等。
2NaCl + CO2 + H2O
碳酸钠Na2CO3的化学性质:
能使指示剂变色:水溶液呈碱性,可使紫色石蕊变蓝,酚酞试剂变红
能与酸反应:
CO32- + 2H+ = CO2 + H2O
能与某些可溶性碱反应:
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
Na2CO3 + 2HCl =
化学式: NaHCO3;
俗名:小苏打;
物理性质:白色固体,易溶于水;
物质类别:盐(水溶液显碱性)。
2.碳酸氢钠
用途:
用作发酵粉,烘焙糕点;制作苏打水、苏打饼干;还可以治疗胃酸过多。
碳酸氢钠NaHCO3的化学性质:
NaHCO3 + HCl =
水溶液呈碱性;
能与酸反应:
HCO3- + H+ = CO2 + H2O
受热易分解:
2NaHCO3 Na2CO3 + CO2 + H2O
NaCl + CO2 + H2O
3.碳酸钙
大理石、石灰石主要成分;
化学式: CaCO3;
物理性质:白色固体,难溶于水。
用途:
建筑材料;补钙剂;牙膏摩擦剂等。
碳酸钙CaCO3的化学性质:
CaCO3 + 2HCl =
能与酸反应:
CO32- + 2H+ = CO2 + H2O
高温能分解:
CaCO3 CaO + CO2
高温
CaCl2 + CO2 + H2O
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
NaHCO3 + HCl = NaCl + CO2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
用酸可检验出CO32-/HCO3-:
加稀盐酸/稀硫酸,产生气泡,将气体通入澄清石灰水,石灰水变浑浊,则证物质结构中含有CO32-或HCO3-。
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗 称 大理石、石灰石主要成分
颜色状态
溶解性
用 途
NaCl
食盐
白色固体
易溶
调味品、
生理盐水
Na2CO3
纯碱、
苏打
白色固体
易溶
玻璃、
造纸
NaHCO3
小苏打
白色固体
易溶
发酵粉、治
疗胃酸过多
CaCO3
白色固体
难溶
建筑材料、
补钙剂
课堂小结
同课章节目录
