化学人教版(2019)必修第一册4.2 元素周期律(共32张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2 元素周期律(共32张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-26 14:52:31 | ||
图片预览




文档简介
(共32张PPT)
第四章 物质结构 元素周期律
第二节 元素周期律
第1课时 元素性质的周期性变化规律
学习目标
1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化规律。
2.以第三周期的钠、镁、铝、硅、磷、硫、氯为例,掌握同周期主族元素金属性、非金属性的递变规律。
3.能结合有关资料说明元素周期律(表)对合成新物质、寻找新材料的指导作用。
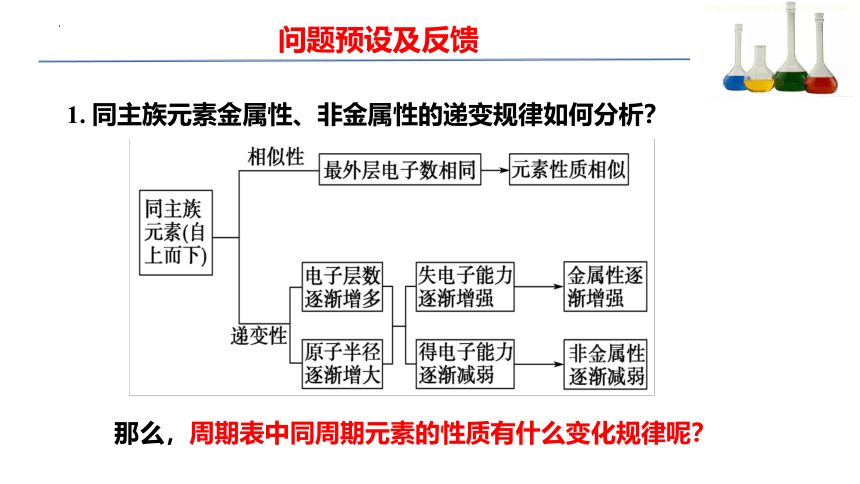
问题预设及反馈
1. 同主族元素金属性、非金属性的递变规律如何分析?
那么,周期表中同周期元素的性质有什么变化规律呢?
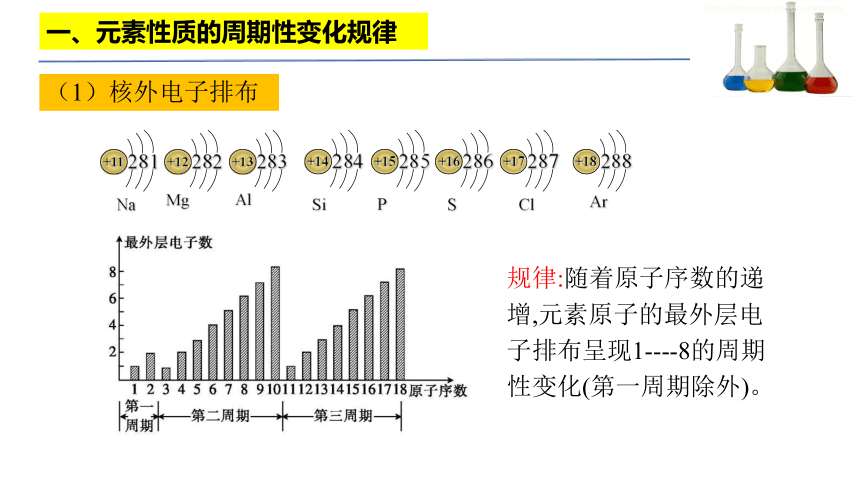
一、元素性质的周期性变化规律
(1)核外电子排布
规律:随着原子序数的递增,元素原子的最外层电子排布呈现1----8的周期性变化(第一周期除外)。
Na
Mg
Al
2
1
8
+11
2
2
8
+12
2
5
8
+15
2
6
8
+16
2
7
8
+17
2
8
8
+18
2
3
8
+13
2
4
8
+14
Si
P
S
Cl
Ar
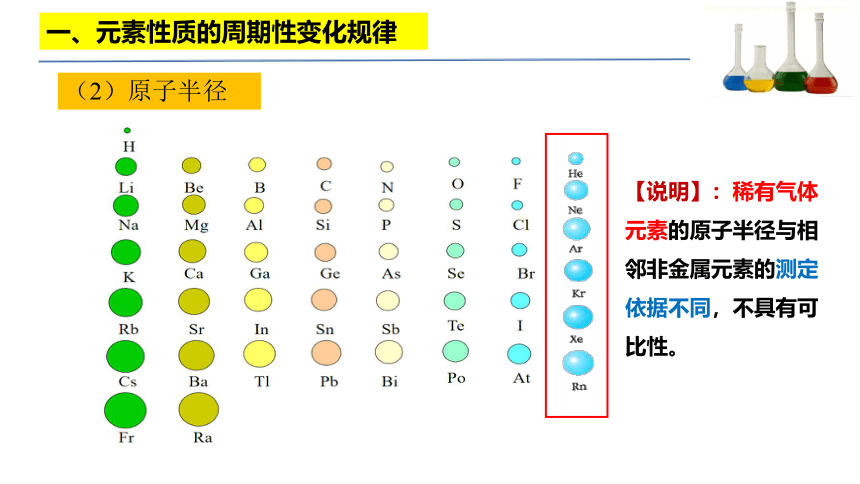
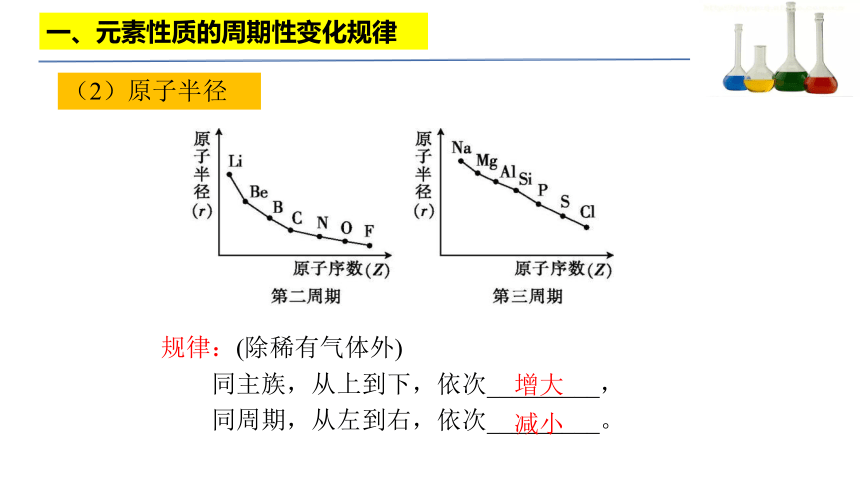
(2)原子半径
一、元素性质的周期性变化规律
【说明】:稀有气体元素的原子半径与相邻非金属元素的测定依据不同,不具有可比性。
规律:(除稀有气体外)
同主族,从上到下,依次_________,
同周期,从左到右,依次_________。
增大
减小
一、元素性质的周期性变化规律
(2)原子半径
思考:原子半径呈现上述变化规律的原因?
半径的影响因素:电子层数、核电荷数
同一主族,最外层电子数相同,从上到下,电子层数越多,原子半径越大。
同一周期,电子层数相同,从做到右,核电荷数的增加,原子核对核外电子的吸引能力 。核电荷数的增加半径 ,
增强
减小
例1、比较以下离子的半径大小 :
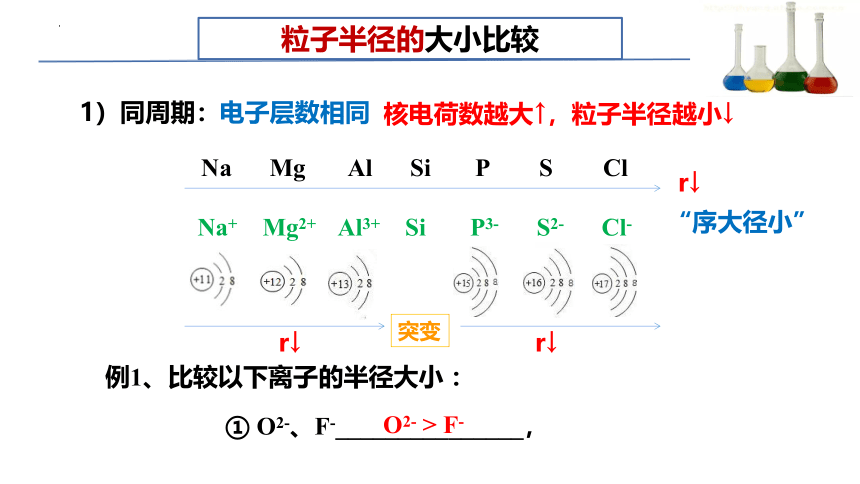
粒子半径的大小比较
“序大径小”
① O2-、F-_______________,
O2- > F-
1)同周期:
电子层数相同
核电荷数越大↑,粒子半径越小↓
Na Mg Al Si P S Cl
Na+ Mg2+ Al3+ Si P3- S2- Cl-
突变
r↓
r↓
r↓
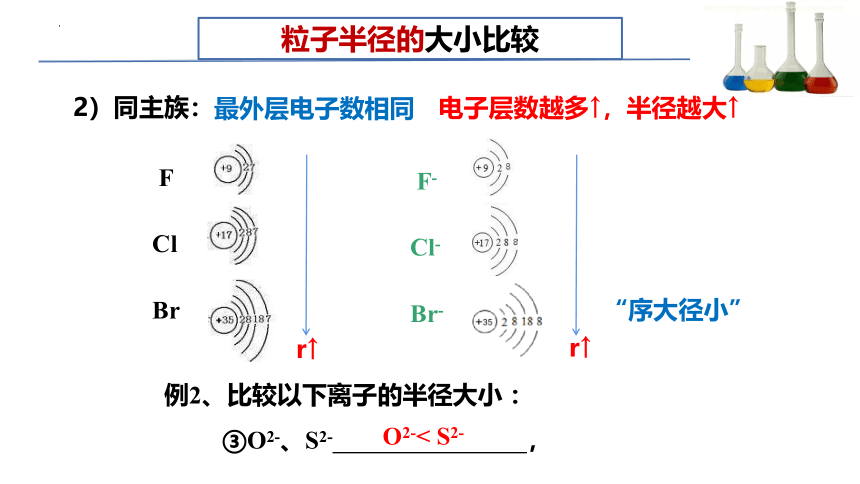
③O2-、S2- ,
例2、比较以下离子的半径大小 :
粒子半径的大小比较
2)同主族:
O2-< S2-
“序大径小”
电子层数越多↑,半径越大↑
最外层电子数相同
7
F
Cl
Br
F-
Cl-
Br-
r↑
r↑
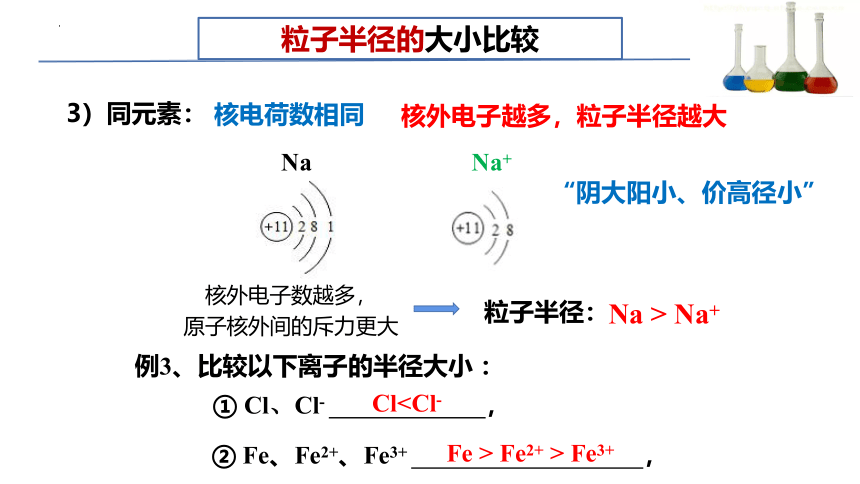
粒子半径的大小比较
3)同元素:
核外电子越多,粒子半径越大
“阴大阳小、价高径小”
核电荷数相同
Na
Na+
核外电子数越多,
原子核外间的斥力更大
Cl粒子半径:
Na > Na+
① Cl、Cl- ,
例3、比较以下离子的半径大小 :
② Fe、Fe2+、Fe3+ ,
Fe > Fe2+ > Fe3+
核电荷数越大,粒子半径越小
例4、比较以下离子的半径大小 :
O2- > Na+ > Mg2+ > Al3+
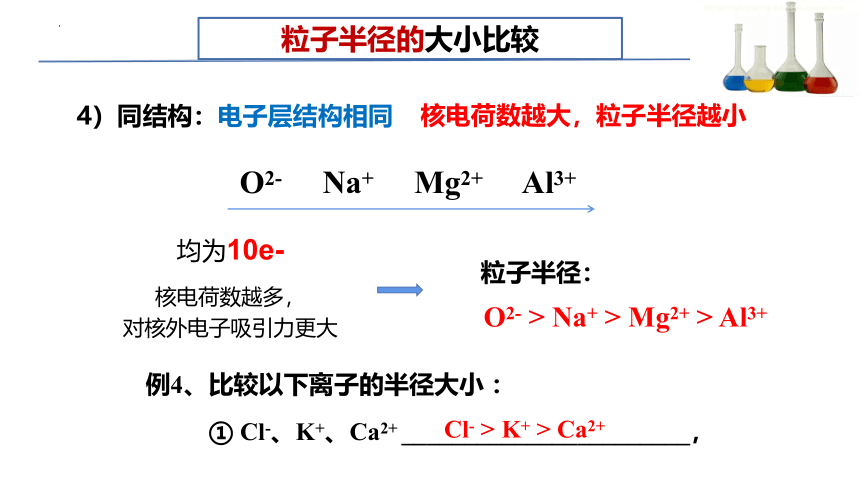
粒子半径的大小比较
① Cl-、K+、Ca2+ _______________________,
4)同结构:
电子层结构相同
O2- Na+ Mg2+ Al3+
均为10e-
粒子半径:
核电荷数越多,
对核外电子吸引力更大
Cl- > K+ > Ca2+
(电子层数相同时) 核电荷数越大,粒子半径越小。
[总结]离子半径的大小比较
2)看——核电荷数:
(最外层电子数相同时) 电子层数越多,半径越大。
1)看——电子层数
3)看——核外电子数:
(电子层数、核电荷数相同时)核外电子越多,粒子半径越大。
“三看”法
3、请对下列粒子半径大小进行排序
O 、S、Si 、Al
Na+ 、Mg2+、O2-、F-
学以致用
Mg2+Al>Si>S>O
1、短周期中,原子半径最大的是?
2、下列各组元素中,按原子半径依次增大的顺序排列的是( )
A.Na、Mg、Al B.Cl、P、S
C.Na、N、F D.Cl、Br、I
Na
D
原子序数 1 2
元素符号 H He
最高正化合价
最低负化合价
原子序数 3 4 5 6 7 8 9 10
元素符号 Li Be B C N O F Ne
最高正化合价
最低负化合价
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
最高正化合价
最低负化合价
+1 +2 +3 +4
-4 -3 -2 -1
+1 +2 +3 +4 +5 +6 +7
-4 -3 -2 -1
[探究]元素化合价的变化规律
+1
-1
0
0
0
+5
(3)化合价
(1)金属无负化合价,F无正价,O无最高正价。
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
元素符号 Na Mg Al Si P S Cl
最外层电子数 1 2 3 4 5 6 7
最高正化合价 +1 +2 +3 ___ +5 +6 ___
最低负化合价 -4 -3 -2 -1
+4
+7
(3)非金属元素:
(2)主族元素:
最高正价 = 主族序数 = 最外层电子数
(O、F除外)
|最高正价|+|最低负价|= 8
或 最低负价 = 最高正价-8
完成课本102页思考与讨论
2
3
1 →8
1 →8
0.186nm → 0.099nm
大 →小
+1 -----------→ +7
-4 →-1 →0
随着原子序数的递增
原子的核外电子排布
原子半径
化合价
呈现周期性的变化
(4)金属性、非金属性
[探究]元素金属性和非金属性的变化规律
[演示实验]取一块镁条,除去表面的氧化膜,加入水,滴加酚酞,观察现象;加热溶液,再观察现象。
【实验现象】
未加热时:
加热时:
溶液变红色
无现象
与Na和水的反应相比,反应难易程度如何?
Mg + 2H2O = Mg(OH)2 + H2↑
即金属性强弱:
Na Mg
>
与金属钠相比较,该反应明显困难,说明钠的金属性强于镁
[探究]元素金属性和非金属性的变化规律
[演示实验]向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象。
AlCl3溶液
氨水
HCl溶液
NaOH溶液
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
Al(OH)3+ 3H+ = Al3+ + 3H2O
Al(OH)3+ OH- = AlO2- + 2H2O
白色絮状沉淀
两性氢氧化物:与酸、碱都反应,生成盐和水的氢氧化物
科学事实:
碱性强弱:
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性氢氧化物
>
>
金属性强弱:
Na Mg Al
>
>
[探究]元素金属性和非金属性的变化规律
Si P S Cl
氧化物的水化物
酸 性
酸性变化
结 论
H2SiO3 H3PO4 H2SO4 HClO4
(硅酸) (磷酸) (硫酸) (高氯酸)
弱酸 中强酸 强酸 强酸
逐渐增强
非金属性逐渐增强
Si、P、S、Cl 非金属性强弱的比较
非金属性强弱:
Si P S Cl
<
<
<
[探究]元素金属性和非金属性的变化规律
(4)金属性、非金属性
金属性增强
、非金属性减弱
非金属性增强,金属性减弱
练习
1、下列不能说明氯元素的非金属性比硫元素强的事实是( )。
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强
③HClO4的酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
答案 A
2、下列递变规律正确的是( )。 A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱
D.Na+、Mg2+、Al3+的离子半径逐渐增大
答案 C
练习
3、下列各组元素性质的递变情况错误的是( )。
A.B、C、N原子最外层电子数依次增多
B.Na、Mg、Al元素最高正价依次升高
C.Li、Be、B原子半径依次增大
D.Be、Mg、Ca的电子层数依次增多
答案 C
练习
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属区
金属区
稀
有
气
体
元
素
金属性逐渐增强
金属性逐渐增强
Cs
Be
1、金属元素性质递变规律
既表现金属元素的性质,又表现非金属元素的性质。
左下:
金属性越强
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属区
金属区
稀
有
气
体
元
素
金属性逐渐增强
非金属性逐渐增强
非金属性逐渐增强
金属性逐渐增强
Cs
F
Be
2、非金属元素的性质递变规律
左下:
金属性越强
右上:
非金属性越强
例1、用元素符号或化学式填空,1-18号元素(除稀有气体元素):
1)最高价氧化物的水化物酸性最强的是 。
2)碱性最强的是 。
3)气态氢化物稳定性最强的是 。
4)原子半径最大的是__________。
NaOH
HClO4
HF
Na
二、元素周期表/律的应用
寻找新物质
(1)在金属与非金属分界处可以寻找半导体材料。
(2)研究氟、氯、硫、磷、砷附近元素,制造新农药。
(3)在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
二、元素周期表/律的应用
谢谢观看
第四章 物质结构 元素周期律
第二节 元素周期律
第1课时 元素性质的周期性变化规律
学习目标
1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化规律。
2.以第三周期的钠、镁、铝、硅、磷、硫、氯为例,掌握同周期主族元素金属性、非金属性的递变规律。
3.能结合有关资料说明元素周期律(表)对合成新物质、寻找新材料的指导作用。
问题预设及反馈
1. 同主族元素金属性、非金属性的递变规律如何分析?
那么,周期表中同周期元素的性质有什么变化规律呢?
一、元素性质的周期性变化规律
(1)核外电子排布
规律:随着原子序数的递增,元素原子的最外层电子排布呈现1----8的周期性变化(第一周期除外)。
Na
Mg
Al
2
1
8
+11
2
2
8
+12
2
5
8
+15
2
6
8
+16
2
7
8
+17
2
8
8
+18
2
3
8
+13
2
4
8
+14
Si
P
S
Cl
Ar
(2)原子半径
一、元素性质的周期性变化规律
【说明】:稀有气体元素的原子半径与相邻非金属元素的测定依据不同,不具有可比性。
规律:(除稀有气体外)
同主族,从上到下,依次_________,
同周期,从左到右,依次_________。
增大
减小
一、元素性质的周期性变化规律
(2)原子半径
思考:原子半径呈现上述变化规律的原因?
半径的影响因素:电子层数、核电荷数
同一主族,最外层电子数相同,从上到下,电子层数越多,原子半径越大。
同一周期,电子层数相同,从做到右,核电荷数的增加,原子核对核外电子的吸引能力 。核电荷数的增加半径 ,
增强
减小
例1、比较以下离子的半径大小 :
粒子半径的大小比较
“序大径小”
① O2-、F-_______________,
O2- > F-
1)同周期:
电子层数相同
核电荷数越大↑,粒子半径越小↓
Na Mg Al Si P S Cl
Na+ Mg2+ Al3+ Si P3- S2- Cl-
突变
r↓
r↓
r↓
③O2-、S2- ,
例2、比较以下离子的半径大小 :
粒子半径的大小比较
2)同主族:
O2-< S2-
“序大径小”
电子层数越多↑,半径越大↑
最外层电子数相同
7
F
Cl
Br
F-
Cl-
Br-
r↑
r↑
粒子半径的大小比较
3)同元素:
核外电子越多,粒子半径越大
“阴大阳小、价高径小”
核电荷数相同
Na
Na+
核外电子数越多,
原子核外间的斥力更大
Cl
Na > Na+
① Cl、Cl- ,
例3、比较以下离子的半径大小 :
② Fe、Fe2+、Fe3+ ,
Fe > Fe2+ > Fe3+
核电荷数越大,粒子半径越小
例4、比较以下离子的半径大小 :
O2- > Na+ > Mg2+ > Al3+
粒子半径的大小比较
① Cl-、K+、Ca2+ _______________________,
4)同结构:
电子层结构相同
O2- Na+ Mg2+ Al3+
均为10e-
粒子半径:
核电荷数越多,
对核外电子吸引力更大
Cl- > K+ > Ca2+
(电子层数相同时) 核电荷数越大,粒子半径越小。
[总结]离子半径的大小比较
2)看——核电荷数:
(最外层电子数相同时) 电子层数越多,半径越大。
1)看——电子层数
3)看——核外电子数:
(电子层数、核电荷数相同时)核外电子越多,粒子半径越大。
“三看”法
3、请对下列粒子半径大小进行排序
O 、S、Si 、Al
Na+ 、Mg2+、O2-、F-
学以致用
Mg2+
1、短周期中,原子半径最大的是?
2、下列各组元素中,按原子半径依次增大的顺序排列的是( )
A.Na、Mg、Al B.Cl、P、S
C.Na、N、F D.Cl、Br、I
Na
D
原子序数 1 2
元素符号 H He
最高正化合价
最低负化合价
原子序数 3 4 5 6 7 8 9 10
元素符号 Li Be B C N O F Ne
最高正化合价
最低负化合价
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
最高正化合价
最低负化合价
+1 +2 +3 +4
-4 -3 -2 -1
+1 +2 +3 +4 +5 +6 +7
-4 -3 -2 -1
[探究]元素化合价的变化规律
+1
-1
0
0
0
+5
(3)化合价
(1)金属无负化合价,F无正价,O无最高正价。
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
元素符号 Na Mg Al Si P S Cl
最外层电子数 1 2 3 4 5 6 7
最高正化合价 +1 +2 +3 ___ +5 +6 ___
最低负化合价 -4 -3 -2 -1
+4
+7
(3)非金属元素:
(2)主族元素:
最高正价 = 主族序数 = 最外层电子数
(O、F除外)
|最高正价|+|最低负价|= 8
或 最低负价 = 最高正价-8
完成课本102页思考与讨论
2
3
1 →8
1 →8
0.186nm → 0.099nm
大 →小
+1 -----------→ +7
-4 →-1 →0
随着原子序数的递增
原子的核外电子排布
原子半径
化合价
呈现周期性的变化
(4)金属性、非金属性
[探究]元素金属性和非金属性的变化规律
[演示实验]取一块镁条,除去表面的氧化膜,加入水,滴加酚酞,观察现象;加热溶液,再观察现象。
【实验现象】
未加热时:
加热时:
溶液变红色
无现象
与Na和水的反应相比,反应难易程度如何?
Mg + 2H2O = Mg(OH)2 + H2↑
即金属性强弱:
Na Mg
>
与金属钠相比较,该反应明显困难,说明钠的金属性强于镁
[探究]元素金属性和非金属性的变化规律
[演示实验]向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象。
AlCl3溶液
氨水
HCl溶液
NaOH溶液
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
Al(OH)3+ 3H+ = Al3+ + 3H2O
Al(OH)3+ OH- = AlO2- + 2H2O
白色絮状沉淀
两性氢氧化物:与酸、碱都反应,生成盐和水的氢氧化物
科学事实:
碱性强弱:
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性氢氧化物
>
>
金属性强弱:
Na Mg Al
>
>
[探究]元素金属性和非金属性的变化规律
Si P S Cl
氧化物的水化物
酸 性
酸性变化
结 论
H2SiO3 H3PO4 H2SO4 HClO4
(硅酸) (磷酸) (硫酸) (高氯酸)
弱酸 中强酸 强酸 强酸
逐渐增强
非金属性逐渐增强
Si、P、S、Cl 非金属性强弱的比较
非金属性强弱:
Si P S Cl
<
<
<
[探究]元素金属性和非金属性的变化规律
(4)金属性、非金属性
金属性增强
、非金属性减弱
非金属性增强,金属性减弱
练习
1、下列不能说明氯元素的非金属性比硫元素强的事实是( )。
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强
③HClO4的酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
答案 A
2、下列递变规律正确的是( )。 A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱
D.Na+、Mg2+、Al3+的离子半径逐渐增大
答案 C
练习
3、下列各组元素性质的递变情况错误的是( )。
A.B、C、N原子最外层电子数依次增多
B.Na、Mg、Al元素最高正价依次升高
C.Li、Be、B原子半径依次增大
D.Be、Mg、Ca的电子层数依次增多
答案 C
练习
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属区
金属区
稀
有
气
体
元
素
金属性逐渐增强
金属性逐渐增强
Cs
Be
1、金属元素性质递变规律
既表现金属元素的性质,又表现非金属元素的性质。
左下:
金属性越强
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属区
金属区
稀
有
气
体
元
素
金属性逐渐增强
非金属性逐渐增强
非金属性逐渐增强
金属性逐渐增强
Cs
F
Be
2、非金属元素的性质递变规律
左下:
金属性越强
右上:
非金属性越强
例1、用元素符号或化学式填空,1-18号元素(除稀有气体元素):
1)最高价氧化物的水化物酸性最强的是 。
2)碱性最强的是 。
3)气态氢化物稳定性最强的是 。
4)原子半径最大的是__________。
NaOH
HClO4
HF
Na
二、元素周期表/律的应用
寻找新物质
(1)在金属与非金属分界处可以寻找半导体材料。
(2)研究氟、氯、硫、磷、砷附近元素,制造新农药。
(3)在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
二、元素周期表/律的应用
谢谢观看
