化学人教版(2019)选择性必修1 2.3化学反应的方向(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.3化学反应的方向(共33张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 90.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-26 14:53:10 | ||
图片预览










文档简介
(共33张PPT)
走进化学反应原理
第2章 第3节 化学反应的方向
2019人教版选择性必修1
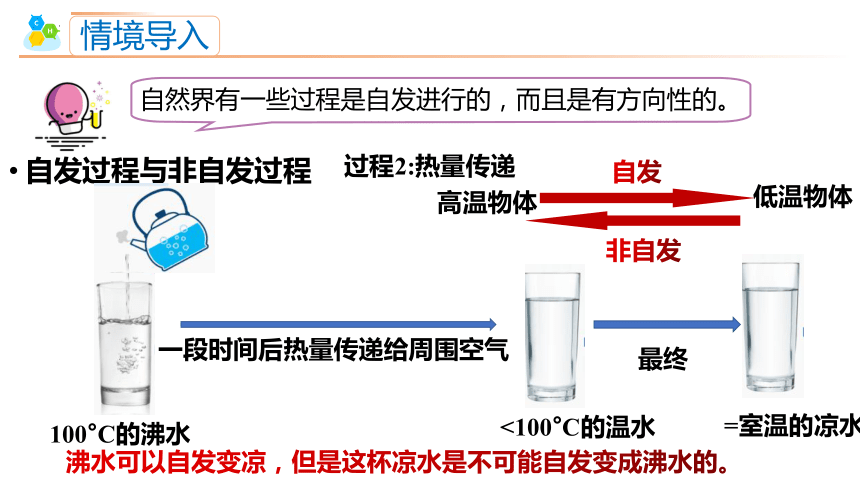
情境导入
自然界有一些过程是自发进行的,而且是有方向性的。
飞流直下:不借助外力
过程1:水的流动
高处
抽水上山:借助水泵,持续消耗电能
低处
自发
非自发
自发过程与非自发过程
情境导入
自然界有一些过程是自发进行的,而且是有方向性的。
自发过程与非自发过程
过程2:热量传递
高温物体
低温物体
自发
非自发
100°C的沸水
<100°C的温水
沸水可以自发变凉,但是这杯凉水是不可能自发变成沸水的。
一段时间后热量传递给周围空气
=室温的凉水
最终
情境导入
自发过程与非自发过程
过程3:氢气燃烧
自发
非自发
水的电解
2H2+O2=2H2O
①在一定条件下,如果一个过程是自发的,那么它的逆过程通常是非自发的
氢气的燃烧
自发
非自发
过程4:钢铁生锈
钢铁生锈也是
自发反应,但
是速率很慢。
情境导入
自然界有一些过程是自发进行的,而且是有方向性的。
自发过程与非自发过程
③“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
过程6:春天冰融水自发
过程5:冬天水结冰自发
过程8:暖炉取暖
过程7:墨滴在水中扩散
有些化学反应也是自发进行的,而且具有方向性。
如何判断化学反应自发进行的方向呢
模块一 化学反应的方向
1. 有些化学反应也是自发进行的,而且具有方向性。
如何判断化学反应自发进行的方向呢
(1) 如何判断化学平衡?化学平衡常数、转化率的计算公式是?
(2) 受浓度、温度、压强、催化剂的影响,化学平衡的如何移动?
知识回顾
课前预习
2.能自发的反应都是放热反应吗
.能自发的反应都是熵增反应吗
3.反应2N2O5(g) ==2NO2(g)+O2(g) ΔH>0
能自发进行的依据是什么?
知识回顾
(1)如何判断化学平衡?化学平衡常数、转化率的计算公式是?
(2)受浓度、温度、压强、催化剂的影响,化学平衡的如何移动?
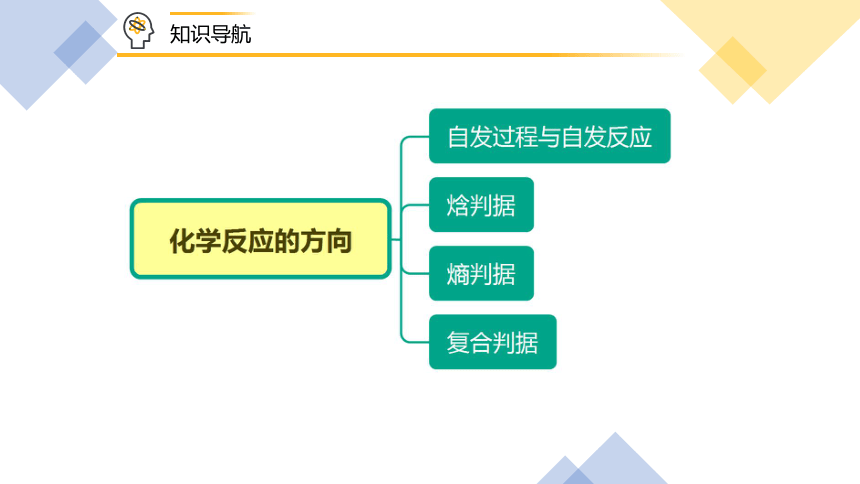
知识导航
一、化学反应的方向
知识精讲
水从高处到低处可以用来发电
1.自发反应:不借助外力,自动发生的反应。
①一般来说,正反应是自发,则逆反应是非自发。
②“自发”只是有发生的趋势,并不代表实际发生,更不能确定发生的速率。
“非自发”也不代表不能发生。
氢气燃烧可以设计成原电池
③“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
一、化学反应的方向
知识精讲
2.焓判据:
自热小火锅探秘
品 名:
主要成分:
净 含 量:
贮存条件:
保质期:
使用方法:
生产日期:
食品专用发热包
氧化钙、铝粉、碳酸氢钠
50克
存放于阴凉干燥处
18个月
撕开塑料袋后加常温水发热
见喷码
一、化学反应的方向
知识精讲
2.焓判据:
自热小火锅探秘
品 名:
主要成分:
净 含 量:
贮存条件:
保质期:
使用方法:
生产日期:
食品专用发热包
氧化钙、铝粉、碳酸氢钠
50克
存放于阴凉干燥处
18个月
撕开塑料袋后加常温水发热
见喷码
1.发热包里的物质与水发生了哪些反应?各物质在发热包中所起的作用?
2.这些反应有什么共同的特点?
自发
放热
3.通过对发热包里反应的研究,大家认为什么反应可以自发进行?
焓判据:ΔH<0 (放热),一般可自发进行(焓减)。
4.为什么化学反应有向放热方向自发进行的倾向?
能量越低越稳定,体系有自发趋向稳定的倾向。
ΔH<0 (放热),一般可自发进行(焓减)。
一、化学反应的方向
知识精讲
2.焓判据:ΔH<0 (放热),一般可自发进行(焓减)。
思考1.能自发的反应都是放热反应吗
神奇的自冷冰袋
一、化学反应的方向
知识精讲
2.焓判据:ΔH<0 (放热),一般可自发进行(焓减)。
思考1.能自发的反应都是放热反应吗
神奇的冰袋
尿素溶解吸收热量
冰袋自冷的原理?
一、化学反应的方向
知识精讲
2.焓判据:ΔH<0 (放热),一般可自发进行(焓减)。
思考1.能自发的反应都是放热反应吗
2NH4Cl(s)+Ba(OH)2·8H2O(s)==2NH3(g)+BaCl2(s)+10H2O(l)
实验室里的自制冰袋
△H>0
焓变是自发依据之一
但不是唯一依据
一、化学反应的方向
知识精讲
2NH4Cl(s)+Ba(OH)2·8H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) △H>0
尿素分子
水分子
尿素溶解吸收热量
有序
无序
一、化学反应的方向
知识精讲
2NH4Cl(s)+Ba(OH)2·8H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) △H>0
无序
有序
一、化学反应的方向
知识精讲
3.熵判据:
克劳修斯
(德国)
(1)熵(符号为S ):描述体系混乱度的物理量.
同一物质熵值: 气态>液态>固态
水蒸气
188.7Jmol-1K-1
液态水
69.9Jmol-1K-1
固态水
47.9Jmol-1K-1
一、化学反应的方向
知识精讲
3.熵判据:ΔS>0 (混乱度增加),一般可自发进行(熵增)。
克劳修斯
(德国)
(1)熵(符号为S ):描述体系混乱度的物理量.
(2)熵增原理:ΔS>0 (混乱度增加),一般可自发进行(熵增).
熵变:△S=S生成物总熵-S反应物总熵
有序
无序
△S>0
S越大
熵增(导致混乱度增加)的一些因素
①同一物质熵值:气态>液态>固态
②固体的溶解过程、墨水扩散过程和气体扩散过程。
③反应过程中气体物质的量增加的反应。
熵的定义
【思考与讨论】?
判断下列在一定条件下,可自发进行的反应的熵是如何变化的?
(1)NH4HCO3(s)+CH3COOH(aq)=CH3COONH4 (aq)+CO2(g)+H2O(l)
(2)CaCO3(s)=CaO(s)+CO2(g)
(3)2NaHCO3(s)=Na2CO3 (s)+CO2(g)+H2O(g)
(4)N2(g)+3H2(g)=2NH3(g)
△H=-92.2kJ/mol
△S=334.3Jmol-1K-1
△S=-198.2Jmol-1K-1
△S=169.6Jmol-1K-1
△S=184.0 Jmol-1K-1
一、化学反应的方向
知识精讲
3.熵判据:ΔS>0 (混乱度增加),一般可自发进行(熵增)。
思考2.能自发的反应都是熵增反应吗
高温
CaCO3(s)=CaO(s)+CO2(g )
△H=+178.2KJ·mol-1 △S=+169.6J·mol-1·K-1
T
熵变是自发依据之一
但不是唯一依据
一、化学反应的方向
知识精讲
4.复合判据(自由能):
吉布斯
(美国)
△G=△H - T△S
△G<0,反应自发进行
△G>0,反应不自发进行
△G=0,平衡状态
(1)公式:
(2)在等温等压的条件下:
(3)温度与反应方向关系::
ΔH
所有温度能自发
一定不能自发
高温下能自发
低温下能自发
ΔS
ΔH<0
ΔS>0
ΔH>0
ΔS>0
ΔH>0
ΔS<0
ΔH<0
ΔS<0
【思考与讨论】?
△H (298K)=+178.2 kJ·mol-1
△S (298K)=+169.6 J·mol-1·K-1
(1)CaCO3(s)=CaO(s)+CO2(g)
【思考1】在298K、 101Kpa下,判断下列反应能否自发进行
G= H-T S
=178.2kJ·mol-1-298K×(169.6 ×10-3 ) kJ·mol-1·K-1
=128kJ·mol-1 >0
常温常压下正向不能自发进行
【思考2】请同学们用所学的自由能公式判断这个反应能否自发进行?
(2)TiO2(s)+2Cl2(g)=TICl4(l)+O2(g) ΔH=+161.9kJ·mol-1
ΔS=-38.4J·mol-1·K-1
ΔH>0
ΔS<0
该反应在任何温度下都不能自发进行。
(3)TiO2(s)+2Cl2(g)+2C(石墨)=TICl4(l)+2CO(g) ΔH=-59.2 kJ·mol-1
ΔS=+141.0 J·mol-1·K-1
ΔH<0 ΔS>0 该反应在任何温度下都能自发进行。
课堂小结
ΔH
ΔS
高温下能自发进行
一定不能自发进行
低温下能自发进行
一定能自发进行
△G=△H - T△S
△G<0,反应自发进行
公式:
复合判据(自由能):
温度与反应方向关系:
题型三:自由能判断反应进行的方向
例1:.某化学反应的ΔH=-122 kJ·mol-1,ΔS=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
题中ΔH<0、ΔS>0,故必有ΔH-TΔS<0,故在任何温度下都能自发进行。
A
D
题型三:自由能判断反应进行的方向
【变1-1】
【变1-2】焦炭常用于冶炼工业。已知反应①:2C(s)+O2(g)=2CO(g);反应②:2CO(g)+O2(g)=2CO2(g),反应①、②的反应趋势与温度关系如图所示。下列说法错误的是
A.反应②2CO(g)+O2(g)=2CO2(g)的ΔS<0,ΔH<0
B.983K是两个反应主次趋势变化的转折点
C.L1对应反应①
D.当温度低于983K时,过量焦炭的氧化产物以反应②生成CO2为主
C
题型三:自由能判断反应进行的方向
题型二:熵的大小比较
【例2】请按要求回答下列问题(填“>”或“<”,下同)。
(1)溶解少量蔗糖于水中,ΔS 0。
(2)乙烯聚合成聚乙烯,ΔS 0。
(3)CaCO3(s)加热分解生成CaO(s)和CO2(g),ΔS 0。
(4)H2O(s)→H2O(l)→H2O(g)ΔS 0。
(5) 2N2O5(g) 4NO2(g)+O2(g) ΔS 0。
>
<
>
>
>
导致混乱度增加的一些因素
(1)同一物质S(g)>S(l)>S(s)。
(2)固体的溶解过程、墨水扩散过程和气体扩散过程。
(3)反应过程中气体物质的量增加的反应。
变式2—1:(2021·浙江高考真题)相同温度和压强下,关于物质熵的大小比较,合理的是
题型二:熵的大小比较
变式2—2已知下列反应都能自发进行,其中不能用“焓判据”解释的是( )
A.2Na(s)+Cl2(g)=2NaCl(s) ΔH<0
B.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH<0
C.
D.2Mg(s)+O2(g)=2MgO(s) ΔH<0
【答案】C
C
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) ΔH>0
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) ΔH>0
【例3】(2021·莆田第七中学高二期末)下列过程是非自发的是
A.水由高处向低处流
B.氯气和溴化钾溶液的反应
C.铁在潮湿空气中生锈
D.室温下水结成冰
D
题型一:自发过程与自发反应
课堂检测
【变式3—1】下列关于自发过程的叙述正确的是( )
A.只有不需要任何条件就能够自动进行的过程才是自发过程。
B.需要加热才能进行的过程肯定不是自发过程。
C.同一可逆反应的正、逆反应在不同条件下都有自发进行的可能。
D.非自发过程在任何条件下都不可能转化为自发过程。
C
课堂小结
走进化学反应原理
第2章 第3节 化学反应的方向
2019人教版选择性必修1
情境导入
自然界有一些过程是自发进行的,而且是有方向性的。
飞流直下:不借助外力
过程1:水的流动
高处
抽水上山:借助水泵,持续消耗电能
低处
自发
非自发
自发过程与非自发过程
情境导入
自然界有一些过程是自发进行的,而且是有方向性的。
自发过程与非自发过程
过程2:热量传递
高温物体
低温物体
自发
非自发
100°C的沸水
<100°C的温水
沸水可以自发变凉,但是这杯凉水是不可能自发变成沸水的。
一段时间后热量传递给周围空气
=室温的凉水
最终
情境导入
自发过程与非自发过程
过程3:氢气燃烧
自发
非自发
水的电解
2H2+O2=2H2O
①在一定条件下,如果一个过程是自发的,那么它的逆过程通常是非自发的
氢气的燃烧
自发
非自发
过程4:钢铁生锈
钢铁生锈也是
自发反应,但
是速率很慢。
情境导入
自然界有一些过程是自发进行的,而且是有方向性的。
自发过程与非自发过程
③“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
过程6:春天冰融水自发
过程5:冬天水结冰自发
过程8:暖炉取暖
过程7:墨滴在水中扩散
有些化学反应也是自发进行的,而且具有方向性。
如何判断化学反应自发进行的方向呢
模块一 化学反应的方向
1. 有些化学反应也是自发进行的,而且具有方向性。
如何判断化学反应自发进行的方向呢
(1) 如何判断化学平衡?化学平衡常数、转化率的计算公式是?
(2) 受浓度、温度、压强、催化剂的影响,化学平衡的如何移动?
知识回顾
课前预习
2.能自发的反应都是放热反应吗
.能自发的反应都是熵增反应吗
3.反应2N2O5(g) ==2NO2(g)+O2(g) ΔH>0
能自发进行的依据是什么?
知识回顾
(1)如何判断化学平衡?化学平衡常数、转化率的计算公式是?
(2)受浓度、温度、压强、催化剂的影响,化学平衡的如何移动?
知识导航
一、化学反应的方向
知识精讲
水从高处到低处可以用来发电
1.自发反应:不借助外力,自动发生的反应。
①一般来说,正反应是自发,则逆反应是非自发。
②“自发”只是有发生的趋势,并不代表实际发生,更不能确定发生的速率。
“非自发”也不代表不能发生。
氢气燃烧可以设计成原电池
③“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
一、化学反应的方向
知识精讲
2.焓判据:
自热小火锅探秘
品 名:
主要成分:
净 含 量:
贮存条件:
保质期:
使用方法:
生产日期:
食品专用发热包
氧化钙、铝粉、碳酸氢钠
50克
存放于阴凉干燥处
18个月
撕开塑料袋后加常温水发热
见喷码
一、化学反应的方向
知识精讲
2.焓判据:
自热小火锅探秘
品 名:
主要成分:
净 含 量:
贮存条件:
保质期:
使用方法:
生产日期:
食品专用发热包
氧化钙、铝粉、碳酸氢钠
50克
存放于阴凉干燥处
18个月
撕开塑料袋后加常温水发热
见喷码
1.发热包里的物质与水发生了哪些反应?各物质在发热包中所起的作用?
2.这些反应有什么共同的特点?
自发
放热
3.通过对发热包里反应的研究,大家认为什么反应可以自发进行?
焓判据:ΔH<0 (放热),一般可自发进行(焓减)。
4.为什么化学反应有向放热方向自发进行的倾向?
能量越低越稳定,体系有自发趋向稳定的倾向。
ΔH<0 (放热),一般可自发进行(焓减)。
一、化学反应的方向
知识精讲
2.焓判据:ΔH<0 (放热),一般可自发进行(焓减)。
思考1.能自发的反应都是放热反应吗
神奇的自冷冰袋
一、化学反应的方向
知识精讲
2.焓判据:ΔH<0 (放热),一般可自发进行(焓减)。
思考1.能自发的反应都是放热反应吗
神奇的冰袋
尿素溶解吸收热量
冰袋自冷的原理?
一、化学反应的方向
知识精讲
2.焓判据:ΔH<0 (放热),一般可自发进行(焓减)。
思考1.能自发的反应都是放热反应吗
2NH4Cl(s)+Ba(OH)2·8H2O(s)==2NH3(g)+BaCl2(s)+10H2O(l)
实验室里的自制冰袋
△H>0
焓变是自发依据之一
但不是唯一依据
一、化学反应的方向
知识精讲
2NH4Cl(s)+Ba(OH)2·8H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) △H>0
尿素分子
水分子
尿素溶解吸收热量
有序
无序
一、化学反应的方向
知识精讲
2NH4Cl(s)+Ba(OH)2·8H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) △H>0
无序
有序
一、化学反应的方向
知识精讲
3.熵判据:
克劳修斯
(德国)
(1)熵(符号为S ):描述体系混乱度的物理量.
同一物质熵值: 气态>液态>固态
水蒸气
188.7Jmol-1K-1
液态水
69.9Jmol-1K-1
固态水
47.9Jmol-1K-1
一、化学反应的方向
知识精讲
3.熵判据:ΔS>0 (混乱度增加),一般可自发进行(熵增)。
克劳修斯
(德国)
(1)熵(符号为S ):描述体系混乱度的物理量.
(2)熵增原理:ΔS>0 (混乱度增加),一般可自发进行(熵增).
熵变:△S=S生成物总熵-S反应物总熵
有序
无序
△S>0
S越大
熵增(导致混乱度增加)的一些因素
①同一物质熵值:气态>液态>固态
②固体的溶解过程、墨水扩散过程和气体扩散过程。
③反应过程中气体物质的量增加的反应。
熵的定义
【思考与讨论】?
判断下列在一定条件下,可自发进行的反应的熵是如何变化的?
(1)NH4HCO3(s)+CH3COOH(aq)=CH3COONH4 (aq)+CO2(g)+H2O(l)
(2)CaCO3(s)=CaO(s)+CO2(g)
(3)2NaHCO3(s)=Na2CO3 (s)+CO2(g)+H2O(g)
(4)N2(g)+3H2(g)=2NH3(g)
△H=-92.2kJ/mol
△S=334.3Jmol-1K-1
△S=-198.2Jmol-1K-1
△S=169.6Jmol-1K-1
△S=184.0 Jmol-1K-1
一、化学反应的方向
知识精讲
3.熵判据:ΔS>0 (混乱度增加),一般可自发进行(熵增)。
思考2.能自发的反应都是熵增反应吗
高温
CaCO3(s)=CaO(s)+CO2(g )
△H=+178.2KJ·mol-1 △S=+169.6J·mol-1·K-1
T
熵变是自发依据之一
但不是唯一依据
一、化学反应的方向
知识精讲
4.复合判据(自由能):
吉布斯
(美国)
△G=△H - T△S
△G<0,反应自发进行
△G>0,反应不自发进行
△G=0,平衡状态
(1)公式:
(2)在等温等压的条件下:
(3)温度与反应方向关系::
ΔH
所有温度能自发
一定不能自发
高温下能自发
低温下能自发
ΔS
ΔH<0
ΔS>0
ΔH>0
ΔS>0
ΔH>0
ΔS<0
ΔH<0
ΔS<0
【思考与讨论】?
△H (298K)=+178.2 kJ·mol-1
△S (298K)=+169.6 J·mol-1·K-1
(1)CaCO3(s)=CaO(s)+CO2(g)
【思考1】在298K、 101Kpa下,判断下列反应能否自发进行
G= H-T S
=178.2kJ·mol-1-298K×(169.6 ×10-3 ) kJ·mol-1·K-1
=128kJ·mol-1 >0
常温常压下正向不能自发进行
【思考2】请同学们用所学的自由能公式判断这个反应能否自发进行?
(2)TiO2(s)+2Cl2(g)=TICl4(l)+O2(g) ΔH=+161.9kJ·mol-1
ΔS=-38.4J·mol-1·K-1
ΔH>0
ΔS<0
该反应在任何温度下都不能自发进行。
(3)TiO2(s)+2Cl2(g)+2C(石墨)=TICl4(l)+2CO(g) ΔH=-59.2 kJ·mol-1
ΔS=+141.0 J·mol-1·K-1
ΔH<0 ΔS>0 该反应在任何温度下都能自发进行。
课堂小结
ΔH
ΔS
高温下能自发进行
一定不能自发进行
低温下能自发进行
一定能自发进行
△G=△H - T△S
△G<0,反应自发进行
公式:
复合判据(自由能):
温度与反应方向关系:
题型三:自由能判断反应进行的方向
例1:.某化学反应的ΔH=-122 kJ·mol-1,ΔS=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
题中ΔH<0、ΔS>0,故必有ΔH-TΔS<0,故在任何温度下都能自发进行。
A
D
题型三:自由能判断反应进行的方向
【变1-1】
【变1-2】焦炭常用于冶炼工业。已知反应①:2C(s)+O2(g)=2CO(g);反应②:2CO(g)+O2(g)=2CO2(g),反应①、②的反应趋势与温度关系如图所示。下列说法错误的是
A.反应②2CO(g)+O2(g)=2CO2(g)的ΔS<0,ΔH<0
B.983K是两个反应主次趋势变化的转折点
C.L1对应反应①
D.当温度低于983K时,过量焦炭的氧化产物以反应②生成CO2为主
C
题型三:自由能判断反应进行的方向
题型二:熵的大小比较
【例2】请按要求回答下列问题(填“>”或“<”,下同)。
(1)溶解少量蔗糖于水中,ΔS 0。
(2)乙烯聚合成聚乙烯,ΔS 0。
(3)CaCO3(s)加热分解生成CaO(s)和CO2(g),ΔS 0。
(4)H2O(s)→H2O(l)→H2O(g)ΔS 0。
(5) 2N2O5(g) 4NO2(g)+O2(g) ΔS 0。
>
<
>
>
>
导致混乱度增加的一些因素
(1)同一物质S(g)>S(l)>S(s)。
(2)固体的溶解过程、墨水扩散过程和气体扩散过程。
(3)反应过程中气体物质的量增加的反应。
变式2—1:(2021·浙江高考真题)相同温度和压强下,关于物质熵的大小比较,合理的是
题型二:熵的大小比较
变式2—2已知下列反应都能自发进行,其中不能用“焓判据”解释的是( )
A.2Na(s)+Cl2(g)=2NaCl(s) ΔH<0
B.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH<0
C.
D.2Mg(s)+O2(g)=2MgO(s) ΔH<0
【答案】C
C
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) ΔH>0
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) ΔH>0
【例3】(2021·莆田第七中学高二期末)下列过程是非自发的是
A.水由高处向低处流
B.氯气和溴化钾溶液的反应
C.铁在潮湿空气中生锈
D.室温下水结成冰
D
题型一:自发过程与自发反应
课堂检测
【变式3—1】下列关于自发过程的叙述正确的是( )
A.只有不需要任何条件就能够自动进行的过程才是自发过程。
B.需要加热才能进行的过程肯定不是自发过程。
C.同一可逆反应的正、逆反应在不同条件下都有自发进行的可能。
D.非自发过程在任何条件下都不可能转化为自发过程。
C
课堂小结
