2022-2023学年鲁科版高中化学选择性必修1 1.3.1趣味电解-电解的原理(共18张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学选择性必修1 1.3.1趣味电解-电解的原理(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-24 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
趣味电解
——电解的基本原理
课标要求与核心素养
1、从宏观和微观的角度理解电解池中电子和阴阳离子的移动、阴阳两极
上的反应及其变化,培养宏观辨识与微观探析的核心素养。
2、建立对电解过程系统分析认识的思维模型,理解电解的规律,会判断
电解的产物,会书写电极反应式和总反应式,培养证据推理与模型认
知的核心素养。
3、通过实验探究激发学生的学习热情和求知欲,培养科学探究与创新精
神的核心素养。
2、电解池的定义:
3、电解池的构成:
1、电解的定义
在直流电作用下,电解质在两个电极上分别发生 和 的过程,实现电能转变为化学能。
借助直流电引起氧化还原反应的装置。
直流电源 两个电极 电解质(熔融或溶液)
形成 闭合回路
氧化反应
还原反应
4、电极及电极反应式:
阳极:发生 的电极, 电子,与电源 相连。
失去
阴极:发生 的电极, 电子,与电源 相连。
氧化反应
还原反应
正极
负极
得到
复习回顾
5、电子的移动方向:
6、离子的移动方向:
电子从电源负极流向电解池阴极;再从电解池阳极
流回电源正极。(外电路)
阳离子向阴极移动,阴离子向阳极移动。(内电路)
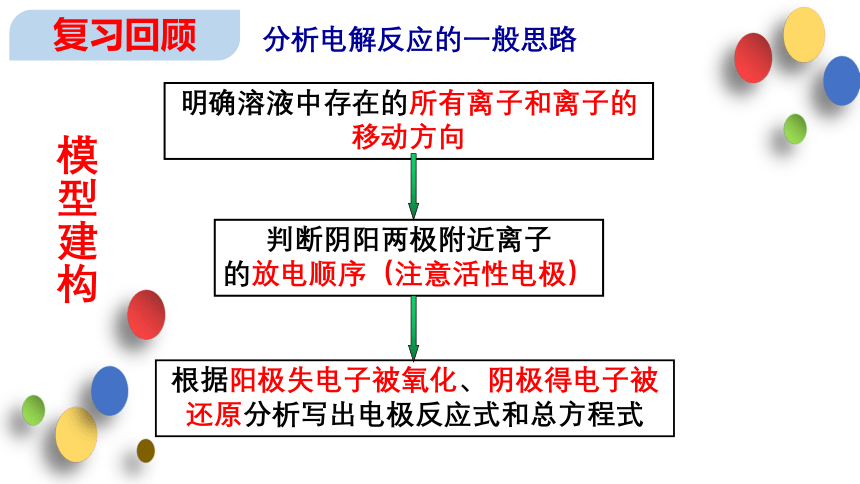
分析电解反应的一般思路
明确溶液中存在的所有离子和离子的移动方向
根据阳极失电子被氧化、阴极得电子被还原分析写出电极反应式和总方程式
判断阴阳两极附近离子
的放电顺序(注意活性电极)
模型建构
复习回顾
复习回顾
离子的放电顺序
阳极:
(1)活性电极(金属活动性顺序表中排在Ag之前):电极金属失电
子,生成对应的金属阳离子,溶液中阴离子不再放电。
(2)惰性电极:
当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
(还原性由强到弱的顺序)
S2-> I- >Fe2+ > Br-> Cl-> OH- > 含氧酸根离子( NO3 -、SO4 2- )
阴极:
常见阳离子的放电顺序(阳离子的氧化性顺序)
K+ <Ca2+ < Na+ < Mg2+ < Al3+ < Zn2+ < Fe2+ <
Sn2+<Pb2+ < H+ < Cu2+ < Fe3+ < Hg2+< Ag+
滤纸有较好的吸湿性,可以把它看作是能盛装水溶液的容器(用电解液浸透滤纸即可)
1、黑笔写出双色字
实验用品:饱和KI溶液、酚酞试液、铅笔电极 、滤纸
学生电源、导线、培养皿
一、滤纸上的电解
实验过程:滤纸用饱和KI溶液和酚酞试液浸湿,连接电源
用两支铅笔电极写字。
要求:小组合作完成实验,记录实验现象,
分析产生现象的原因。
【现象及原理解释】--KI溶液
阴极:写出了红色的字
2H++2e-= H2 (2H2O+2e-=H2+2OH-)
生成的OH-使酚酞变红
阳极:写出了棕黄色的字
2I--2e-= I2(棕黄色)
总反应:2I-+2H2O = H2+2OH-+I2
通电
2、电笔密信
实验用品:FeSO4溶液、KSCN溶液、铅笔电极 、滤纸
学生电源、导线、培养皿
实验过程及要求:
①滤纸用FeSO4溶液浸湿,连接电源,用连接正极铅笔写字,观察并记录实验现象。
②在字上滴入KSCN溶液后又会出现什么现象?
【现象解释】
阳极:Fe2+-e-= Fe3+ Fe3+ + 3SCN- Fe(SCN)3
二、PH试纸上的电解
实验用品:Na2SO4溶液、铁氰化钾溶液、铁丝 、PH试纸、
铅笔电极、学生电源、导线、培养皿
实验过程及要求:
①PH试纸用Na2SO4溶液浸湿,连接电源,用两支铅笔电极形
成闭合回路,观察并记录实验现象。
②若把阳极材料改为铁丝,又有什么不同的现象?为什么?
如何验证产物?
1、惰性电极(两支铅笔电极)
【现象及原理解释】— Na2SO4溶液
阴极:PH试纸变蓝
2H++2e-= H2 (2H2O+2e-=H2+2OH-)
生成的OH-使PH试纸变蓝
阳极:PH试纸变红
4OH--4e-= 2H2O+O2 (2H2O-4e-=4H++O2)
生成的H+使PH试纸变红
2、活性电极(铁丝作阳极)
阳极:开始无明显现象,加入铁氰化钾溶液后变蓝。
Fe -2e-= Fe2+
阴极:和上面现象相同
三、电沉积——银树的生成
实验用品:AgNO3溶液、铅笔电极、学生电源、导线、培养皿
实验过程:先向培养皿中加入适量的AgNO3溶液,
把两支铅笔电极插入溶液中,连接电源。
要求:记录实验现象,写出电极反应式。
阴极:生成了银树。 Ag++e-= Ag
阳极:4OH--4e-= 2H2O+O2 (2H2O-4e-=4H++O2)
【现象解释】
美丽化学之电解
谢谢大家!
趣味电解
——电解的基本原理
课标要求与核心素养
1、从宏观和微观的角度理解电解池中电子和阴阳离子的移动、阴阳两极
上的反应及其变化,培养宏观辨识与微观探析的核心素养。
2、建立对电解过程系统分析认识的思维模型,理解电解的规律,会判断
电解的产物,会书写电极反应式和总反应式,培养证据推理与模型认
知的核心素养。
3、通过实验探究激发学生的学习热情和求知欲,培养科学探究与创新精
神的核心素养。
2、电解池的定义:
3、电解池的构成:
1、电解的定义
在直流电作用下,电解质在两个电极上分别发生 和 的过程,实现电能转变为化学能。
借助直流电引起氧化还原反应的装置。
直流电源 两个电极 电解质(熔融或溶液)
形成 闭合回路
氧化反应
还原反应
4、电极及电极反应式:
阳极:发生 的电极, 电子,与电源 相连。
失去
阴极:发生 的电极, 电子,与电源 相连。
氧化反应
还原反应
正极
负极
得到
复习回顾
5、电子的移动方向:
6、离子的移动方向:
电子从电源负极流向电解池阴极;再从电解池阳极
流回电源正极。(外电路)
阳离子向阴极移动,阴离子向阳极移动。(内电路)
分析电解反应的一般思路
明确溶液中存在的所有离子和离子的移动方向
根据阳极失电子被氧化、阴极得电子被还原分析写出电极反应式和总方程式
判断阴阳两极附近离子
的放电顺序(注意活性电极)
模型建构
复习回顾
复习回顾
离子的放电顺序
阳极:
(1)活性电极(金属活动性顺序表中排在Ag之前):电极金属失电
子,生成对应的金属阳离子,溶液中阴离子不再放电。
(2)惰性电极:
当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
(还原性由强到弱的顺序)
S2-> I- >Fe2+ > Br-> Cl-> OH- > 含氧酸根离子( NO3 -、SO4 2- )
阴极:
常见阳离子的放电顺序(阳离子的氧化性顺序)
K+ <Ca2+ < Na+ < Mg2+ < Al3+ < Zn2+ < Fe2+ <
Sn2+<Pb2+ < H+ < Cu2+ < Fe3+ < Hg2+< Ag+
滤纸有较好的吸湿性,可以把它看作是能盛装水溶液的容器(用电解液浸透滤纸即可)
1、黑笔写出双色字
实验用品:饱和KI溶液、酚酞试液、铅笔电极 、滤纸
学生电源、导线、培养皿
一、滤纸上的电解
实验过程:滤纸用饱和KI溶液和酚酞试液浸湿,连接电源
用两支铅笔电极写字。
要求:小组合作完成实验,记录实验现象,
分析产生现象的原因。
【现象及原理解释】--KI溶液
阴极:写出了红色的字
2H++2e-= H2 (2H2O+2e-=H2+2OH-)
生成的OH-使酚酞变红
阳极:写出了棕黄色的字
2I--2e-= I2(棕黄色)
总反应:2I-+2H2O = H2+2OH-+I2
通电
2、电笔密信
实验用品:FeSO4溶液、KSCN溶液、铅笔电极 、滤纸
学生电源、导线、培养皿
实验过程及要求:
①滤纸用FeSO4溶液浸湿,连接电源,用连接正极铅笔写字,观察并记录实验现象。
②在字上滴入KSCN溶液后又会出现什么现象?
【现象解释】
阳极:Fe2+-e-= Fe3+ Fe3+ + 3SCN- Fe(SCN)3
二、PH试纸上的电解
实验用品:Na2SO4溶液、铁氰化钾溶液、铁丝 、PH试纸、
铅笔电极、学生电源、导线、培养皿
实验过程及要求:
①PH试纸用Na2SO4溶液浸湿,连接电源,用两支铅笔电极形
成闭合回路,观察并记录实验现象。
②若把阳极材料改为铁丝,又有什么不同的现象?为什么?
如何验证产物?
1、惰性电极(两支铅笔电极)
【现象及原理解释】— Na2SO4溶液
阴极:PH试纸变蓝
2H++2e-= H2 (2H2O+2e-=H2+2OH-)
生成的OH-使PH试纸变蓝
阳极:PH试纸变红
4OH--4e-= 2H2O+O2 (2H2O-4e-=4H++O2)
生成的H+使PH试纸变红
2、活性电极(铁丝作阳极)
阳极:开始无明显现象,加入铁氰化钾溶液后变蓝。
Fe -2e-= Fe2+
阴极:和上面现象相同
三、电沉积——银树的生成
实验用品:AgNO3溶液、铅笔电极、学生电源、导线、培养皿
实验过程:先向培养皿中加入适量的AgNO3溶液,
把两支铅笔电极插入溶液中,连接电源。
要求:记录实验现象,写出电极反应式。
阴极:生成了银树。 Ag++e-= Ag
阳极:4OH--4e-= 2H2O+O2 (2H2O-4e-=4H++O2)
【现象解释】
美丽化学之电解
谢谢大家!
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
