2022-2023学年人教版九年级化学下册 第八单元复习《金属和金属材料》导学案 (WORD版,含答案 )
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 第八单元复习《金属和金属材料》导学案 (WORD版,含答案 ) |

|
|
| 格式 | zip | ||
| 文件大小 | 229.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 00:00:00 | ||
图片预览

文档简介
第八单元复习
【课时目标】
1.了解金属的物理特征,知道生铁和钢等重要的合金,认识金属材料在生产、生活和社会发展中的重要作用;
2.认识常见金属的主要化学性质;能用金属活动性顺序对有关置换反应进行判断,并能解释日常生活中的一些化学现象;掌握金属活动性顺序的探究;
3.知道一些常见金属(铁、铝等)矿物,知道可用铁矿石炼铁;了解防止金属锈蚀的简单方法,认识废弃金属对环境的影响和回收金属的重要性;
重点:1.铁、铝、铜等金属和合金的重要性质和用途;2.金属活动性顺序;3.铁锈蚀的条件及其防护。
难点:1.对金属活动性顺序的初步探究;2.对铁锈蚀条件及其防护措施的初步探究;3.有关化学方程式计算中的杂质问题计算。
【学习活动】
任务一 金属材料的物理性质和用途
1.垃圾分类回收有利于保护环境、节约资源。下列可回收垃圾中属于金属材料的是( )
A.玻璃瓶 B.塑料袋 C.易拉罐 D.废报纸
2.下列关于合金的说法正确的是( )
A.合金属于金属单质
B.多数合金的熔点高于组成它的成分金属
C.合金不属于金属材料
D.合金的硬度一般比各成分金属大
3.从化学的角度对下列成语进行解释,其中错误的是( )
A.点石成金——化学反应改变了元素种类
B.铜墙铁壁——铜、铁硬度较大,比较坚固
C.釜底抽薪——燃烧的条件之一是需要可燃物
D.烈火真金——金在高温下难与其他物质反应
【变式1】《梦溪笔谈》对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”。关于剂钢和柔铁的说法正确的是( )
A.剂钢是纯铁,柔铁是合金
B.合金中至少有两种金属
C.剂钢的强度和硬度比纯铁低
D.改变合金中元素比例,可以得到不同性能的合金
任务二 金属的化学性质和金属活动性顺序
4.下列描述中,属于金属化学性质的是( )
A.铜是紫红色固体
B.汞在常温下呈液态
C.铁在潮湿的空气中容易生锈
D.钠的质地较软
5.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是( )
A.MgCl2溶液、Cu、Sn B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸 D.MgCl2溶液、Sn、CuCl2溶液
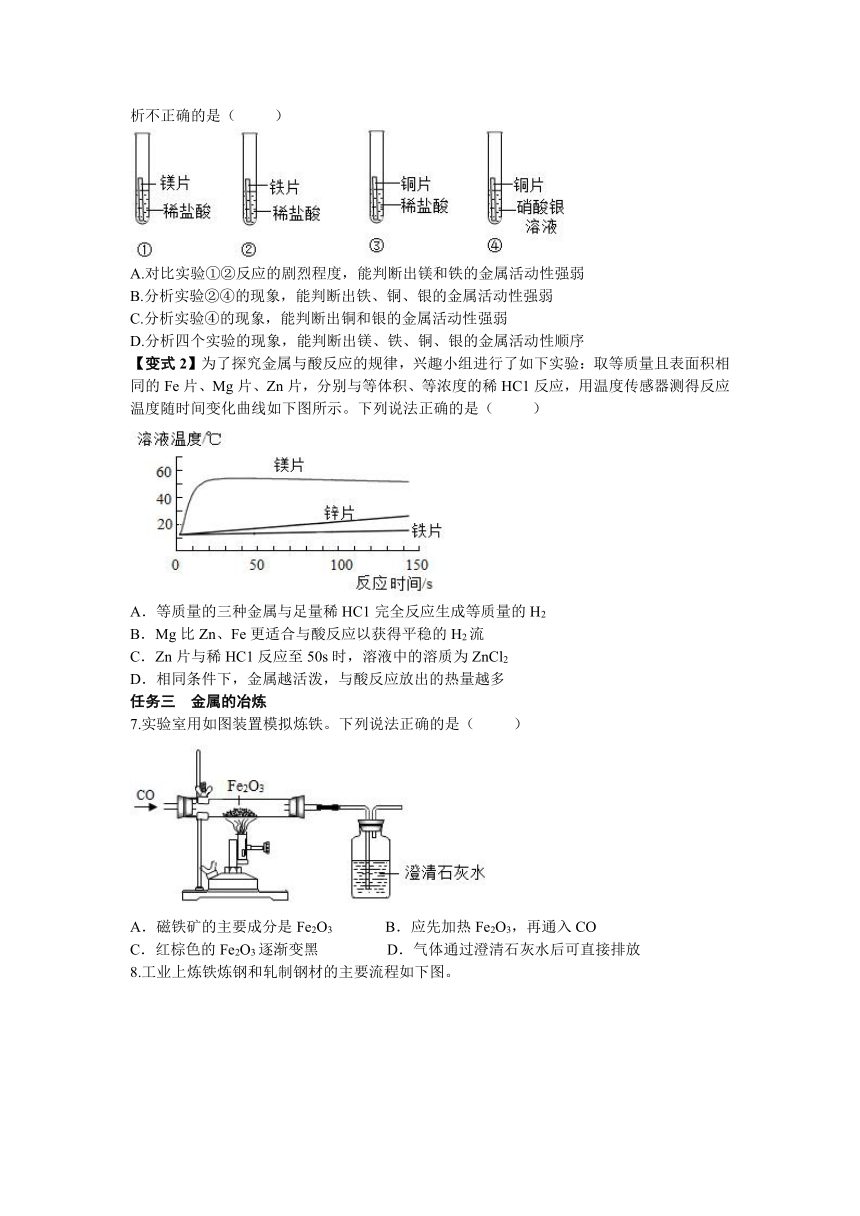
6.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
【变式2】为了探究金属与酸反应的规律,兴趣小组进行了如下实验:取等质量且表面积相同的Fe片、Mg片、Zn片,分别与等体积、等浓度的稀HC1反应,用温度传感器测得反应温度随时间变化曲线如下图所示。下列说法正确的是( )
A.等质量的三种金属与足量稀HC1完全反应生成等质量的H2
B.Mg比Zn、Fe更适合与酸反应以获得平稳的H2流
C.Zn片与稀HC1反应至50s时,溶液中的溶质为ZnCl2
D.相同条件下,金属越活泼,与酸反应放出的热量越多
任务三 金属的冶炼
7.实验室用如图装置模拟炼铁。下列说法正确的是( )
A.磁铁矿的主要成分是Fe2O3 B.应先加热Fe2O3,再通入CO
C.红棕色的Fe2O3逐渐变黑 D.气体通过澄清石灰水后可直接排放
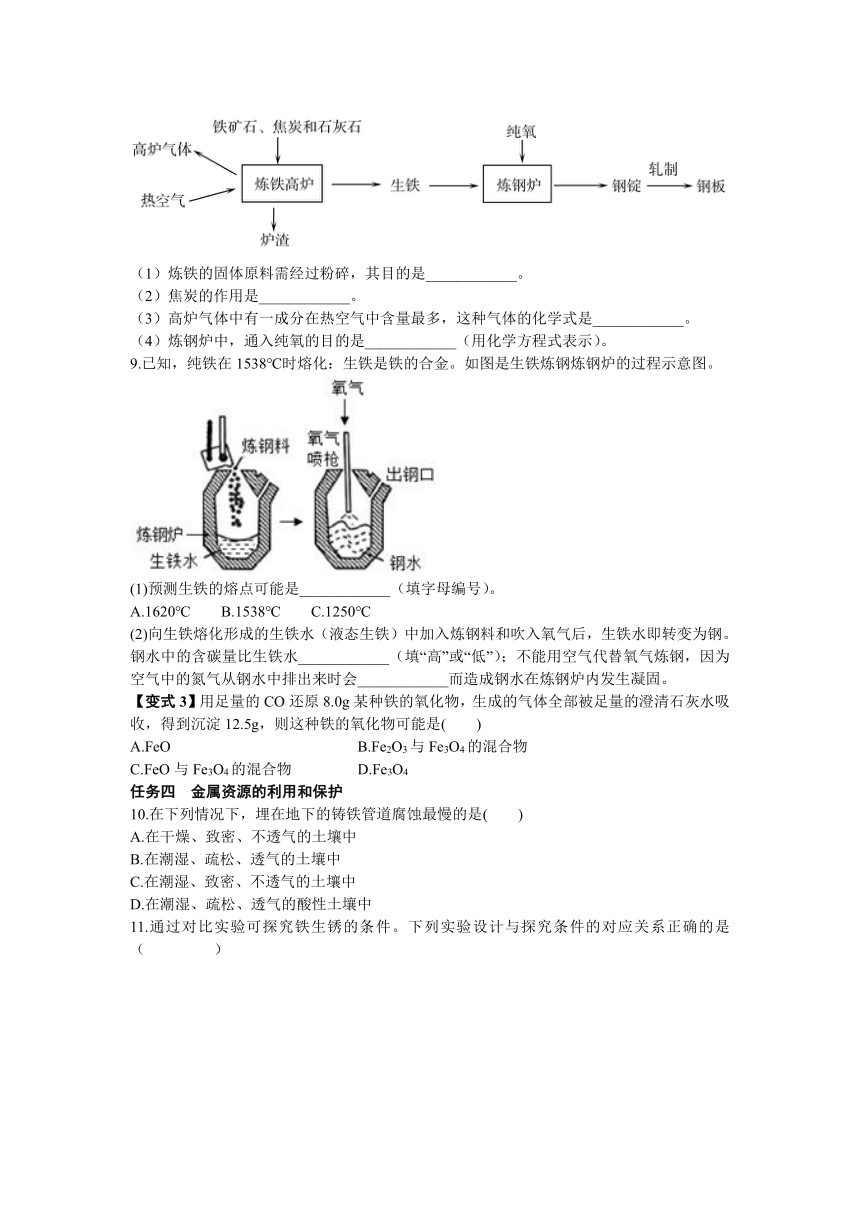
8.工业上炼铁炼钢和轧制钢材的主要流程如下图。
(1)炼铁的固体原料需经过粉碎,其目的是____________。
(2)焦炭的作用是____________。
(3)高炉气体中有一成分在热空气中含量最多,这种气体的化学式是____________。
(4)炼钢炉中,通入纯氧的目的是____________(用化学方程式表示)。
9.已知,纯铁在1538℃时熔化:生铁是铁的合金。如图是生铁炼钢炼钢炉的过程示意图。
(1)预测生铁的熔点可能是____________(填字母编号)。
A.1620℃ B.1538℃ C.1250℃
(2)向生铁熔化形成的生铁水(液态生铁)中加入炼钢料和吹入氧气后,生铁水即转变为钢。钢水中的含碳量比生铁水____________(填“高”或“低”);不能用空气代替氧气炼钢,因为空气中的氮气从钢水中排出来时会____________而造成钢水在炼钢炉内发生凝固。
【变式3】用足量的CO还原8.0g某种铁的氧化物,生成的气体全部被足量的澄清石灰水吸收,得到沉淀12.5g,则这种铁的氧化物可能是( )
A.FeO B.Fe2O3与Fe3O4的混合物
C.FeO与Fe3O4的混合物 D.Fe3O4
任务四 金属资源的利用和保护
10.在下列情况下,埋在地下的铸铁管道腐蚀最慢的是( )
A.在干燥、致密、不透气的土壤中
B.在潮湿、疏松、透气的土壤中
C.在潮湿、致密、不透气的土壤中
D.在潮湿、疏松、透气的酸性土壤中
11.通过对比实验可探究铁生锈的条件。下列实验设计与探究条件的对应关系正确的是( )
A.甲和乙:水 B.乙和丙:空气 C.甲和丙:空气 D.甲和丁:水
12.下列防锈措施不合理的是( )
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
【变式4】小东通过查阅资料,根据铁在空气中生锈的原理,设计了如图所示的实验装置,来测定空气中氧气含量(装置中的饱和食盐水、活性炭会加速铁生锈)。已知广口瓶的有效容积为242mL,实验8分钟后打开止水夹,水从烧杯流入广口瓶中的体积为48mL。下列说法错误的是( )
A.该实验的不足之处在于实验前广口瓶底未放少量水
B.通过分析本次实验数据,可知空气中氧气的体积分数约为19.8%
C.若实验药品充足,时间足够长,可十分接近拉瓦锡实验的结果
D.此实验可有效解决拉瓦锡实验中的汞污染问题
【课后作业】
1.东汉时期的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品。其制作材料属于( )
A.合成材料 B.天然材料 C.金属材料 D.复合材料
2.金属是一类重要的材料。下列有关金属的说法正确的是( )
A.不锈钢是绝对不会生锈的铁合金
B.武德合金的熔点比其成分金属高
C.日常生活中,钢铁表面刷油漆可以防止生锈
D.“曾青得铁则化为铜”的原理是用铜置换出铁
3.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是( )
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
4.如图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
5.研究金属的冶炼和腐蚀对于合理生产和使用金属有着重要意义。下列说法不正确的是( )
A.炼铁是将铁的化合物转化为铁单质的过程
B.炼铁时,固体原料从高炉上方加入,空气从下方通入
C.铁被腐蚀时发生了铁单质转化为铁的化合物的反应
D.洗净铁制品表面的油膜能有效防止其腐蚀
6.金属材料对于促进生产发展、改善人类生活发挥了重大作用。
(1)铝具有很好的抗腐蚀性能,原因是___________。
(2)一氧化碳的还原性可用于冶金工业,写出一氧化碳和氧化铜反应的化学方程式___________。
(3)铝在高温条件下能与氧化铁发生置换反应,该反应的化学方程式为___________。
(4)下列保护金属资源的做法不正确的是___________(填字母)。
A.任意开采矿物
B.回收利用废旧金属
C.铁制品存放在潮湿的环境中
D.用塑料代替金属材料制造管道
7.金属具有广泛的应用。
(1)铁锅用来炒菜,主要是利用铁的___________(填“导热”或“导电”)性。
(2)某炼铁厂要冶炼1 000t含杂质3%的生铁,需要含Fe2O3 80%的赤铁矿石的质量约是 ___________t(计算结果精确到0.1)。
(3)某金属粉末可能由镁、锌、铁、铝、银中的一种或几种组成。取该样品2.4g,向其中加入100g一定溶质质量分数的稀硫酸,恰好完全反应,生成0.2g氢气,得到无色溶液,固体无剩余。下列说法正确的是___________(填序号)。
A.样品中一定含有镁
B.样品中一定不含有银,可能含有铁
C.所得溶液中溶质总质量为12g
D.加入的稀硫酸的溶质质量分数为19.6%
8.甲、乙两位同学发现铜质眼镜架上出现一些绿色的锈渍。经査阅资料得知,铜锈的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。他们依照钢铁生锈的研究方法设计如下实验(如图1所示):①将光亮铜片部分浸入蒸馏水中;②将光亮铜片完全浸入煮沸过的蒸馏水中;③将光亮铜片放在干燥的空气中。请回答:
(1)推测一段时间后会出现铜锈的是___________(填序号)试管内铜片。
(2)经过讨论同学们发现上述实验不够科学,于是又设计了图2实验,请在横线上分别写出B、C、D三支试管中应加入的物质的化学式___________。
(3)除去铜锈可以使用稀盐酸,因为从组成上来看碱式碳酸铜有碱和碳酸盐的化学性质,反应的化学方程式为___________。
9.某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸用下面装置完成表中实验,回答下列问题。
实验序号 ① ② ③ ④
实验温度/℃ 25 25 70 70
试剂 稀氨水 稀醋酸 稀氨水 稀醋酸
出现铁锈所需时间 1天未见锈蚀 5分钟 1天未见锈蚀 1分钟
(1)铁锈的主要成分是___________(填化学式)。
(2)实验②和④可探究___________因素对铁制品锈蚀快慢的影响,试探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是___________ (填实验序号)。
(3)根据表中实验现象得出的结论是___________(写出1点即可)。
(4)影响铁制品锈蚀快慢除上述因素外,还有___________(写出1点即可),请设计实验方案___________。
10.化学兴趣小组为测定某铜锌合金中成分金属的含量,称取10g样品放入烧杯中,向其中加入100g稀硫酸,恰好完全反应后。测得烧杯内所有物质的总质量为109.8g。请完成下列分析及计算:
(1)反应中共生成气体___________g。
(2)计算合金中铜的质量分数。
【评价与反思】___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
参考答案
【学习活动】1.C 2.D 3.A 【变式1】D 4.C 5.A 6.B 【变式2】D 7.C 8.(1)增大反应物接触面积,使反应更快更充分 (2)提供炼铁所需的热量和还原剂CO (3)N2 (4)C+O2CO2 9.(1)C (2)低 吸收热量 【变式3】C 10.A 11.D 12.B 【变式4】A
【课后作业】1.C 2.C 3.C 4.C 5.D 6.(1)常温下铝与空气中的氧气反应,表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化 (2)CuO+COCu+CO2 (3)2Al+Fe2O32Fe+Al2O3 (4)AC 7.(1)导热 (2)1 732.1 (3)C 8.(1)① (2)O2、CO2;O2、H2O;H2O、CO2 (3)Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O 9.(1)Fe2O3 xH2O (2)温度 ①和②(或③和④) (3)在相同温度下,酸性环境铁生锈更快(其他合理答案均可) (4)试剂浓度(其他合理答案均可) 同温下,将相同的铁钉放入等体积不同浓度的醋酸中,观察铁锈出现的时间(其他合理答案均可) 10.(1)0.2 (2)35%
【课时目标】
1.了解金属的物理特征,知道生铁和钢等重要的合金,认识金属材料在生产、生活和社会发展中的重要作用;
2.认识常见金属的主要化学性质;能用金属活动性顺序对有关置换反应进行判断,并能解释日常生活中的一些化学现象;掌握金属活动性顺序的探究;
3.知道一些常见金属(铁、铝等)矿物,知道可用铁矿石炼铁;了解防止金属锈蚀的简单方法,认识废弃金属对环境的影响和回收金属的重要性;
重点:1.铁、铝、铜等金属和合金的重要性质和用途;2.金属活动性顺序;3.铁锈蚀的条件及其防护。
难点:1.对金属活动性顺序的初步探究;2.对铁锈蚀条件及其防护措施的初步探究;3.有关化学方程式计算中的杂质问题计算。
【学习活动】
任务一 金属材料的物理性质和用途
1.垃圾分类回收有利于保护环境、节约资源。下列可回收垃圾中属于金属材料的是( )
A.玻璃瓶 B.塑料袋 C.易拉罐 D.废报纸
2.下列关于合金的说法正确的是( )
A.合金属于金属单质
B.多数合金的熔点高于组成它的成分金属
C.合金不属于金属材料
D.合金的硬度一般比各成分金属大
3.从化学的角度对下列成语进行解释,其中错误的是( )
A.点石成金——化学反应改变了元素种类
B.铜墙铁壁——铜、铁硬度较大,比较坚固
C.釜底抽薪——燃烧的条件之一是需要可燃物
D.烈火真金——金在高温下难与其他物质反应
【变式1】《梦溪笔谈》对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”。关于剂钢和柔铁的说法正确的是( )
A.剂钢是纯铁,柔铁是合金
B.合金中至少有两种金属
C.剂钢的强度和硬度比纯铁低
D.改变合金中元素比例,可以得到不同性能的合金
任务二 金属的化学性质和金属活动性顺序
4.下列描述中,属于金属化学性质的是( )
A.铜是紫红色固体
B.汞在常温下呈液态
C.铁在潮湿的空气中容易生锈
D.钠的质地较软
5.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是( )
A.MgCl2溶液、Cu、Sn B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸 D.MgCl2溶液、Sn、CuCl2溶液
6.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
【变式2】为了探究金属与酸反应的规律,兴趣小组进行了如下实验:取等质量且表面积相同的Fe片、Mg片、Zn片,分别与等体积、等浓度的稀HC1反应,用温度传感器测得反应温度随时间变化曲线如下图所示。下列说法正确的是( )
A.等质量的三种金属与足量稀HC1完全反应生成等质量的H2
B.Mg比Zn、Fe更适合与酸反应以获得平稳的H2流
C.Zn片与稀HC1反应至50s时,溶液中的溶质为ZnCl2
D.相同条件下,金属越活泼,与酸反应放出的热量越多
任务三 金属的冶炼
7.实验室用如图装置模拟炼铁。下列说法正确的是( )
A.磁铁矿的主要成分是Fe2O3 B.应先加热Fe2O3,再通入CO
C.红棕色的Fe2O3逐渐变黑 D.气体通过澄清石灰水后可直接排放
8.工业上炼铁炼钢和轧制钢材的主要流程如下图。
(1)炼铁的固体原料需经过粉碎,其目的是____________。
(2)焦炭的作用是____________。
(3)高炉气体中有一成分在热空气中含量最多,这种气体的化学式是____________。
(4)炼钢炉中,通入纯氧的目的是____________(用化学方程式表示)。
9.已知,纯铁在1538℃时熔化:生铁是铁的合金。如图是生铁炼钢炼钢炉的过程示意图。
(1)预测生铁的熔点可能是____________(填字母编号)。
A.1620℃ B.1538℃ C.1250℃
(2)向生铁熔化形成的生铁水(液态生铁)中加入炼钢料和吹入氧气后,生铁水即转变为钢。钢水中的含碳量比生铁水____________(填“高”或“低”);不能用空气代替氧气炼钢,因为空气中的氮气从钢水中排出来时会____________而造成钢水在炼钢炉内发生凝固。
【变式3】用足量的CO还原8.0g某种铁的氧化物,生成的气体全部被足量的澄清石灰水吸收,得到沉淀12.5g,则这种铁的氧化物可能是( )
A.FeO B.Fe2O3与Fe3O4的混合物
C.FeO与Fe3O4的混合物 D.Fe3O4
任务四 金属资源的利用和保护
10.在下列情况下,埋在地下的铸铁管道腐蚀最慢的是( )
A.在干燥、致密、不透气的土壤中
B.在潮湿、疏松、透气的土壤中
C.在潮湿、致密、不透气的土壤中
D.在潮湿、疏松、透气的酸性土壤中
11.通过对比实验可探究铁生锈的条件。下列实验设计与探究条件的对应关系正确的是( )
A.甲和乙:水 B.乙和丙:空气 C.甲和丙:空气 D.甲和丁:水
12.下列防锈措施不合理的是( )
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
【变式4】小东通过查阅资料,根据铁在空气中生锈的原理,设计了如图所示的实验装置,来测定空气中氧气含量(装置中的饱和食盐水、活性炭会加速铁生锈)。已知广口瓶的有效容积为242mL,实验8分钟后打开止水夹,水从烧杯流入广口瓶中的体积为48mL。下列说法错误的是( )
A.该实验的不足之处在于实验前广口瓶底未放少量水
B.通过分析本次实验数据,可知空气中氧气的体积分数约为19.8%
C.若实验药品充足,时间足够长,可十分接近拉瓦锡实验的结果
D.此实验可有效解决拉瓦锡实验中的汞污染问题
【课后作业】
1.东汉时期的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品。其制作材料属于( )
A.合成材料 B.天然材料 C.金属材料 D.复合材料
2.金属是一类重要的材料。下列有关金属的说法正确的是( )
A.不锈钢是绝对不会生锈的铁合金
B.武德合金的熔点比其成分金属高
C.日常生活中,钢铁表面刷油漆可以防止生锈
D.“曾青得铁则化为铜”的原理是用铜置换出铁
3.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是( )
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
4.如图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
5.研究金属的冶炼和腐蚀对于合理生产和使用金属有着重要意义。下列说法不正确的是( )
A.炼铁是将铁的化合物转化为铁单质的过程
B.炼铁时,固体原料从高炉上方加入,空气从下方通入
C.铁被腐蚀时发生了铁单质转化为铁的化合物的反应
D.洗净铁制品表面的油膜能有效防止其腐蚀
6.金属材料对于促进生产发展、改善人类生活发挥了重大作用。
(1)铝具有很好的抗腐蚀性能,原因是___________。
(2)一氧化碳的还原性可用于冶金工业,写出一氧化碳和氧化铜反应的化学方程式___________。
(3)铝在高温条件下能与氧化铁发生置换反应,该反应的化学方程式为___________。
(4)下列保护金属资源的做法不正确的是___________(填字母)。
A.任意开采矿物
B.回收利用废旧金属
C.铁制品存放在潮湿的环境中
D.用塑料代替金属材料制造管道
7.金属具有广泛的应用。
(1)铁锅用来炒菜,主要是利用铁的___________(填“导热”或“导电”)性。
(2)某炼铁厂要冶炼1 000t含杂质3%的生铁,需要含Fe2O3 80%的赤铁矿石的质量约是 ___________t(计算结果精确到0.1)。
(3)某金属粉末可能由镁、锌、铁、铝、银中的一种或几种组成。取该样品2.4g,向其中加入100g一定溶质质量分数的稀硫酸,恰好完全反应,生成0.2g氢气,得到无色溶液,固体无剩余。下列说法正确的是___________(填序号)。
A.样品中一定含有镁
B.样品中一定不含有银,可能含有铁
C.所得溶液中溶质总质量为12g
D.加入的稀硫酸的溶质质量分数为19.6%
8.甲、乙两位同学发现铜质眼镜架上出现一些绿色的锈渍。经査阅资料得知,铜锈的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。他们依照钢铁生锈的研究方法设计如下实验(如图1所示):①将光亮铜片部分浸入蒸馏水中;②将光亮铜片完全浸入煮沸过的蒸馏水中;③将光亮铜片放在干燥的空气中。请回答:
(1)推测一段时间后会出现铜锈的是___________(填序号)试管内铜片。
(2)经过讨论同学们发现上述实验不够科学,于是又设计了图2实验,请在横线上分别写出B、C、D三支试管中应加入的物质的化学式___________。
(3)除去铜锈可以使用稀盐酸,因为从组成上来看碱式碳酸铜有碱和碳酸盐的化学性质,反应的化学方程式为___________。
9.某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸用下面装置完成表中实验,回答下列问题。
实验序号 ① ② ③ ④
实验温度/℃ 25 25 70 70
试剂 稀氨水 稀醋酸 稀氨水 稀醋酸
出现铁锈所需时间 1天未见锈蚀 5分钟 1天未见锈蚀 1分钟
(1)铁锈的主要成分是___________(填化学式)。
(2)实验②和④可探究___________因素对铁制品锈蚀快慢的影响,试探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是___________ (填实验序号)。
(3)根据表中实验现象得出的结论是___________(写出1点即可)。
(4)影响铁制品锈蚀快慢除上述因素外,还有___________(写出1点即可),请设计实验方案___________。
10.化学兴趣小组为测定某铜锌合金中成分金属的含量,称取10g样品放入烧杯中,向其中加入100g稀硫酸,恰好完全反应后。测得烧杯内所有物质的总质量为109.8g。请完成下列分析及计算:
(1)反应中共生成气体___________g。
(2)计算合金中铜的质量分数。
【评价与反思】___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
参考答案
【学习活动】1.C 2.D 3.A 【变式1】D 4.C 5.A 6.B 【变式2】D 7.C 8.(1)增大反应物接触面积,使反应更快更充分 (2)提供炼铁所需的热量和还原剂CO (3)N2 (4)C+O2CO2 9.(1)C (2)低 吸收热量 【变式3】C 10.A 11.D 12.B 【变式4】A
【课后作业】1.C 2.C 3.C 4.C 5.D 6.(1)常温下铝与空气中的氧气反应,表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化 (2)CuO+COCu+CO2 (3)2Al+Fe2O32Fe+Al2O3 (4)AC 7.(1)导热 (2)1 732.1 (3)C 8.(1)① (2)O2、CO2;O2、H2O;H2O、CO2 (3)Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O 9.(1)Fe2O3 xH2O (2)温度 ①和②(或③和④) (3)在相同温度下,酸性环境铁生锈更快(其他合理答案均可) (4)试剂浓度(其他合理答案均可) 同温下,将相同的铁钉放入等体积不同浓度的醋酸中,观察铁锈出现的时间(其他合理答案均可) 10.(1)0.2 (2)35%
同课章节目录
