化学(科粤版)九下参考课件:8.2 常见的酸和碱(第1课时)(共22张PPT)
文档属性
| 名称 | 化学(科粤版)九下参考课件:8.2 常见的酸和碱(第1课时)(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
第八章 常见的酸、碱、盐
8.2常见的酸和碱(第一课时)
1.了解常见酸的物理性质。
2.认识常见酸的化学性质,能说出相关反应的实验现象,并熟练写出化学方程式。
3.初步学会稀释浓硫酸的方法。
教学目标
目 录/
1.
浓酸的物理性质和特性
2.
稀酸的化学性质
PART 01
浓酸的物理性质和特性
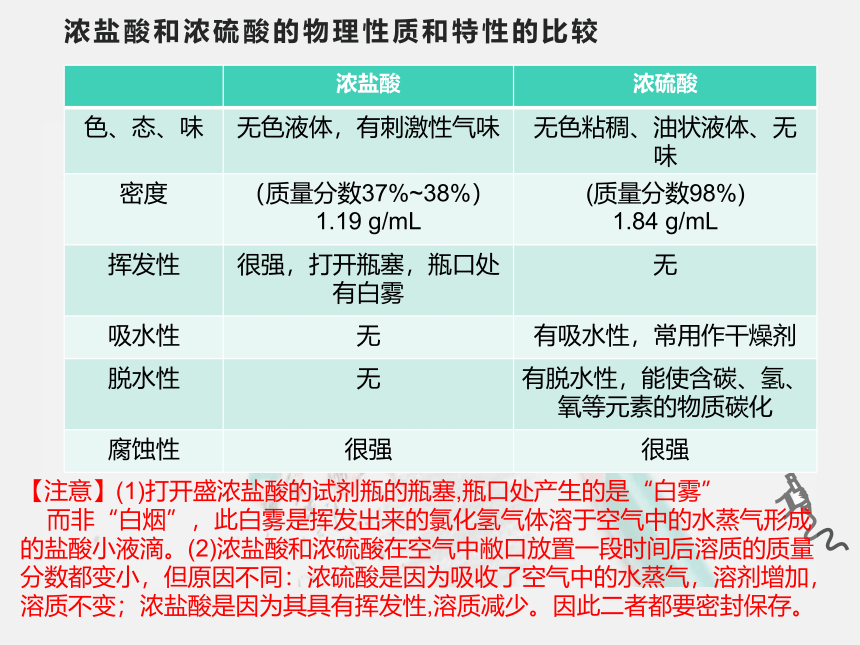
浓盐酸和浓硫酸的物理性质和特性的比较
浓盐酸 浓硫酸
色、态、味 无色液体,有刺激性气味 无色粘稠、油状液体、无味
密度 (质量分数37%~38%) 1.19 g/mL (质量分数98%)
1.84 g/mL
挥发性 很强,打开瓶塞,瓶口处有白雾 无
吸水性 无 有吸水性,常用作干燥剂
脱水性 无 有脱水性,能使含碳、氢、氧等元素的物质碳化
腐蚀性 很强 很强
【注意】(1)打开盛浓盐酸的试剂瓶的瓶塞,瓶口处产生的是“白雾”
而非“白烟”,此白雾是挥发出来的氯化氢气体溶于空气中的水蒸气形成的盐酸小液滴。(2)浓盐酸和浓硫酸在空气中敝口放置一段时间后溶质的质量分数都变小,但原因不同:浓硫酸是因为吸收了空气中的水蒸气,溶剂增加,溶质不变;浓盐酸是因为其具有挥发性,溶质减少。因此二者都要密封保存。
白纸上有明显的黑色字迹
肉皮有点腐烂
白糖变黑,逐渐变成蓬松的”黑面包“并产生有刺激性气味的气体,”黑面包“的体积逐渐增大,溢出烧杯
浓硫酸具有强腐蚀性和脱水性
【实验结论与解释】
①结论:浓硫酸有强脱水性。
②解释:浓硫酸能夺取纸张、木材、布料、皮肤(主要含碳、氢、氧元素)里的水分(浓硫酸的脱水作用),生成黑色的炭。
浓硫酸的吸水性由于浓硫酸具有强吸水性,故在实验室常用作干燥剂。
①可以干燥的气体有:
酸性气体:氯化氢、二氧化碳、二氧化硫等。
中性气体:一氧化碳、氢气、氧气、氯气和所有的稀有气体。
②不能干燥的气体有:碱性气体,如NH3。
③装置:如右图所示。
④操作:用浓硫酸来干燥气体时,气体应从长导管(a端)进人,从短导管(b端)排出,可总结为“长管进,短管出”。
⑤浓硫酸的吸水性是浓硫酸的物理性质。
浓硫酸的吸水性
吸水性和脱水性的比较
吸水性 脱水性
概念 吸收物质中原本含有的水分 将物质中含有的氢、氧元素按水的组成比(原子个数比为2:1)脱去
变化类型 物理变化 化学变化
性质类型 物理性质 化学性质
浓硫酸的稀释
①操作要点:水中倒硫酸,动作要缓慢,沿壁往下流,玻璃棒来搅拌。②错误操作会造成危险。
如果将水注入浓硫酸中,会造成液滴飞溅,容易造成伤人事故,这是因为水的密度较小(与浓硫酸相比),会浮在浓硫酸上面,浓硫酸溶于水放出大量热,使水立即沸腾,使硫酸液滴向四周飞溅。
酸的用途
酸 用途
盐酸 用于电镀、食品、化工生产、金属表面除锈、制造药物等;人体胃液中含有盐酸,可帮助消化
硫酸 用于生产车用电池、化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等;实验室还常用作干燥剂
硝酸 生产化肥、染料、炸药
PART 02
稀酸的化学性质
如果铁制品生锈了,我们可以用稀盐酸除去铁锈;如果衣服染上了铁锈渍,不用担心,只要将衣服浸在含醋酸百分之二的水溶液里,两三分钟后,用水冲洗即可除去;如果烧水的水壶有了水垢,把食醋倒入水壶中,烧一两个小时,水垢即除。解决这些生活中的小难题的原理是什么呢?
酸能与指示剂反应
【小结】酸能与指示剂反应,使紫色石蕊溶液变为红色,不能使无色酚酞溶液变色。
紫色石蕊溶液 无色酚酞溶液
稀盐酸 由紫色变为红色 不变色
稀硫酸 由紫色变为红色 不变色
酸与较活泼金属反应
【小结】酸和较活泼的金属反应,生成氢气和由金属离子与酸根离子构成的化合物-----盐
实验现象 反应化学方程式
镁和稀盐酸 镁表面迅速产生大量气泡,镁片逐渐溶解 Mg+2HCl=MgCl2+H2↑
铝和稀盐酸 铝片表面迅速产生大量气泡,铝片逐渐溶解 2Al+6HCl=3AlCl3+3H2↑
锌和稀盐酸 锌片表面迅速产生气泡 Zn+2HCl=ZnCl2+H2↑
铁和稀盐酸 铁片表面缓慢产生气泡,溶液逐渐变为浅绿色 Fe+2HCl=FeCl2+H2↑
酸与金属氧化物反应
酸与金属氧化物反应 实验现象 反应方程式
取少量黑色金属氧化铜粉末于试管中,滴入稀盐酸,加热并振荡。 黑色固体逐渐溶解,生成蓝色溶液 CuO+2HCl=CuCl2+H2O
在试管中放入一支生满锈的铁钉,滴入稀硫酸加热并振荡 铁锈逐渐溶解,生成黄色溶液 Fe2O3+6HCl=2FeCl3+3H2O
【小结】酸可以和多数金属氧化物反应生成盐和水
酸与盐反应
【小结】酸和某些盐反应生成新酸和新盐
酸与盐反应 实验现象 反应方程式
稀盐酸滴入石灰石中 石灰石表面产生大量气泡,石灰石逐渐溶解 CaCO3+2HCl=CaCl2+CO2↑+H2O
稀盐酸滴入硝酸银溶液中 溶液中产生白色沉淀 AgNO3+HCl=AgCl↓+HNO3
稀酸的化学性质总结
课堂练习
1.下列说法不正确的是( )
A.浓硫酸溶于水放出大量的热
B.浓盐酸露置于空气中,溶质的质量分数减小
C.浓硫酸置于空气中溶质质量增加
D.打开浓盐酸的试剂瓶,瓶口会产生白雾
【解答】解:A.浓硫酸溶于水放出大量的热,A正确;B.浓盐酸具有挥发性,露置于空气中,会挥发出HCl气体,使溶质质量减小,溶质的质量分数减小,B正确;C.浓硫酸具有吸水性,置于空气中会吸收空气中水分,使溶剂质量增加,溶质质量不变;C不正确;D.浓盐酸具有挥发性,露置于空气中,会挥发出HCl气体,与空气中水蒸气结合成盐酸小液滴,形成白雾,D正确;故选:C。
2.在做氧化铜与稀盐酸反应的实验,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是( )①该实验是将氧化铜逐渐加入到盛有稀盐酸的容器中②a点表示氧化铜与稀盐酸恰好完全反应③a点和b点对应溶液中铜元素的质量相等④a点和b点对应溶液蒸发结晶后得到的固体成分不相同
A.②③ B.①②③
C.③④ D.②③④
【解答】解:①反应前溶液质量是0,该实验是将稀盐酸逐渐加入到盛有氧化铜的容器中,该选项说法不正确;②a点表示氧化铜与稀盐酸恰好完全反应,此时溶液中的溶质是氯化铜,该选项说法正确;③b点对应溶液中的溶质是氯化铜和过量的氯化氢,a点和b点对应溶液中铜元素的质量相等,该选项说法正确;④a点和b点对应溶液蒸发结晶后得到的固体成分相同,都是氯化铜,是因为随着蒸发,b中的氯化氢挥发出去,该选项说法不正确。故选:A。
3.某化学兴趣小组利用如图装置进行实验:打开弹簧夹,将液体a滴入试管①中与固体b接触,若试管②中的导管口没有气泡产生,则液体a和固体b的组合可能是( )
A.水和氢氧化钠 B.稀盐酸和碳酸钙
C.水和硝酸铵 D.过氧化氢溶液和二氧化锰
【解答】解:A.氢氧化钠溶于水放热,导致试管中气体膨胀,试管②中的导管口出现气泡;B.碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳逸出时出现气泡;C.硝酸铵溶于水吸热,导致压强减小,试管②中的导管口没有气泡产生;D.过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出时出现气泡。故选:C。
感谢聆听
第八章 常见的酸、碱、盐
8.2常见的酸和碱(第一课时)
1.了解常见酸的物理性质。
2.认识常见酸的化学性质,能说出相关反应的实验现象,并熟练写出化学方程式。
3.初步学会稀释浓硫酸的方法。
教学目标
目 录/
1.
浓酸的物理性质和特性
2.
稀酸的化学性质
PART 01
浓酸的物理性质和特性
浓盐酸和浓硫酸的物理性质和特性的比较
浓盐酸 浓硫酸
色、态、味 无色液体,有刺激性气味 无色粘稠、油状液体、无味
密度 (质量分数37%~38%) 1.19 g/mL (质量分数98%)
1.84 g/mL
挥发性 很强,打开瓶塞,瓶口处有白雾 无
吸水性 无 有吸水性,常用作干燥剂
脱水性 无 有脱水性,能使含碳、氢、氧等元素的物质碳化
腐蚀性 很强 很强
【注意】(1)打开盛浓盐酸的试剂瓶的瓶塞,瓶口处产生的是“白雾”
而非“白烟”,此白雾是挥发出来的氯化氢气体溶于空气中的水蒸气形成的盐酸小液滴。(2)浓盐酸和浓硫酸在空气中敝口放置一段时间后溶质的质量分数都变小,但原因不同:浓硫酸是因为吸收了空气中的水蒸气,溶剂增加,溶质不变;浓盐酸是因为其具有挥发性,溶质减少。因此二者都要密封保存。
白纸上有明显的黑色字迹
肉皮有点腐烂
白糖变黑,逐渐变成蓬松的”黑面包“并产生有刺激性气味的气体,”黑面包“的体积逐渐增大,溢出烧杯
浓硫酸具有强腐蚀性和脱水性
【实验结论与解释】
①结论:浓硫酸有强脱水性。
②解释:浓硫酸能夺取纸张、木材、布料、皮肤(主要含碳、氢、氧元素)里的水分(浓硫酸的脱水作用),生成黑色的炭。
浓硫酸的吸水性由于浓硫酸具有强吸水性,故在实验室常用作干燥剂。
①可以干燥的气体有:
酸性气体:氯化氢、二氧化碳、二氧化硫等。
中性气体:一氧化碳、氢气、氧气、氯气和所有的稀有气体。
②不能干燥的气体有:碱性气体,如NH3。
③装置:如右图所示。
④操作:用浓硫酸来干燥气体时,气体应从长导管(a端)进人,从短导管(b端)排出,可总结为“长管进,短管出”。
⑤浓硫酸的吸水性是浓硫酸的物理性质。
浓硫酸的吸水性
吸水性和脱水性的比较
吸水性 脱水性
概念 吸收物质中原本含有的水分 将物质中含有的氢、氧元素按水的组成比(原子个数比为2:1)脱去
变化类型 物理变化 化学变化
性质类型 物理性质 化学性质
浓硫酸的稀释
①操作要点:水中倒硫酸,动作要缓慢,沿壁往下流,玻璃棒来搅拌。②错误操作会造成危险。
如果将水注入浓硫酸中,会造成液滴飞溅,容易造成伤人事故,这是因为水的密度较小(与浓硫酸相比),会浮在浓硫酸上面,浓硫酸溶于水放出大量热,使水立即沸腾,使硫酸液滴向四周飞溅。
酸的用途
酸 用途
盐酸 用于电镀、食品、化工生产、金属表面除锈、制造药物等;人体胃液中含有盐酸,可帮助消化
硫酸 用于生产车用电池、化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等;实验室还常用作干燥剂
硝酸 生产化肥、染料、炸药
PART 02
稀酸的化学性质
如果铁制品生锈了,我们可以用稀盐酸除去铁锈;如果衣服染上了铁锈渍,不用担心,只要将衣服浸在含醋酸百分之二的水溶液里,两三分钟后,用水冲洗即可除去;如果烧水的水壶有了水垢,把食醋倒入水壶中,烧一两个小时,水垢即除。解决这些生活中的小难题的原理是什么呢?
酸能与指示剂反应
【小结】酸能与指示剂反应,使紫色石蕊溶液变为红色,不能使无色酚酞溶液变色。
紫色石蕊溶液 无色酚酞溶液
稀盐酸 由紫色变为红色 不变色
稀硫酸 由紫色变为红色 不变色
酸与较活泼金属反应
【小结】酸和较活泼的金属反应,生成氢气和由金属离子与酸根离子构成的化合物-----盐
实验现象 反应化学方程式
镁和稀盐酸 镁表面迅速产生大量气泡,镁片逐渐溶解 Mg+2HCl=MgCl2+H2↑
铝和稀盐酸 铝片表面迅速产生大量气泡,铝片逐渐溶解 2Al+6HCl=3AlCl3+3H2↑
锌和稀盐酸 锌片表面迅速产生气泡 Zn+2HCl=ZnCl2+H2↑
铁和稀盐酸 铁片表面缓慢产生气泡,溶液逐渐变为浅绿色 Fe+2HCl=FeCl2+H2↑
酸与金属氧化物反应
酸与金属氧化物反应 实验现象 反应方程式
取少量黑色金属氧化铜粉末于试管中,滴入稀盐酸,加热并振荡。 黑色固体逐渐溶解,生成蓝色溶液 CuO+2HCl=CuCl2+H2O
在试管中放入一支生满锈的铁钉,滴入稀硫酸加热并振荡 铁锈逐渐溶解,生成黄色溶液 Fe2O3+6HCl=2FeCl3+3H2O
【小结】酸可以和多数金属氧化物反应生成盐和水
酸与盐反应
【小结】酸和某些盐反应生成新酸和新盐
酸与盐反应 实验现象 反应方程式
稀盐酸滴入石灰石中 石灰石表面产生大量气泡,石灰石逐渐溶解 CaCO3+2HCl=CaCl2+CO2↑+H2O
稀盐酸滴入硝酸银溶液中 溶液中产生白色沉淀 AgNO3+HCl=AgCl↓+HNO3
稀酸的化学性质总结
课堂练习
1.下列说法不正确的是( )
A.浓硫酸溶于水放出大量的热
B.浓盐酸露置于空气中,溶质的质量分数减小
C.浓硫酸置于空气中溶质质量增加
D.打开浓盐酸的试剂瓶,瓶口会产生白雾
【解答】解:A.浓硫酸溶于水放出大量的热,A正确;B.浓盐酸具有挥发性,露置于空气中,会挥发出HCl气体,使溶质质量减小,溶质的质量分数减小,B正确;C.浓硫酸具有吸水性,置于空气中会吸收空气中水分,使溶剂质量增加,溶质质量不变;C不正确;D.浓盐酸具有挥发性,露置于空气中,会挥发出HCl气体,与空气中水蒸气结合成盐酸小液滴,形成白雾,D正确;故选:C。
2.在做氧化铜与稀盐酸反应的实验,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是( )①该实验是将氧化铜逐渐加入到盛有稀盐酸的容器中②a点表示氧化铜与稀盐酸恰好完全反应③a点和b点对应溶液中铜元素的质量相等④a点和b点对应溶液蒸发结晶后得到的固体成分不相同
A.②③ B.①②③
C.③④ D.②③④
【解答】解:①反应前溶液质量是0,该实验是将稀盐酸逐渐加入到盛有氧化铜的容器中,该选项说法不正确;②a点表示氧化铜与稀盐酸恰好完全反应,此时溶液中的溶质是氯化铜,该选项说法正确;③b点对应溶液中的溶质是氯化铜和过量的氯化氢,a点和b点对应溶液中铜元素的质量相等,该选项说法正确;④a点和b点对应溶液蒸发结晶后得到的固体成分相同,都是氯化铜,是因为随着蒸发,b中的氯化氢挥发出去,该选项说法不正确。故选:A。
3.某化学兴趣小组利用如图装置进行实验:打开弹簧夹,将液体a滴入试管①中与固体b接触,若试管②中的导管口没有气泡产生,则液体a和固体b的组合可能是( )
A.水和氢氧化钠 B.稀盐酸和碳酸钙
C.水和硝酸铵 D.过氧化氢溶液和二氧化锰
【解答】解:A.氢氧化钠溶于水放热,导致试管中气体膨胀,试管②中的导管口出现气泡;B.碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳逸出时出现气泡;C.硝酸铵溶于水吸热,导致压强减小,试管②中的导管口没有气泡产生;D.过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出时出现气泡。故选:C。
感谢聆听
