河北省邯郸市2022-2023学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 河北省邯郸市2022-2023学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 20:47:24 | ||
图片预览



文档简介
邯郸市2022-2023学年高二上学期期末考试
化学试卷
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H 1 C12 O 16 Na23 S32 Cl 35.5 K 39 Cu64 Rb85.5
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 神舟十三号航天员在中国空间站进行的“天宫课堂”第二次授课活动中,演示了太空“冰雪”实验——过饱和醋酸钠溶液的结晶现象。下列说法正确的是
A. 醋酸钠溶液是非电解质
B. 过饱和醋酸钠溶液结晶过程中ΔH< 0
C. 过饱和醋酸钠溶液结晶过程中ΔS> >0
D. 向水中加入醋酸钠后,水的电离被抑制
2. 某同学根据化学反应Fe+Cu2+=Fe2+ +Cu,并利用实验室材料制作原电池。下列关于该原电池组成的说法正确的是
选项 A B C D
正极 石墨棒 石墨棒 铁棒 铜棒
负极 铁棒 铜棒 铜棒 铁棒
电解质溶液 CuCl2溶液 CuCl2溶液 FeSO4溶液 FeSO4溶液
A. A B. B C. C D. D
3. 归纳范式是根据事实进行概括归纳出共同点,如直链烷烃的通式可用CnH2n+2表示。现有一系列化合物,按下列特点排列,若用通式表示这一系列化合物,则其通式(n属于正整数)为CH2=CH2 CH2=CH-CH=CH2
CH2=CH- CH=CH- CH=CH2 CH2=CH- CH=CH- CH=CH- CH=CH2
A. CnH2n B. CnH2n-2 C. CnH2n-4 D. C2nH2n+2
4. 下列有关物质结构的说法正确的是
A. 道尔顿发现了电子,揭开了原子的奧秘
B. 基态N原子的轨道表示式为
C. 组成元素相同、结构不同的物质不一定互为同素异形体
D. F-的结构示意图为
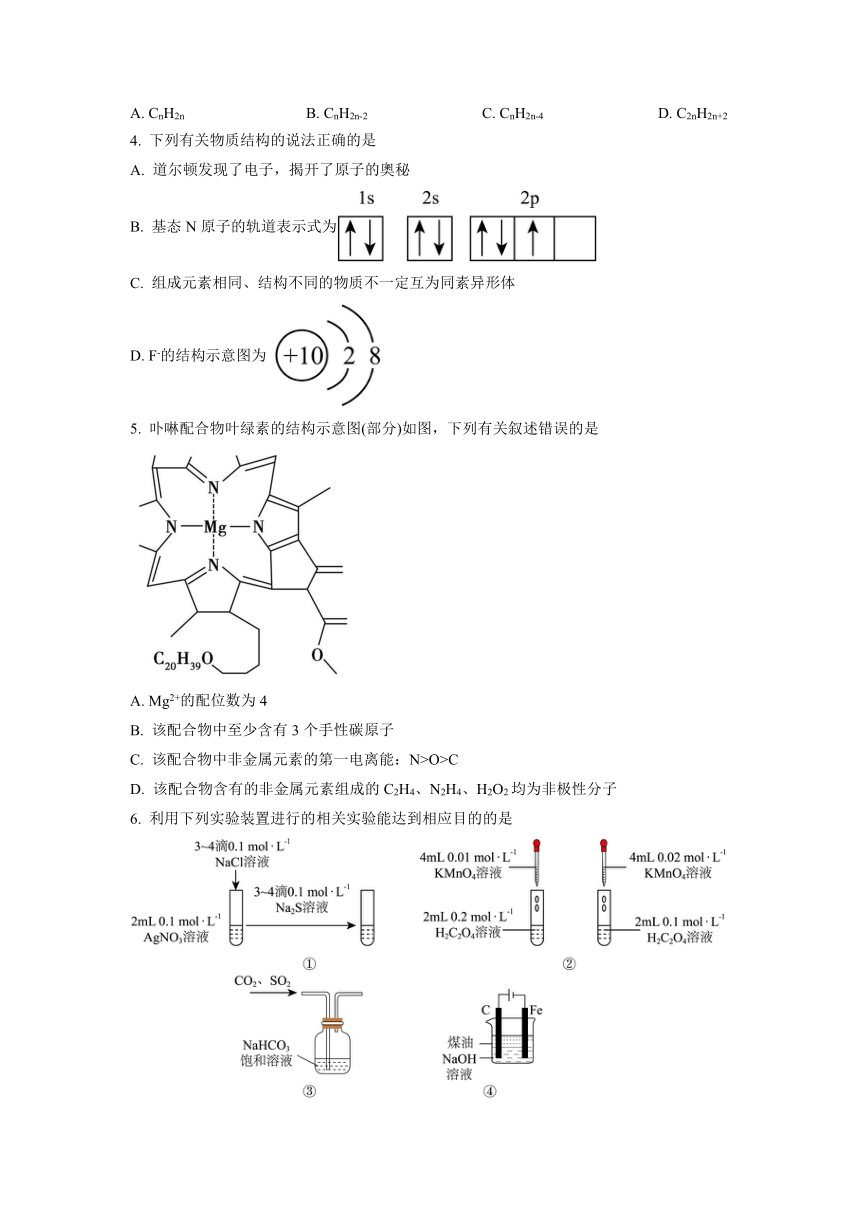
5. 卟啉配合物叶绿素的结构示意图(部分)如图,下列有关叙述错误的是
A. Mg2+的配位数为4
B. 该配合物中至少含有3个手性碳原子
C. 该配合物中非金属元素的第一电离能:N>O>C
D. 该配合物含有的非金属元素组成的C2H4、N2H4、H2O2均为非极性分子
6. 利用下列实验装置进行的相关实验能达到相应目的的是
A. 利用装置①验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B. 利用装置②探究浓度对化学反应速率的影响
C. 利用装置③除去CO2气体中的SO2
D. 利用装置④制备Fe(OH)2并使其保持较长时间不变质
7. 设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 mol·L-1的KCl溶液中含有的K+数目为NA
B. 常温常压下,80 g SO3中含有的氧原子数为3NA
C. 1mol基态P原子中含有的未成对电子数为NA
D. 1 mol CnH2n+2中含有的非极性键数目为nNA
8. 不同催化剂会改变反应的选择性[CH3OCH3的选择性= ],在某催化剂催化下发生的两个反应的能量变化如图所示,下列说法错误的是
A. ΔH1< ΔH2
B. 反应①、反应②均为放热反应
C. 在该条件下,CH3OCH3(g)的生成速率比C2H4(g)的大
D. 改变加入的催化剂,可使E2- E1的值变小
9. 在高压下氮气会发生聚合得到高聚氮,这种高聚氮中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构,其中N-N键的键能为160 kJ·mol-1(N2中N≡N键的键能为942 kJ·mol-1),其晶体片段结构如图所示。下列说法错误的是
A. 高聚氮比氮气稳定
B. 高聚氮为共价晶体
C. 高聚氮与N2互为同素异形体
D. N原子之间的化学键为非极性键
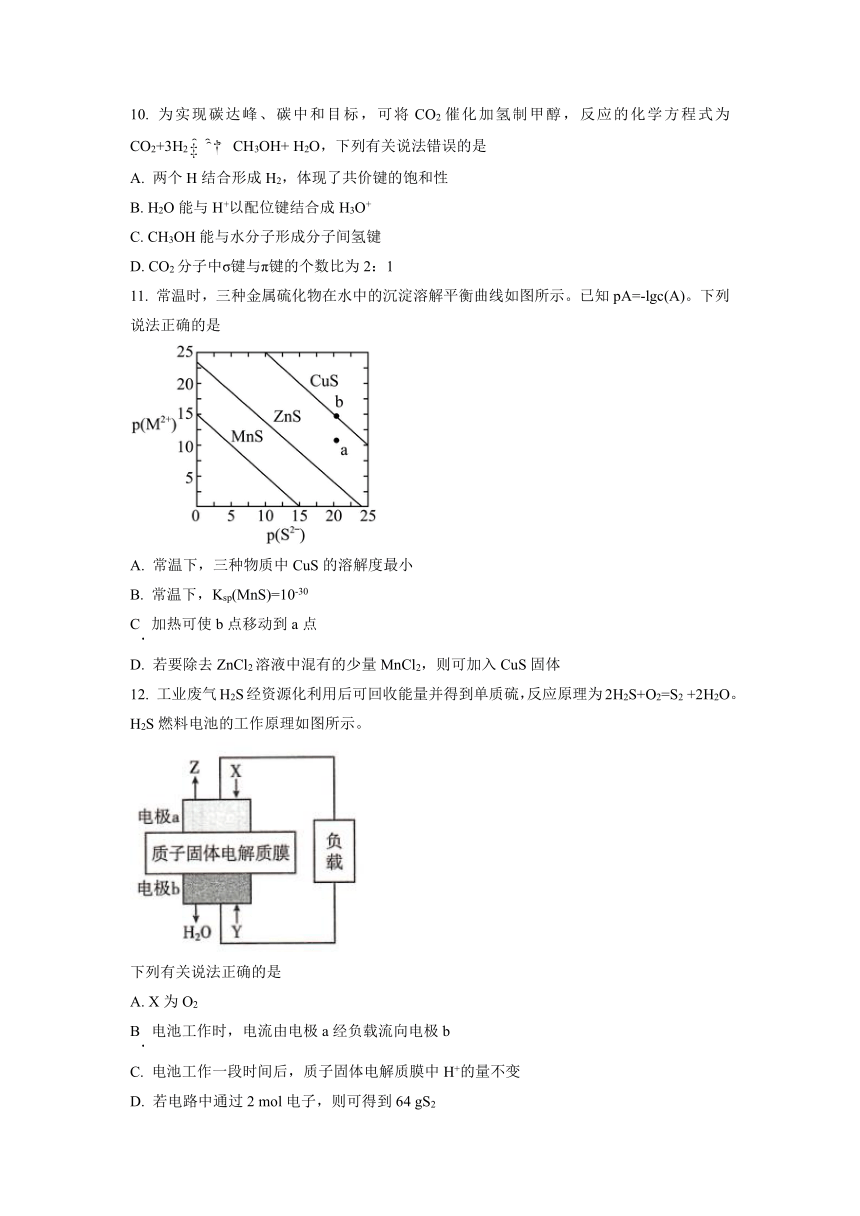
10. 为实现碳达峰、碳中和目标,可将CO2催化加氢制甲醇,反应的化学方程式为CO2+3H2CH3OH+ H2O,下列有关说法错误的是
A. 两个H结合形成H2,体现了共价键的饱和性
B. H2O能与H+以配位键结合成H3O+
C. CH3OH能与水分子形成分子间氢键
D. CO2分子中σ键与π键的个数比为2:1
11. 常温时,三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。已知pA=-lgc(A)。下列说法正确的是
A. 常温下,三种物质中CuS的溶解度最小
B. 常温下,Ksp(MnS)=10-30
C 加热可使b点移动到a点
D. 若要除去ZnCl2溶液中混有的少量MnCl2,则可加入CuS固体
12. 工业废气H2S经资源化利用后可回收能量并得到单质硫,反应原理为2H2S+O2=S2 +2H2O。H2S燃料电池的工作原理如图所示。
下列有关说法正确的是
A. X为O2
B 电池工作时,电流由电极a经负载流向电极b
C. 电池工作一段时间后,质子固体电解质膜中H+的量不变
D. 若电路中通过2 mol电子,则可得到64 gS2
13. 砷化硼晶体是具有超高热导率的半导体材料,其结构如图所示,若晶胞参数为a nm,下列说法正确的是
A. 砷化硼的化学式为B7As2
B. 与顶点B原子距离最近且等距的B原子有6个
C. 晶胞内的4个As原子所围成的空间结构为正四面体形
D. B、As原子之间的最短距离为
14. 常温下,向100 mL0.1 mol·L-1的某二元酸H2A溶液中滴加0.1 mol·L-1的NaOH溶液,溶液中含A微粒的物质的量浓度随溶液pH的变化如图所示,下列说法正确的是
A. 该二元酸的第一步电离是完全的
B. H2A的第二步电离平衡常数的数量级为10-5
C. pH=3时,c(HA- )>c(H2A)>c(A2- )
D. 当加入100mLNaOH溶液时,溶液显碱性
二、非选择题:本题共4小题,共58分。
15. 现有X、Y、Z、W、R五种前四周期的元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
X元素是形成化合物种类最多的元素
Y元素基态原子的核外p电子比s电子多3个
Z元素最高正价与最低负价的代数和为4
W元素主族序数与周期数的差为4
R元素位于元素周期表中的第八列
(1)R元素位于元素周期表的_______区。已知该元素的+3价离子比+2价离子稳定,请简述其原因:___________。
(2)W的基态原子含有______个原子轨道,其中电子所占据的最高能级的原子轨道呈_______形。
(3)X、Y、Z、W的最高价氧化物对应水化物的酸性由强到弱的顺序为______________(用化学式表示)。
(4)YW3的电子式为__________。该物质遇水会发生水解反应,生成HYO2,同时产生白雾,写出该反应的化学方程式:_________________________。
16. 某同学利用如下实验仪器及试剂完成酸碱中和反应反应热的测定实验。
仪器:
试剂:pH=1盐酸、pH=1的醋酸、NaOH固体、酚酞、甲基橙蒸馏水。
回答下列有关问题:
(1)由于两瓶酸的标签已脱落,请利用上述仪器和试剂设计实验来确认哪一瓶是盐酸:_____________。
(2)①配制250 mL NaOH溶液:由于缺少________________________(填仪器名称),无法准确配制0.100 mol·L-1的NaOH溶液。
②用中和滴定法测定新配制的NaOH溶液的物质的量浓度,其操作可分解为如下几步:
a.检查滴定管是否漏水;
b.取20. 00 mL的待测液于锥形瓶中,并滴加几滴指示剂;
c.用标准溶液润洗装标准溶液的滴定管,用待测液润洗装待测液的滴定管;
d.装标准溶液和待测液并调整液面(记录初读数);
e.用蒸馏水洗涤玻璃仪器;
f.进行滴定操作。
正确的操作顺序为_____________________。
③选用0.1000 mol· L-1的盐酸为标准溶液、______作指示剂 ;滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____;直到加入____为止。滴定结果如下所示:
次数 盐酸溶液起始读数 盐酸溶液终点读数
第一次 0.10mL 23.75 mL
第二次 0.80 mL 24.40 mL
第三次 0.30 mL 23.85 mL
则新配制的NaOH溶液的物质的量浓度为_______mol·L-1。
(3)完成酸碱中和反应反应热的测定实验(溶液的密度均视为1 g·mL-1,反应后生成溶液的比热容c=4.2J·g-1·°C-1):
取碎纸条、硬纸板以及D、E、H组装好实验装置,实验中取50 mL pH=1的盐酸与50 mL新配制的NaOH溶液进行反应,若测得反应前后温差为0.68 °C ,经计算该实验中酸碱中和生成1 mol水时放出的热量为57. 12 kJ,该数值与理论值(理论值为57.3 kJ)有偏差,其原因可能是_____________(任填一条)。
17. 甲烷在日常生活及有机合成中用途广泛,某实验小组研究甲烷在高温下气相裂解反应的原理及其应用。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=- 890.3 kJ·mol-1
②C2H4(g) + 3O2(g)=2CO2(g)+2H2O(l) ΔH2=- 1323.8 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3= -571.6 kJ·mol-1
(1)裂解反应2CH4(g)C2H4(g)+2H2(g) ΔH=______ kJ·mol-1。
(2)在某密闭容器中投入1 mol CH4(g),在不同条件下发生反应: 2CH4(g) C2H4(g)+2H2(g)。实验测得平衡时C2H4(g)的物质的量随温度、压强的变化如图1所示。
①M点时,CH4的转化率为_______,温度:T1____(填“>”、“<”或“=”)T2。
②M、N、Q三点的平衡常数由大到小的顺序为_______________ 。
③M点对应的压强平衡常数Kp=________________ (以分压表示 ,分压=总压 ×物质的量分数)。
④若在某密闭容器中充入2 mol H2、a(a>0)mol C2H4和2 mol CH4,在T1 K、p1 kPa下进行上述反应。为了使该反应逆向进行,a的范围为_____________________。
(3)该实验小组在研究过程中得出固体表面催化裂解甲烷时,几种气体平衡时分压(Pa)与温度(°C)的关系如图2
所示。副反应为2CH4(g) C2H2(g)+3H2(g) ΔH=+376.4 kJ·mol-1。
温度高于1145 °C时,C2H2(g)的平衡分压高于C2H4(g);
温度低于1145 °C时,C2H4(g)的平衡分压高于C2H2(g),
其原因是_____________________________。
18. 某课题组借用足球烯核心成功实现了高效且选择性可精准定制的离子跨膜运输。示意图如图所示。
已知:图中有机物称为冠醚,含C、H、O三种元素。
请回答下列问题:
(1)基态Rb原子的价层电子排布式为____________。基态K原子核外有_____种空间运动状态不同的电子,含钾元素的物质在灼烧时火焰呈________色。
(2)冠醚中所含非金属元素的电负性由小到大的顺序是____________。
(3)几种冠醚与识别的碱金属离子如表所示。
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠(醚)-4 120~150 Li+ (152)
15-冠(醚)-5 170~ 220 Na+ (204)
18-冠(醚)-6 260~320 K+ (276)
21-冠(醚)-7 340~430 Rb+ (304)
21-冠(醚)-7 340~430 Cs+ (334)
冠醚识别碱金属离子的必要条件是______________________。 Li+、Na+、K+、Rb+、Cs+的离子半径依次增大的原因是___________________________________。
(4)足球烯如图1所示。足球烯为_______(填晶体类型)晶体。
(5)铷晶胞为体心立方堆积,如图2所示,晶胞参数为a nm,设1号原子坐标参数为(0,0,0) 、3号原子坐标参数为(1,1,1)。
①2号原子坐标参数为___________。
②设NA为阿伏加德罗常数的值,则该晶胞的密度为____________g· cm-3。
邯郸市2022-2023学年高二上学期期末考试
化学试卷 答案
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【1题答案】
【答案】B
【2题答案】
【答案】A
【3题答案】
【答案】D
【4题答案】
【答案】C
【5题答案】
【答案】D
【6题答案】
【答案】C
【7题答案】
【答案】B
【8题答案】
【答案】D
【9题答案】
【答案】A
【10题答案】
【答案】D
【11题答案】
【答案】A
【12题答案】
【答案】C
【13题答案】
【答案】C
【14题答案】
【答案】B
二、非选择题:本题共4小题,共58分。
【15题答案】
【答案】(1) ①. d ②. +2价离子的价层电子排布式为3d6,而+3价离子的价层电子排布式为3d5,为较稳定的半充满结构
(2) ①. 9 ②. 纺锤(哑铃)
(3)HClO4>H2SO4>H3PO4或(HPO3)>H2CO3
(4) ①. ②. PCl3+2H2O= HPO2 + 3HCl
【16题答案】
【答案】(1)用量筒量取少量相同体积的两种溶液于两个烧杯中,再均加入相同体积的水,用pH计测量稀释后溶液的pH,pH大的溶液为盐酸
(2) ①. 250 mL容量瓶 ②. aecdbf ③. 酚酞 ④. 锥形瓶中溶液颜色变化 ⑤. 最后半滴标准溶液,溶液从红色变为无色,且半分钟不恢复原色 ⑥. 0.118
(3)量筒量取盐酸时仰视读数(或硬纸板没盖好)
【17题答案】
【答案】(1)+114.8
(2) ①. 50% ②. > ③. KM>KN= KQ ④. ⑤. a>1
(3)不同温度下催化剂的选择性不同,温度高于1145 °C.以C2H2为主,温度低于1145 °C.以C2H4为主
【18题答案】
【答案】(1) ①. 5s1 ②. 10 ③. 紫
(2)H(4)分子 (5) ①. (,,) ②.
化学试卷
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H 1 C12 O 16 Na23 S32 Cl 35.5 K 39 Cu64 Rb85.5
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 神舟十三号航天员在中国空间站进行的“天宫课堂”第二次授课活动中,演示了太空“冰雪”实验——过饱和醋酸钠溶液的结晶现象。下列说法正确的是
A. 醋酸钠溶液是非电解质
B. 过饱和醋酸钠溶液结晶过程中ΔH< 0
C. 过饱和醋酸钠溶液结晶过程中ΔS> >0
D. 向水中加入醋酸钠后,水的电离被抑制
2. 某同学根据化学反应Fe+Cu2+=Fe2+ +Cu,并利用实验室材料制作原电池。下列关于该原电池组成的说法正确的是
选项 A B C D
正极 石墨棒 石墨棒 铁棒 铜棒
负极 铁棒 铜棒 铜棒 铁棒
电解质溶液 CuCl2溶液 CuCl2溶液 FeSO4溶液 FeSO4溶液
A. A B. B C. C D. D
3. 归纳范式是根据事实进行概括归纳出共同点,如直链烷烃的通式可用CnH2n+2表示。现有一系列化合物,按下列特点排列,若用通式表示这一系列化合物,则其通式(n属于正整数)为CH2=CH2 CH2=CH-CH=CH2
CH2=CH- CH=CH- CH=CH2 CH2=CH- CH=CH- CH=CH- CH=CH2
A. CnH2n B. CnH2n-2 C. CnH2n-4 D. C2nH2n+2
4. 下列有关物质结构的说法正确的是
A. 道尔顿发现了电子,揭开了原子的奧秘
B. 基态N原子的轨道表示式为
C. 组成元素相同、结构不同的物质不一定互为同素异形体
D. F-的结构示意图为
5. 卟啉配合物叶绿素的结构示意图(部分)如图,下列有关叙述错误的是
A. Mg2+的配位数为4
B. 该配合物中至少含有3个手性碳原子
C. 该配合物中非金属元素的第一电离能:N>O>C
D. 该配合物含有的非金属元素组成的C2H4、N2H4、H2O2均为非极性分子
6. 利用下列实验装置进行的相关实验能达到相应目的的是
A. 利用装置①验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B. 利用装置②探究浓度对化学反应速率的影响
C. 利用装置③除去CO2气体中的SO2
D. 利用装置④制备Fe(OH)2并使其保持较长时间不变质
7. 设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 mol·L-1的KCl溶液中含有的K+数目为NA
B. 常温常压下,80 g SO3中含有的氧原子数为3NA
C. 1mol基态P原子中含有的未成对电子数为NA
D. 1 mol CnH2n+2中含有的非极性键数目为nNA
8. 不同催化剂会改变反应的选择性[CH3OCH3的选择性= ],在某催化剂催化下发生的两个反应的能量变化如图所示,下列说法错误的是
A. ΔH1< ΔH2
B. 反应①、反应②均为放热反应
C. 在该条件下,CH3OCH3(g)的生成速率比C2H4(g)的大
D. 改变加入的催化剂,可使E2- E1的值变小
9. 在高压下氮气会发生聚合得到高聚氮,这种高聚氮中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构,其中N-N键的键能为160 kJ·mol-1(N2中N≡N键的键能为942 kJ·mol-1),其晶体片段结构如图所示。下列说法错误的是
A. 高聚氮比氮气稳定
B. 高聚氮为共价晶体
C. 高聚氮与N2互为同素异形体
D. N原子之间的化学键为非极性键
10. 为实现碳达峰、碳中和目标,可将CO2催化加氢制甲醇,反应的化学方程式为CO2+3H2CH3OH+ H2O,下列有关说法错误的是
A. 两个H结合形成H2,体现了共价键的饱和性
B. H2O能与H+以配位键结合成H3O+
C. CH3OH能与水分子形成分子间氢键
D. CO2分子中σ键与π键的个数比为2:1
11. 常温时,三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。已知pA=-lgc(A)。下列说法正确的是
A. 常温下,三种物质中CuS的溶解度最小
B. 常温下,Ksp(MnS)=10-30
C 加热可使b点移动到a点
D. 若要除去ZnCl2溶液中混有的少量MnCl2,则可加入CuS固体
12. 工业废气H2S经资源化利用后可回收能量并得到单质硫,反应原理为2H2S+O2=S2 +2H2O。H2S燃料电池的工作原理如图所示。
下列有关说法正确的是
A. X为O2
B 电池工作时,电流由电极a经负载流向电极b
C. 电池工作一段时间后,质子固体电解质膜中H+的量不变
D. 若电路中通过2 mol电子,则可得到64 gS2
13. 砷化硼晶体是具有超高热导率的半导体材料,其结构如图所示,若晶胞参数为a nm,下列说法正确的是
A. 砷化硼的化学式为B7As2
B. 与顶点B原子距离最近且等距的B原子有6个
C. 晶胞内的4个As原子所围成的空间结构为正四面体形
D. B、As原子之间的最短距离为
14. 常温下,向100 mL0.1 mol·L-1的某二元酸H2A溶液中滴加0.1 mol·L-1的NaOH溶液,溶液中含A微粒的物质的量浓度随溶液pH的变化如图所示,下列说法正确的是
A. 该二元酸的第一步电离是完全的
B. H2A的第二步电离平衡常数的数量级为10-5
C. pH=3时,c(HA- )>c(H2A)>c(A2- )
D. 当加入100mLNaOH溶液时,溶液显碱性
二、非选择题:本题共4小题,共58分。
15. 现有X、Y、Z、W、R五种前四周期的元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
X元素是形成化合物种类最多的元素
Y元素基态原子的核外p电子比s电子多3个
Z元素最高正价与最低负价的代数和为4
W元素主族序数与周期数的差为4
R元素位于元素周期表中的第八列
(1)R元素位于元素周期表的_______区。已知该元素的+3价离子比+2价离子稳定,请简述其原因:___________。
(2)W的基态原子含有______个原子轨道,其中电子所占据的最高能级的原子轨道呈_______形。
(3)X、Y、Z、W的最高价氧化物对应水化物的酸性由强到弱的顺序为______________(用化学式表示)。
(4)YW3的电子式为__________。该物质遇水会发生水解反应,生成HYO2,同时产生白雾,写出该反应的化学方程式:_________________________。
16. 某同学利用如下实验仪器及试剂完成酸碱中和反应反应热的测定实验。
仪器:
试剂:pH=1盐酸、pH=1的醋酸、NaOH固体、酚酞、甲基橙蒸馏水。
回答下列有关问题:
(1)由于两瓶酸的标签已脱落,请利用上述仪器和试剂设计实验来确认哪一瓶是盐酸:_____________。
(2)①配制250 mL NaOH溶液:由于缺少________________________(填仪器名称),无法准确配制0.100 mol·L-1的NaOH溶液。
②用中和滴定法测定新配制的NaOH溶液的物质的量浓度,其操作可分解为如下几步:
a.检查滴定管是否漏水;
b.取20. 00 mL的待测液于锥形瓶中,并滴加几滴指示剂;
c.用标准溶液润洗装标准溶液的滴定管,用待测液润洗装待测液的滴定管;
d.装标准溶液和待测液并调整液面(记录初读数);
e.用蒸馏水洗涤玻璃仪器;
f.进行滴定操作。
正确的操作顺序为_____________________。
③选用0.1000 mol· L-1的盐酸为标准溶液、______作指示剂 ;滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____;直到加入____为止。滴定结果如下所示:
次数 盐酸溶液起始读数 盐酸溶液终点读数
第一次 0.10mL 23.75 mL
第二次 0.80 mL 24.40 mL
第三次 0.30 mL 23.85 mL
则新配制的NaOH溶液的物质的量浓度为_______mol·L-1。
(3)完成酸碱中和反应反应热的测定实验(溶液的密度均视为1 g·mL-1,反应后生成溶液的比热容c=4.2J·g-1·°C-1):
取碎纸条、硬纸板以及D、E、H组装好实验装置,实验中取50 mL pH=1的盐酸与50 mL新配制的NaOH溶液进行反应,若测得反应前后温差为0.68 °C ,经计算该实验中酸碱中和生成1 mol水时放出的热量为57. 12 kJ,该数值与理论值(理论值为57.3 kJ)有偏差,其原因可能是_____________(任填一条)。
17. 甲烷在日常生活及有机合成中用途广泛,某实验小组研究甲烷在高温下气相裂解反应的原理及其应用。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=- 890.3 kJ·mol-1
②C2H4(g) + 3O2(g)=2CO2(g)+2H2O(l) ΔH2=- 1323.8 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3= -571.6 kJ·mol-1
(1)裂解反应2CH4(g)C2H4(g)+2H2(g) ΔH=______ kJ·mol-1。
(2)在某密闭容器中投入1 mol CH4(g),在不同条件下发生反应: 2CH4(g) C2H4(g)+2H2(g)。实验测得平衡时C2H4(g)的物质的量随温度、压强的变化如图1所示。
①M点时,CH4的转化率为_______,温度:T1____(填“>”、“<”或“=”)T2。
②M、N、Q三点的平衡常数由大到小的顺序为_______________ 。
③M点对应的压强平衡常数Kp=________________ (以分压表示 ,分压=总压 ×物质的量分数)。
④若在某密闭容器中充入2 mol H2、a(a>0)mol C2H4和2 mol CH4,在T1 K、p1 kPa下进行上述反应。为了使该反应逆向进行,a的范围为_____________________。
(3)该实验小组在研究过程中得出固体表面催化裂解甲烷时,几种气体平衡时分压(Pa)与温度(°C)的关系如图2
所示。副反应为2CH4(g) C2H2(g)+3H2(g) ΔH=+376.4 kJ·mol-1。
温度高于1145 °C时,C2H2(g)的平衡分压高于C2H4(g);
温度低于1145 °C时,C2H4(g)的平衡分压高于C2H2(g),
其原因是_____________________________。
18. 某课题组借用足球烯核心成功实现了高效且选择性可精准定制的离子跨膜运输。示意图如图所示。
已知:图中有机物称为冠醚,含C、H、O三种元素。
请回答下列问题:
(1)基态Rb原子的价层电子排布式为____________。基态K原子核外有_____种空间运动状态不同的电子,含钾元素的物质在灼烧时火焰呈________色。
(2)冠醚中所含非金属元素的电负性由小到大的顺序是____________。
(3)几种冠醚与识别的碱金属离子如表所示。
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠(醚)-4 120~150 Li+ (152)
15-冠(醚)-5 170~ 220 Na+ (204)
18-冠(醚)-6 260~320 K+ (276)
21-冠(醚)-7 340~430 Rb+ (304)
21-冠(醚)-7 340~430 Cs+ (334)
冠醚识别碱金属离子的必要条件是______________________。 Li+、Na+、K+、Rb+、Cs+的离子半径依次增大的原因是___________________________________。
(4)足球烯如图1所示。足球烯为_______(填晶体类型)晶体。
(5)铷晶胞为体心立方堆积,如图2所示,晶胞参数为a nm,设1号原子坐标参数为(0,0,0) 、3号原子坐标参数为(1,1,1)。
①2号原子坐标参数为___________。
②设NA为阿伏加德罗常数的值,则该晶胞的密度为____________g· cm-3。
邯郸市2022-2023学年高二上学期期末考试
化学试卷 答案
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【1题答案】
【答案】B
【2题答案】
【答案】A
【3题答案】
【答案】D
【4题答案】
【答案】C
【5题答案】
【答案】D
【6题答案】
【答案】C
【7题答案】
【答案】B
【8题答案】
【答案】D
【9题答案】
【答案】A
【10题答案】
【答案】D
【11题答案】
【答案】A
【12题答案】
【答案】C
【13题答案】
【答案】C
【14题答案】
【答案】B
二、非选择题:本题共4小题,共58分。
【15题答案】
【答案】(1) ①. d ②. +2价离子的价层电子排布式为3d6,而+3价离子的价层电子排布式为3d5,为较稳定的半充满结构
(2) ①. 9 ②. 纺锤(哑铃)
(3)HClO4>H2SO4>H3PO4或(HPO3)>H2CO3
(4) ①. ②. PCl3+2H2O= HPO2 + 3HCl
【16题答案】
【答案】(1)用量筒量取少量相同体积的两种溶液于两个烧杯中,再均加入相同体积的水,用pH计测量稀释后溶液的pH,pH大的溶液为盐酸
(2) ①. 250 mL容量瓶 ②. aecdbf ③. 酚酞 ④. 锥形瓶中溶液颜色变化 ⑤. 最后半滴标准溶液,溶液从红色变为无色,且半分钟不恢复原色 ⑥. 0.118
(3)量筒量取盐酸时仰视读数(或硬纸板没盖好)
【17题答案】
【答案】(1)+114.8
(2) ①. 50% ②. > ③. KM>KN= KQ ④. ⑤. a>1
(3)不同温度下催化剂的选择性不同,温度高于1145 °C.以C2H2为主,温度低于1145 °C.以C2H4为主
【18题答案】
【答案】(1) ①. 5s1 ②. 10 ③. 紫
(2)H
同课章节目录
