2022-2023学年鲁科版高中化学必修1 1.2研究物质性质的基本方法和程序再谈(23张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学必修1 1.2研究物质性质的基本方法和程序再谈(23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 35.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-24 11:06:09 | ||
图片预览






文档简介
(共23张PPT)
研究物质性质的
基本方法和程序再谈
——Fe2+、Fe3+性质探究
课程目标
1.能从物质类别和铁元素化合价的角度探究亚铁盐和铁盐的主要性质,理清铁元素不同价态之间的转化关系,增强证据推理与模型认知能力。
2.回顾研究物质性质的方法和程序,独立思考后与同学合作探究完成亚铁盐和铁盐性质的实验,完成实验报告,并能主动交流,提升科学探究与创新能力。
3.能应用氧化还原反应原理和实验探究Fe2+和Fe3+的转化,掌握Fe2+和Fe3+的检验方法,培养证据推理和模型认知能力。
瓷器中的铁元素
【思考】为什么陶瓷的颜色会随着环境发生变化呢?
瓷器中的铁元素
无处不在的铁元素
铁元素在地壳中的含量处于第四位,仅次于氧、硅和铝元素。
自然界中的铁元素 游离态: 化合态:
实验室中的铁元素
日常生活中的铁元素
研究物质性质的基本方法和程序
基本方法:观察法、实验法、分类法、比较法
基本程序:
预测物质的性质
解释与结论
观察外部特征
实验法和观察
观察法了解物质的存在状态、颜色、气味等物理性质
对实验现象进行分析、综合、推理、得出结论。一般运用比较法,归纳总结出物质的共性和差异
视角一:物质类别
视角二:化合价
分类法
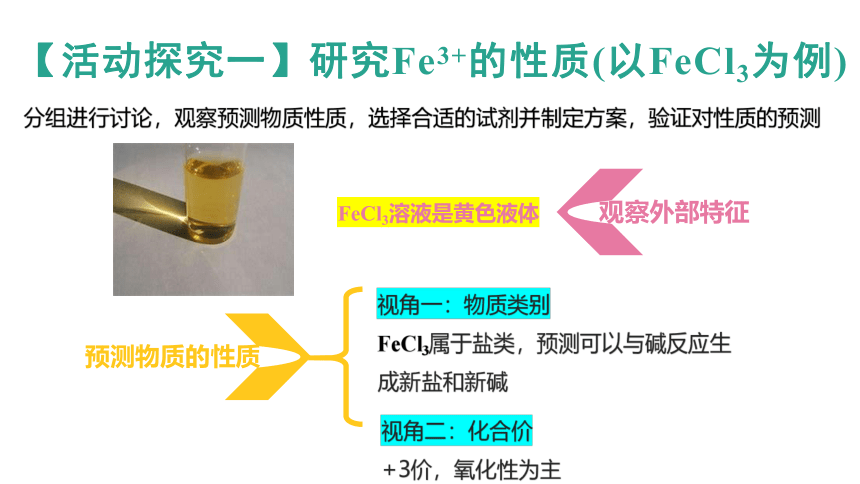
【活动探究一】研究Fe3+的性质(以FeCl3为例)
预测物质的性质
观察外部特征
FeCl3溶液是黄色液体
视角一:物质类别
FeCl3属于盐类,预测可以与碱反应生成新盐和新碱
视角二:化合价
+3价,氧化性为主
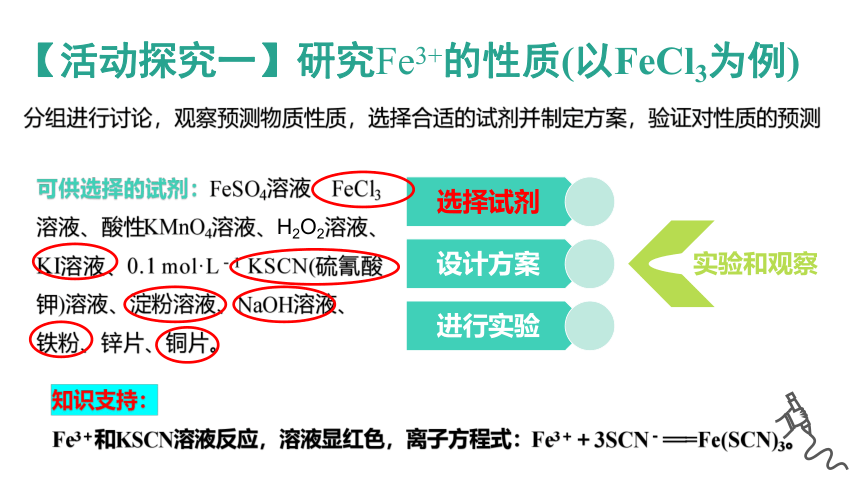
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
实验和观察
可供选择的试剂:FeSO4溶液、FeCl3溶液、酸性KMnO4溶液、H2O2溶液、KI溶液、0.1 mol·L-1 KSCN(硫氰酸钾)溶液、淀粉溶液、NaOH溶液、
铁粉、锌片、铜片。
知识支持:
Fe3+和KSCN溶液反应,溶液显红色,离子方程式:Fe3++3SCN-===Fe(SCN)3。
【活动探究一】研究Fe3+的性质(以FeCl3为例)
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
实验和观察
【活动探究一】研究Fe3+的性质(以FeCl3为例)
实验目的:
实验用品:
实验步骤:
实验现象:
实验结论:
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
物质 预测性质 选择试剂 实验现象 相关离子方程式
Fe3++3OH-=Fe(OH)3↓
观察实验现象并完成表格
2Fe3++Fe= 3Fe2+
盐的性质
氧化性
NaOH溶液
产生红褐色沉淀
KSCN、铁粉
2Fe3++Cu= 2Fe2++Cu2+
2Fe3++2I-= 2Fe2+ +I2
溶液变为蓝色
氯化铁
KI 溶液,淀粉溶液
KSCN、铜片
溶液变红,后
变为浅绿色
溶液变红,后
变为蓝色
【活动探究一】研究Fe3+的性质(以FeCl3为例)
解释与结论
①从物质类别的角度:
FeCl3可以与碱反应生成红褐色沉淀,主要成分为Fe(OH)3
②从化合价的角度:
FeCl3具有氧化性,可以与Fe、Cu、KI发生氧化还原反应
【活动探究一】研究Fe3+的性质(以FeCl3为例)
预测物质的性质
观察外部特征
FeSO4·7H2O是绿色晶体,溶于水溶液呈浅绿色
视角一:物质类别
FeSO4属于盐类,预测可以与碱反应生成新盐和新碱
视角二:化合价
+2价,处于中间价态:①氧化性 ②还原性
【活动探究二】研究Fe2+的性质(以FeSO4为例)
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
实验和观察
可供选择的试剂:FeSO4溶液、FeCl3溶液、酸性KMnO4溶液、H2O2溶液、KI溶液、0.1 mol·L-1 KSCN(硫氰酸钾)溶液、淀粉溶液、NaOH溶液、铁粉、锌片、铜片。
知识支持:
Fe3+和KSCN溶液反应,溶液显红色,离子方程式:Fe3++3SCN-===Fe(SCN)3。
【活动探究二】研究Fe2+的性质(以FeSO4为例)
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
实验和观察
【活动探究二】研究Fe2+的性质(以FeSO4为例)
实验目的:
实验用品:
实验步骤:
实验现象:
实验结论:
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
物质 预测性质 选择试剂 实验现象 相关离子方程式
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O =Fe(OH)3
观察实验现象并完成表格
Fe2+ +Zn=Zn2++Fe
盐的性质
氧化性
NaOH溶液
产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色
锌片
MnO4-+5Fe2+ +8H+=
Mn2+ +5Fe3++4H2O
H2O2+2Fe2++2H+= 2Fe3+ +H2O
溶液变为红色
硫酸亚铁
KSCN、H2O2
酸性KMnO4溶液
析出黑色固体
溶液紫色褪去
还原性
【活动探究二】研究Fe2+的性质(以FeSO4为例)
解释与结论
①从物质类别的角度:
FeSO4可以与碱反应生成白色絮状沉淀,主要成分为Fe(OH)2,但容易被空气中的氧气氧化为红褐色的Fe(OH)3。
②从化合价的角度:
FeSO4具有氧化性,可以与Zn片发生氧化还原反应生成Fe单质。
FeSO4具有还原性,可以被KMnO4、H2O2等氧化剂氧化为Fe3+
【活动探究二】研究Fe2+的性质(以FeSO4为例)
【总结归纳】Fe2+和Fe3+的性质比较
离子 Fe2+ Fe3+
颜色 浅绿色 黄色
化合价 +2 +3
性质 氧化性、还原性 主要体现氧化性
与碱的反应 产生白色沉淀Fe(OH)2 但不稳定 产生红褐色沉淀Fe(OH)3
转化关系
【深度思考】如何检验Fe2+和Fe3+
(1)Fe3+的检验方法
(2)Fe2+的检验方法
(3)同时含有Fe2+、Fe3+的检验方法
【应用体验】
1、实验室保存Fe2+溶液时通常进行密封保存,并加入铁粉
2、电子工业中,人们常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。用耐腐油墨把预先设计的电路印刷在覆铜板上,然后把覆铜板放到FeCl3溶液中,未被油墨覆盖的铜被腐蚀掉,再将油墨清洗后就得到了电路板。
【应用体验】
3、补铁剂和维生素C一起吃可以促进铁元素的吸收
【回顾】
价、类二维图
预测物质的性质
解释与结论
观察外部特征
实验法和观察
【判断正误】
(1)Fe2+的价态为中间价态,要证明其有氧化性应加入还原剂,如铜( )
(2)Fe3+和KSCN溶液反应生成红色沉淀( )
(3)将SO2气体通入FeCl3溶液中,溶液颜色由黄色变为淡绿色,说明Fe3+具有氧化性( )
(4)向某溶液中滴入KSCN溶液,溶液显示红色,则溶液中一定含Fe3+,一定无Fe2+( )
(5)要除去FeCl3溶液中少量的FeCl2杂质,可向溶液通入适量氯气( )
×
×
√
×
√
【跟踪强化】
2.证明某溶液中只含有Fe2+不含有Fe3+的实验方法是
A.先滴加氯水,再滴加KSCN溶液后显红色
B.只需滴加KSCN溶液
C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D.滴加酸性高锰酸钾溶液后溶液褪色
C
研究物质性质的
基本方法和程序再谈
——Fe2+、Fe3+性质探究
课程目标
1.能从物质类别和铁元素化合价的角度探究亚铁盐和铁盐的主要性质,理清铁元素不同价态之间的转化关系,增强证据推理与模型认知能力。
2.回顾研究物质性质的方法和程序,独立思考后与同学合作探究完成亚铁盐和铁盐性质的实验,完成实验报告,并能主动交流,提升科学探究与创新能力。
3.能应用氧化还原反应原理和实验探究Fe2+和Fe3+的转化,掌握Fe2+和Fe3+的检验方法,培养证据推理和模型认知能力。
瓷器中的铁元素
【思考】为什么陶瓷的颜色会随着环境发生变化呢?
瓷器中的铁元素
无处不在的铁元素
铁元素在地壳中的含量处于第四位,仅次于氧、硅和铝元素。
自然界中的铁元素 游离态: 化合态:
实验室中的铁元素
日常生活中的铁元素
研究物质性质的基本方法和程序
基本方法:观察法、实验法、分类法、比较法
基本程序:
预测物质的性质
解释与结论
观察外部特征
实验法和观察
观察法了解物质的存在状态、颜色、气味等物理性质
对实验现象进行分析、综合、推理、得出结论。一般运用比较法,归纳总结出物质的共性和差异
视角一:物质类别
视角二:化合价
分类法
【活动探究一】研究Fe3+的性质(以FeCl3为例)
预测物质的性质
观察外部特征
FeCl3溶液是黄色液体
视角一:物质类别
FeCl3属于盐类,预测可以与碱反应生成新盐和新碱
视角二:化合价
+3价,氧化性为主
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
实验和观察
可供选择的试剂:FeSO4溶液、FeCl3溶液、酸性KMnO4溶液、H2O2溶液、KI溶液、0.1 mol·L-1 KSCN(硫氰酸钾)溶液、淀粉溶液、NaOH溶液、
铁粉、锌片、铜片。
知识支持:
Fe3+和KSCN溶液反应,溶液显红色,离子方程式:Fe3++3SCN-===Fe(SCN)3。
【活动探究一】研究Fe3+的性质(以FeCl3为例)
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
实验和观察
【活动探究一】研究Fe3+的性质(以FeCl3为例)
实验目的:
实验用品:
实验步骤:
实验现象:
实验结论:
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
物质 预测性质 选择试剂 实验现象 相关离子方程式
Fe3++3OH-=Fe(OH)3↓
观察实验现象并完成表格
2Fe3++Fe= 3Fe2+
盐的性质
氧化性
NaOH溶液
产生红褐色沉淀
KSCN、铁粉
2Fe3++Cu= 2Fe2++Cu2+
2Fe3++2I-= 2Fe2+ +I2
溶液变为蓝色
氯化铁
KI 溶液,淀粉溶液
KSCN、铜片
溶液变红,后
变为浅绿色
溶液变红,后
变为蓝色
【活动探究一】研究Fe3+的性质(以FeCl3为例)
解释与结论
①从物质类别的角度:
FeCl3可以与碱反应生成红褐色沉淀,主要成分为Fe(OH)3
②从化合价的角度:
FeCl3具有氧化性,可以与Fe、Cu、KI发生氧化还原反应
【活动探究一】研究Fe3+的性质(以FeCl3为例)
预测物质的性质
观察外部特征
FeSO4·7H2O是绿色晶体,溶于水溶液呈浅绿色
视角一:物质类别
FeSO4属于盐类,预测可以与碱反应生成新盐和新碱
视角二:化合价
+2价,处于中间价态:①氧化性 ②还原性
【活动探究二】研究Fe2+的性质(以FeSO4为例)
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
实验和观察
可供选择的试剂:FeSO4溶液、FeCl3溶液、酸性KMnO4溶液、H2O2溶液、KI溶液、0.1 mol·L-1 KSCN(硫氰酸钾)溶液、淀粉溶液、NaOH溶液、铁粉、锌片、铜片。
知识支持:
Fe3+和KSCN溶液反应,溶液显红色,离子方程式:Fe3++3SCN-===Fe(SCN)3。
【活动探究二】研究Fe2+的性质(以FeSO4为例)
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
实验和观察
【活动探究二】研究Fe2+的性质(以FeSO4为例)
实验目的:
实验用品:
实验步骤:
实验现象:
实验结论:
分组进行讨论,观察预测物质性质,选择合适的试剂并制定方案,验证对性质的预测
物质 预测性质 选择试剂 实验现象 相关离子方程式
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O =Fe(OH)3
观察实验现象并完成表格
Fe2+ +Zn=Zn2++Fe
盐的性质
氧化性
NaOH溶液
产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色
锌片
MnO4-+5Fe2+ +8H+=
Mn2+ +5Fe3++4H2O
H2O2+2Fe2++2H+= 2Fe3+ +H2O
溶液变为红色
硫酸亚铁
KSCN、H2O2
酸性KMnO4溶液
析出黑色固体
溶液紫色褪去
还原性
【活动探究二】研究Fe2+的性质(以FeSO4为例)
解释与结论
①从物质类别的角度:
FeSO4可以与碱反应生成白色絮状沉淀,主要成分为Fe(OH)2,但容易被空气中的氧气氧化为红褐色的Fe(OH)3。
②从化合价的角度:
FeSO4具有氧化性,可以与Zn片发生氧化还原反应生成Fe单质。
FeSO4具有还原性,可以被KMnO4、H2O2等氧化剂氧化为Fe3+
【活动探究二】研究Fe2+的性质(以FeSO4为例)
【总结归纳】Fe2+和Fe3+的性质比较
离子 Fe2+ Fe3+
颜色 浅绿色 黄色
化合价 +2 +3
性质 氧化性、还原性 主要体现氧化性
与碱的反应 产生白色沉淀Fe(OH)2 但不稳定 产生红褐色沉淀Fe(OH)3
转化关系
【深度思考】如何检验Fe2+和Fe3+
(1)Fe3+的检验方法
(2)Fe2+的检验方法
(3)同时含有Fe2+、Fe3+的检验方法
【应用体验】
1、实验室保存Fe2+溶液时通常进行密封保存,并加入铁粉
2、电子工业中,人们常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。用耐腐油墨把预先设计的电路印刷在覆铜板上,然后把覆铜板放到FeCl3溶液中,未被油墨覆盖的铜被腐蚀掉,再将油墨清洗后就得到了电路板。
【应用体验】
3、补铁剂和维生素C一起吃可以促进铁元素的吸收
【回顾】
价、类二维图
预测物质的性质
解释与结论
观察外部特征
实验法和观察
【判断正误】
(1)Fe2+的价态为中间价态,要证明其有氧化性应加入还原剂,如铜( )
(2)Fe3+和KSCN溶液反应生成红色沉淀( )
(3)将SO2气体通入FeCl3溶液中,溶液颜色由黄色变为淡绿色,说明Fe3+具有氧化性( )
(4)向某溶液中滴入KSCN溶液,溶液显示红色,则溶液中一定含Fe3+,一定无Fe2+( )
(5)要除去FeCl3溶液中少量的FeCl2杂质,可向溶液通入适量氯气( )
×
×
√
×
√
【跟踪强化】
2.证明某溶液中只含有Fe2+不含有Fe3+的实验方法是
A.先滴加氯水,再滴加KSCN溶液后显红色
B.只需滴加KSCN溶液
C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D.滴加酸性高锰酸钾溶液后溶液褪色
C
