【原创】第五章第二节《氮及其化合物》课件-2022-2023学年高一化学(人教版)必修第二册(共29张PPT)
文档属性
| 名称 | 【原创】第五章第二节《氮及其化合物》课件-2022-2023学年高一化学(人教版)必修第二册(共29张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-24 11:12:31 | ||
图片预览








文档简介
(共29张PPT)
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
一、氮气与氮的固定
氮元素在自然界的存在形态:
有游离态也有化合态
氮气的物理性质:
氮气是一种无色、无味的气体,
难溶于水。密度比空气的小。
氮气的化学性质:
由于氮分子内氮氮三键(N≡N)键能
很大,难以断裂,所以氮气的化学
性质很稳定,通常情况下难以与其
他物质发生化学反应。
N2+3Mg = Mg3N2
点燃
N2+O2 = 2NO
放电或高温
N2+3H2 2NH3
高温、高压
催化剂
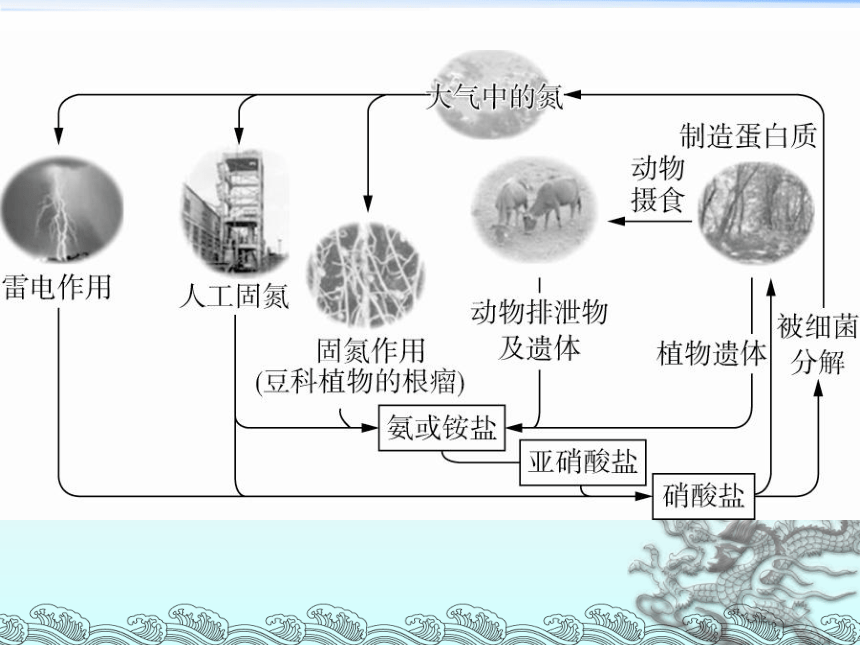
氮的固定:
将大气中游离态的氮转化为氮的
化合物的过程叫做氮的固定。
氮的固定的类型:
自然固定和人工固氮
一氧化氮(NO) 二氧化氮(NO2)
物理
性质
化学
性质
二、一氧化氮和二氧化氮
是无色、无味的有毒
气体,不溶于水。
是红棕色、有刺激性
气味的有毒气体,易
溶于水。易液化。
很容易和氧气化合
N2+O2 = 2NO
3NO2+H2O = 2HNO3
+NO
1、NO和O2的混合气体溶于水时的总反应方程式:
4NO+3O2+2H2O = 4HNO3
2、NO2和O2的混合气体溶于水时的总反应方程式:
4NO2+O2+2H2O = 4HNO3
氮的氧化物和氧气混合并溶于水的两个重要反应:
三、氨气(NH3)
物理性质:
1、NH3是一种无色、有刺激性气味的
气体。
2、容易液化。(液化时放热,液氨汽化时
要吸收大量的热,使周围温度急剧降低。
因此,液氨可用作制冷剂。)
3、极易溶于水,且溶解得快。在常温常
压下,1体积水大约可溶解700体积氨。
用NH3做喷泉实验装置图
化学性质:
(1)和水反应
NH3溶于水后,大部分和水结合生成了NH3·H2O,NH3·H2O只有小部分发生了电离。
NH3+H2O NH3·H2O NH4++OH—
思考:在氨水中存在哪几种微粒(分子和离子)?
3种分子:NH3、H2O、NH3·H2O
3种离子:NH4+、OH—、H+
在以上微粒中,个数最多的是( ),
其次是( )
H2O
NH3·H2O
NH3·H2O是一种弱碱,电离方程式为:
受热也易分解。 NH3·H2O =
NH3·H2O NH4++OH—
NH3↑+H2O
▲
(2)和酸反应
实质:
NH3+H+= NH4+
NH3+HCl = NH4Cl
NH3+HNO3 = NH4NO3
2NH3+H2SO4 = (NH4)2SO4
NH3+H2SO4 = NH4HSO4
3NH3+H3PO4 = (NH4)3PO4
2NH3+H3PO4 = (NH4)2HPO4
NH3+H3PO4 = NH4 H2PO4
NH3或氨水和挥发性酸(浓盐酸、浓硝酸)反应时,
会产生白烟。
(3)催化氧化反应
4NH3+5O2 = 4NO+6H2O
催化剂
加热
(4)和Cl2、NO、NO2、CuO反应
2NH3+3Cl2 = N2+6HCl
8NH3+3Cl2 = N2+6NH4Cl
(NH3不足时)
(NH3过量时)
4NH3+6NO = 5N2+6H2O
催化剂
▲
8NH3+6NO2 = 7N2+12H2O
催化剂
▲
2NH3+3CuO = N2+6H2O
▲
管道工人用浓氨水检验氯气管道是否漏气
8NH3+3Cl2 = N2+6NH4Cl
NH3的实验室制法
原理:
Ca(OH)2+2NH4Cl = CaCl2+2H2O+2NH3↑
▲
装置:
注意事项:
⑴不可用NaOH、KOH代替Ca(OH)2。
⑵不可用NH4NO3、(NH4)2SO4代替NH4Cl。
⑶不可用P2O5、浓H2SO4、CaCl2干燥NH3,
应用碱石灰干燥NH3。
CaCl2+8NH3 = CaCl2·8NH3。
⑷整套装置都应是干燥的。
⑸棉花团的作用是防止NH3与空气对流,提高集气速度和NH3的纯度。
⑹验满的方法是使用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒。
实验室制取氨的简便方法装置图
制取NH3的简便方法:
加热浓氨水、氨水和生石灰、碱石灰、固体氢氧化钠混合。
可不画图
NH3的工业制法:
N2+3H2 2NH3
高温、高压
催化剂
NH3主要用途:
制硝酸、铵盐、纯碱、制冷剂等。
四、铵盐
物理性质:
绝大多数铵盐都易溶于水,也是白色
或无色晶体。
化学性质:
⑴受热可分解
NH4Cl = NH3↑+HCl↑
NH4HCO3 = NH3↑+H2O↑+CO2↑
(NH4)2CO3 = 2NH3↑+H2O ↑ +CO2↑
(NH4)2S = 2NH3↑+H2S↑(加热)
NH4NO3→情况复杂,但不生成NH3。
▲
▲
▲
▲
▲
⑵和碱反应生成NH3·H2O或NH3
①铵盐+碱→NH3
▲
即NH4++OH— = NH3↑+H2O
▲
②浓铵盐+浓碱→NH3
即NH4+(浓)+OH—(浓) = NH3↑+H2O
③稀铵盐+稀碱(不加热)→NH3·H2O
即NH4+(稀)+OH—(稀) = NH3·H2O
如图所示,碳酸铵、碳酸氢铵在太阳下放置,
怎么越来越少?
此页不用记
铵盐的检验方法(即NH4+的检验方法):
(1)试剂:
NaOH溶液和浓盐酸或湿润的红色石蕊试纸
(2)操作:
取少量溶液于试管中,加入少量NaOH溶液,并微热。将一块湿润的红色石蕊试纸放在试管口处(或把蘸有浓盐酸的玻璃棒放在试管口处)。
(3)现象
及结论:
若产生有刺激性气味的气体,且试纸变蓝(或产生白烟),则说明样品中含有NH4+。
(4)有关方程式:
NH4++OH— = NH3↑+H2O
NH3+H2O NH3·H2O NH4++OH—
(NH3+HCl = NH4Cl)
▲
五、硝酸
物理性质:
纯净的硝酸是一种无色、易挥发、有刺激性气味的液体。
化学性质:
1.具有酸的大部分通性
2.具有不稳定性
纯净的硝酸或浓硝酸见光或受热就会分解,硝酸越浓,就越容易分解。
4HNO3 = 4NO2↑+2H2O+O2↑
光照或▲
长期放置的浓硝酸会呈黄色,因为硝酸分解产生的NO2又溶在了硝酸中。保存硝酸应( )
用棕色瓶、玻璃塞、并置于阴暗处。
3.具有强氧化性
本质:
HNO3中+5价的N原子具有很强的得电子能力。
规律:
硝酸越浓,氧化性越强,被还原后氮元素的价态越高。硝酸越稀,氧化性越弱,被还原后氮元素的价态越低。
(1)氧化金属
在金属活动性顺序表中,除Pt、Au外,其余金属均可被HNO3氧化;其中氢以前的金属和HNO3反应时,浓硝酸被还原成NO2,稀硝酸被还原成NO或N2O、N2、NH4NO3等(规律是HNO3越稀,被还原后N元素的价态越低);铁、铝可被浓HNO3钝化。氢以后的金属和HNO3反应时,浓硝酸被还原为NO2,稀HNO3被还原为NO;无论什么金属,和HNO3反应时都不生成H2。常见重要反应如下:
3Cu+8HNO3(稀) = 3Cu(NO3)2+4H2O+2NO↑
Cu+4HNO3(浓) = Cu(NO3)2+2H2O+2NO2↑
Mg+4HNO3 = Mg(NO3)2+2H2O+2NO2↑
(或NO、N2O、N2、NH4NO3)
HNO3浓 稀
(2)氧化非金属(C、S、P)
C+4HNO3(浓) = CO2↑+4NO2↑+2H2O
S+6HNO3(浓) = H2SO4+6NO2↑+2H2O
P+5HNO3(浓) = H3PO4+5NO2↑+H2O
▲
▲
▲
(3)氧化化合物
①含-1价I的化合物(如HI、KI)
如6I—+2NO3—+8H+ = 3I2+4H2O+2NO↑
②含+2价Fe的化合物(如FeO、FeCl2)
如3Fe2++4H++NO3— = 3Fe3++2H2O+NO↑
③含-2价S的化合物(如H2S、Na2S) S(-2)→S(0)
④含+4价S的化合物(如SO2、Na2SO3)
SO2→SO42—;SO32—→SO42—
⑤浓硝酸可氧化含-1价Br的化合物(如HBr、NaBr)
Br(-1) → Br2
浓硝酸和浓盐酸按体积比(实际为物质的量之比)1∶3制成的混合物叫做王水,氧化性更强,可以将金、铂氧化。
六、酸雨及防治
概念:
PH小于5.6的雨水叫酸雨。
二氧化硫、氮氧化物以及它们在大气中发
生反应后的生成物溶于雨水。
成因:
二氧化硫、氮氧化物的主要来源:
(1)SO2主要来自于煤、石油、含硫矿物的燃烧
或冶炼。
(2)氮氧化物主要来自于机动车排放的尾气。
(在发动机中,高温条件下空气中的N2和O2
反应生成氮氧化物)
危害:
(1)损伤农作物。
(2)破坏森林和草原。
(3)使土壤、湖泊酸化。
(4)加速建筑物、桥梁、工业设备、运输工具
和电缆的腐蚀。
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
一、氮气与氮的固定
氮元素在自然界的存在形态:
有游离态也有化合态
氮气的物理性质:
氮气是一种无色、无味的气体,
难溶于水。密度比空气的小。
氮气的化学性质:
由于氮分子内氮氮三键(N≡N)键能
很大,难以断裂,所以氮气的化学
性质很稳定,通常情况下难以与其
他物质发生化学反应。
N2+3Mg = Mg3N2
点燃
N2+O2 = 2NO
放电或高温
N2+3H2 2NH3
高温、高压
催化剂
氮的固定:
将大气中游离态的氮转化为氮的
化合物的过程叫做氮的固定。
氮的固定的类型:
自然固定和人工固氮
一氧化氮(NO) 二氧化氮(NO2)
物理
性质
化学
性质
二、一氧化氮和二氧化氮
是无色、无味的有毒
气体,不溶于水。
是红棕色、有刺激性
气味的有毒气体,易
溶于水。易液化。
很容易和氧气化合
N2+O2 = 2NO
3NO2+H2O = 2HNO3
+NO
1、NO和O2的混合气体溶于水时的总反应方程式:
4NO+3O2+2H2O = 4HNO3
2、NO2和O2的混合气体溶于水时的总反应方程式:
4NO2+O2+2H2O = 4HNO3
氮的氧化物和氧气混合并溶于水的两个重要反应:
三、氨气(NH3)
物理性质:
1、NH3是一种无色、有刺激性气味的
气体。
2、容易液化。(液化时放热,液氨汽化时
要吸收大量的热,使周围温度急剧降低。
因此,液氨可用作制冷剂。)
3、极易溶于水,且溶解得快。在常温常
压下,1体积水大约可溶解700体积氨。
用NH3做喷泉实验装置图
化学性质:
(1)和水反应
NH3溶于水后,大部分和水结合生成了NH3·H2O,NH3·H2O只有小部分发生了电离。
NH3+H2O NH3·H2O NH4++OH—
思考:在氨水中存在哪几种微粒(分子和离子)?
3种分子:NH3、H2O、NH3·H2O
3种离子:NH4+、OH—、H+
在以上微粒中,个数最多的是( ),
其次是( )
H2O
NH3·H2O
NH3·H2O是一种弱碱,电离方程式为:
受热也易分解。 NH3·H2O =
NH3·H2O NH4++OH—
NH3↑+H2O
▲
(2)和酸反应
实质:
NH3+H+= NH4+
NH3+HCl = NH4Cl
NH3+HNO3 = NH4NO3
2NH3+H2SO4 = (NH4)2SO4
NH3+H2SO4 = NH4HSO4
3NH3+H3PO4 = (NH4)3PO4
2NH3+H3PO4 = (NH4)2HPO4
NH3+H3PO4 = NH4 H2PO4
NH3或氨水和挥发性酸(浓盐酸、浓硝酸)反应时,
会产生白烟。
(3)催化氧化反应
4NH3+5O2 = 4NO+6H2O
催化剂
加热
(4)和Cl2、NO、NO2、CuO反应
2NH3+3Cl2 = N2+6HCl
8NH3+3Cl2 = N2+6NH4Cl
(NH3不足时)
(NH3过量时)
4NH3+6NO = 5N2+6H2O
催化剂
▲
8NH3+6NO2 = 7N2+12H2O
催化剂
▲
2NH3+3CuO = N2+6H2O
▲
管道工人用浓氨水检验氯气管道是否漏气
8NH3+3Cl2 = N2+6NH4Cl
NH3的实验室制法
原理:
Ca(OH)2+2NH4Cl = CaCl2+2H2O+2NH3↑
▲
装置:
注意事项:
⑴不可用NaOH、KOH代替Ca(OH)2。
⑵不可用NH4NO3、(NH4)2SO4代替NH4Cl。
⑶不可用P2O5、浓H2SO4、CaCl2干燥NH3,
应用碱石灰干燥NH3。
CaCl2+8NH3 = CaCl2·8NH3。
⑷整套装置都应是干燥的。
⑸棉花团的作用是防止NH3与空气对流,提高集气速度和NH3的纯度。
⑹验满的方法是使用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒。
实验室制取氨的简便方法装置图
制取NH3的简便方法:
加热浓氨水、氨水和生石灰、碱石灰、固体氢氧化钠混合。
可不画图
NH3的工业制法:
N2+3H2 2NH3
高温、高压
催化剂
NH3主要用途:
制硝酸、铵盐、纯碱、制冷剂等。
四、铵盐
物理性质:
绝大多数铵盐都易溶于水,也是白色
或无色晶体。
化学性质:
⑴受热可分解
NH4Cl = NH3↑+HCl↑
NH4HCO3 = NH3↑+H2O↑+CO2↑
(NH4)2CO3 = 2NH3↑+H2O ↑ +CO2↑
(NH4)2S = 2NH3↑+H2S↑(加热)
NH4NO3→情况复杂,但不生成NH3。
▲
▲
▲
▲
▲
⑵和碱反应生成NH3·H2O或NH3
①铵盐+碱→NH3
▲
即NH4++OH— = NH3↑+H2O
▲
②浓铵盐+浓碱→NH3
即NH4+(浓)+OH—(浓) = NH3↑+H2O
③稀铵盐+稀碱(不加热)→NH3·H2O
即NH4+(稀)+OH—(稀) = NH3·H2O
如图所示,碳酸铵、碳酸氢铵在太阳下放置,
怎么越来越少?
此页不用记
铵盐的检验方法(即NH4+的检验方法):
(1)试剂:
NaOH溶液和浓盐酸或湿润的红色石蕊试纸
(2)操作:
取少量溶液于试管中,加入少量NaOH溶液,并微热。将一块湿润的红色石蕊试纸放在试管口处(或把蘸有浓盐酸的玻璃棒放在试管口处)。
(3)现象
及结论:
若产生有刺激性气味的气体,且试纸变蓝(或产生白烟),则说明样品中含有NH4+。
(4)有关方程式:
NH4++OH— = NH3↑+H2O
NH3+H2O NH3·H2O NH4++OH—
(NH3+HCl = NH4Cl)
▲
五、硝酸
物理性质:
纯净的硝酸是一种无色、易挥发、有刺激性气味的液体。
化学性质:
1.具有酸的大部分通性
2.具有不稳定性
纯净的硝酸或浓硝酸见光或受热就会分解,硝酸越浓,就越容易分解。
4HNO3 = 4NO2↑+2H2O+O2↑
光照或▲
长期放置的浓硝酸会呈黄色,因为硝酸分解产生的NO2又溶在了硝酸中。保存硝酸应( )
用棕色瓶、玻璃塞、并置于阴暗处。
3.具有强氧化性
本质:
HNO3中+5价的N原子具有很强的得电子能力。
规律:
硝酸越浓,氧化性越强,被还原后氮元素的价态越高。硝酸越稀,氧化性越弱,被还原后氮元素的价态越低。
(1)氧化金属
在金属活动性顺序表中,除Pt、Au外,其余金属均可被HNO3氧化;其中氢以前的金属和HNO3反应时,浓硝酸被还原成NO2,稀硝酸被还原成NO或N2O、N2、NH4NO3等(规律是HNO3越稀,被还原后N元素的价态越低);铁、铝可被浓HNO3钝化。氢以后的金属和HNO3反应时,浓硝酸被还原为NO2,稀HNO3被还原为NO;无论什么金属,和HNO3反应时都不生成H2。常见重要反应如下:
3Cu+8HNO3(稀) = 3Cu(NO3)2+4H2O+2NO↑
Cu+4HNO3(浓) = Cu(NO3)2+2H2O+2NO2↑
Mg+4HNO3 = Mg(NO3)2+2H2O+2NO2↑
(或NO、N2O、N2、NH4NO3)
HNO3浓 稀
(2)氧化非金属(C、S、P)
C+4HNO3(浓) = CO2↑+4NO2↑+2H2O
S+6HNO3(浓) = H2SO4+6NO2↑+2H2O
P+5HNO3(浓) = H3PO4+5NO2↑+H2O
▲
▲
▲
(3)氧化化合物
①含-1价I的化合物(如HI、KI)
如6I—+2NO3—+8H+ = 3I2+4H2O+2NO↑
②含+2价Fe的化合物(如FeO、FeCl2)
如3Fe2++4H++NO3— = 3Fe3++2H2O+NO↑
③含-2价S的化合物(如H2S、Na2S) S(-2)→S(0)
④含+4价S的化合物(如SO2、Na2SO3)
SO2→SO42—;SO32—→SO42—
⑤浓硝酸可氧化含-1价Br的化合物(如HBr、NaBr)
Br(-1) → Br2
浓硝酸和浓盐酸按体积比(实际为物质的量之比)1∶3制成的混合物叫做王水,氧化性更强,可以将金、铂氧化。
六、酸雨及防治
概念:
PH小于5.6的雨水叫酸雨。
二氧化硫、氮氧化物以及它们在大气中发
生反应后的生成物溶于雨水。
成因:
二氧化硫、氮氧化物的主要来源:
(1)SO2主要来自于煤、石油、含硫矿物的燃烧
或冶炼。
(2)氮氧化物主要来自于机动车排放的尾气。
(在发动机中,高温条件下空气中的N2和O2
反应生成氮氧化物)
危害:
(1)损伤农作物。
(2)破坏森林和草原。
(3)使土壤、湖泊酸化。
(4)加速建筑物、桥梁、工业设备、运输工具
和电缆的腐蚀。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
