第五章第一节第2课时《硫酸》课件(共26张PPT)-2022-2023学年高一化学(人教版)必修第二册
文档属性
| 名称 | 第五章第一节第2课时《硫酸》课件(共26张PPT)-2022-2023学年高一化学(人教版)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-24 11:13:32 | ||
图片预览






文档简介
(共26张PPT)
人教版必修(第二册)
第五章 化学生产中的重要非金属元素
第一节 硫及其化合物
第2课时——硫 酸
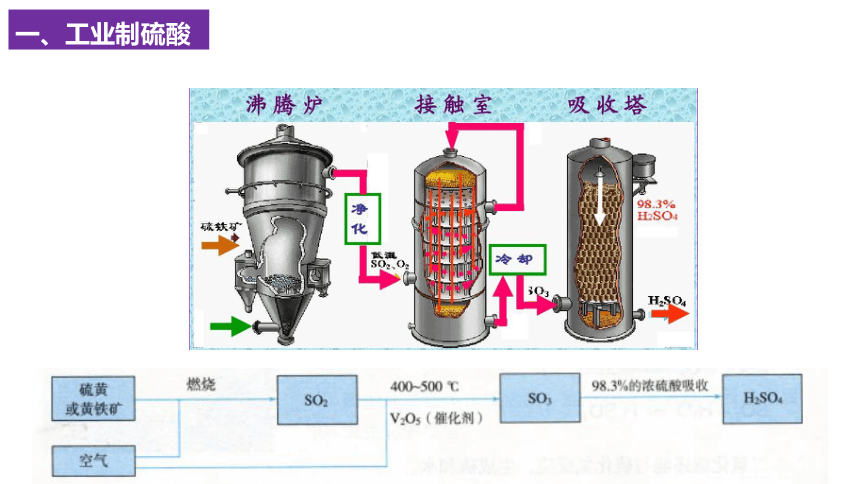
一、工业制硫酸
H2O+SO3=H2SO4
△
4FeS2 + 11O2 == 2Fe2O3 + 8SO2
△
思考与讨论1:根据上面关于工业制硫酸的介绍,能否写出相关的化学反应方程式。
一、工业制硫酸
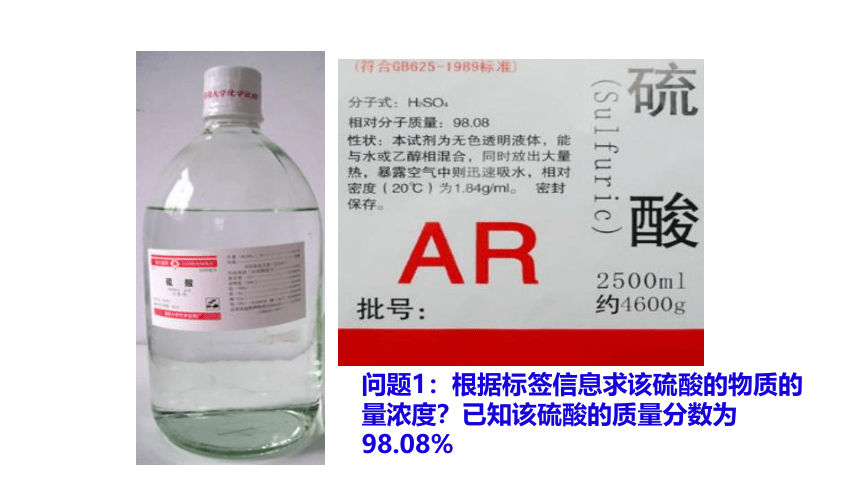
问题1:根据标签信息求该硫酸的物质的量浓度?已知该硫酸的质量分数为98.08%
(一) 物理性质
无色
油状液体
338℃
难挥发
比水大
与水任意比混溶, 稀释时释放大量热
1.颜色:
2.状态:
3.沸点:
4.密度:
5.水溶性:
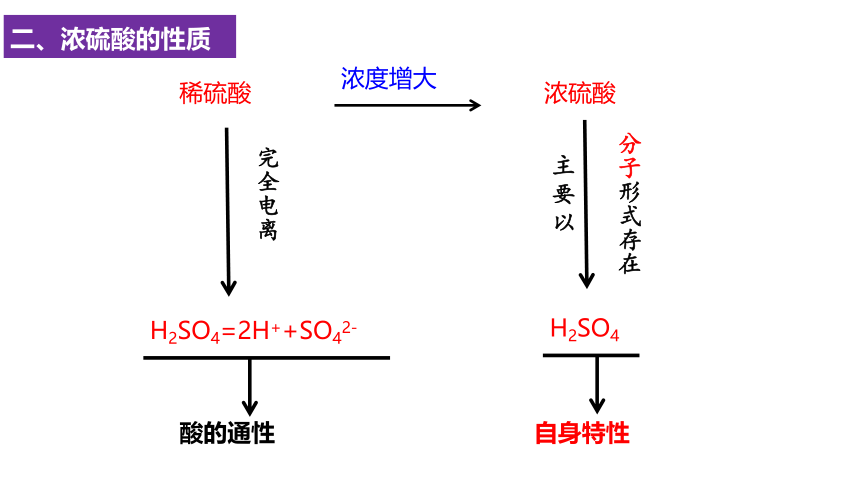
二、浓硫酸的性质
思考与讨论2:稀释浓硫酸时应该如何操作
稀硫酸
完全电离
H2SO4=2H++SO42-
酸的通性
浓度增大
浓硫酸
主要以
分子形式存在
H2SO4
自身特性
二、浓硫酸的性质
蓝色晶体变为白色粉末
现象:
原理:
(二) 化学性质
实验1:
① 2支试管各加入2 mL浓硫酸, 其一敞开久置, 另一密封保存, 观察;
② 向试管中加入少量的胆矾, 再加入2 mL浓硫酸, 观察.
敞口试管溶液体积较密封增大
二、浓硫酸的性质
指浓硫酸具有吸收游离水的性质
(1) 游离水包括: 结晶水、水蒸气;
(2) 吸水本质: nH2O+H2SO4= H2SO4 nH2O;
(3) 吸水放热;
(4) 作某些气体干燥剂。
1、浓硫酸的吸水性:
(二) 化学性质
二、浓硫酸的性质
实验2: 取2g蔗糖放入烧杯中, 滴加几滴水, 搅拌均匀, 然后加入适量浓硫酸, 搅拌, 观察现象。
“黑面包”实验
二、浓硫酸的性质
1.烧杯壁为什么是热的?
3.为什么体积会膨胀?
5.这一过程表现了浓硫酸的什么性质?
4.刺激性气味气体可能含什么?
2.为什么蔗糖会变黑?
浓硫酸吸水放热
蔗糖炭化
有气体生成
脱水性、强氧化性
SO2、CO2
二、浓硫酸的性质
原理:
指浓硫酸能将某些有机物中的H、O原子的组成比(2:1)脱去, 使其炭化的性质。
2.浓硫酸的脱水性:
滴加几滴水的作用
(二) 化学性质
变黑
pH试纸先变红后变黑
思考与讨论3:把少量浓硫酸滴在纸片或火柴梗上,有什么现象?把少量浓硫酸滴在pH试纸上,有什么现象?
二、浓硫酸的性质
蔗糖变黑
放出热量
现象:
产生气体
本质:
脱水性
吸水性
强氧化性
(1) 与非金属单质反应
(例如与C反应)
3. 浓硫酸的强氧化性
(二) 化学性质
二、浓硫酸的性质
3、浓硫酸的强氧化性
【实验5-3】
(二) 化学性质
二、浓硫酸的性质
产生气体, 品红褪色;溶液无色色变成蓝色。试管底部有白色固体生成。
现象:
原理:
说明:
①反应条件:
②浓硫酸显:
(2) 与金属单质反应
浓硫酸, 加热
酸性和强氧化性
(例如与Cu反应)
二、浓硫酸的性质
(1)通过可抽动的铜丝来控制反应的发生或停止。
(2)浸有碱液的棉花团可以吸收多余的SO2,以防止污染环境。
思考与讨论4:回顾刚才的实验,可抽动的铜丝有什么作用?浸有碱液的棉花团有什么作用?
思考与讨论5:
Cu+2H2SO4(浓)
CuSO4+
SO2↑+2H2O
(1) 上述方程式中,谁是氧化剂,谁是还原剂?
(2) 浓硫酸在这个反应中体现了什么性质?
(3) 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
(4)浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
二、浓硫酸的性质
小结:浓硫酸的强氧化性
③与还原性化合物反应,如H2S、HBr等(浓硫酸不能干燥H2S、HBr)
判断正误
(1)可以用稀硫酸洗涤金属表面的氧化物( )
(2)浓硫酸有脱水性,因此可以用于干燥H2、CO2等气体( )
(3)浓硫酸能使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的脱水性( )
(4)金属铜在常温下放入浓硫酸无现象,是浓硫酸把铜钝化了( )
(5)100 mL 18.0 mol·L-1的浓硫酸和足量铜反应生成SO2的分子数目为0.9NA( )
×
√
×
×
×
(6)浓硫酸有强烈的吸水性,因此可以干燥SO2、H2S、HI、NH3等气体( )
(7)蔗糖和浓硫酸的“黑面包”实验中,主要体现了浓硫酸的脱水性和强氧化性( )
√
×
(6)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体____。
应用体验
1.下列各过程主要表现了浓硫酸的哪些性质?请将答案的序号分别填在横线上。
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体___。
③
(2)用磷矿物(主要成分是磷酸钙)和硫酸反应制磷酸_____。
①
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体_______。
(4)常温下可以用铁或铝的容器贮存浓硫酸______。
⑤
②
(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末_____。
⑤
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑______。
②
①④
2.(1)50 mL物质的量浓度为18 mol·L-1的硫酸中加入足量铜片并加热,充分反应,被还原的硫酸_______0.9 mol(填“大于”“等于”或“小于”,下同),消耗铜的物质的量_____0.45 mol。原因是___________________
______________________________。
小于
小于
随着反应的进行,
浓硫酸变稀,稀硫酸不与铜反应
(2)将一定量的锌与100 mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1,则下列叙述正确的是_____(填字母)。
A.气体A为SO2和H2的混合物 B.气体A中SO2和H2的体积比为4∶1
C.反应中共消耗Zn 97.5 g D.反应中共转移3 mol电子
ACD
(2)理论解释
白色
①先加稀盐酸的目的是排除 、 、 等离子的干扰。
②再加入BaCl2溶液,若存在 ,发生反应的离子方程式为
。
Ag+
SO42-检验的正确操作及理解
判断正误
(1)取少量试样溶液,加入用稀盐酸酸化的BaCl2溶液,有白色沉淀生成,则溶液中一定含有 ( )
(2)取少量试样溶液,先加入BaCl2溶液,有白色沉淀生成,再加稀HNO3,沉淀不溶解,则溶液中一定含有 ( )
(3)取少量试样溶液,先加入稀硫酸,无现象,再加入BaCl2,有白色沉淀生成,则溶液中一定含有 ( )
×
×
×
(4)为除去粗盐水中少量的 ,可向溶液中加入过量的K2CO3溶液,然后过滤( )
(5)为除去粗盐中的Mg2+、Ca2+、 ,可依次加入稍过量的NaOH、BaCl2、Na2CO3溶液,过滤后加入稀盐酸调节溶液为中性( )
×
√
深度思考
1.为检验某种阳离子为Na+的溶液中含有的阴离子是 还是OH-、Cl-,下列设计的方案合理的是________________。
方案一:检验 :向待测液中加入足量的稀盐酸产生气泡,将气体通入澄清石灰水中有白色沉淀生成
方案二:检验 :先向待测液中加入稀盐酸至溶液呈酸性,未见沉淀或气体生成,再加入BaCl2溶液出现白色沉淀
方案三:检验OH-:向待测液中加入石蕊溶液,溶液变蓝色
方案四:检验Cl-:向待测溶液中依次加入稀盐酸和AgNO3溶液,有白色沉淀生成
方案二、方案三
2.如何设计实验证明在空气中放置的Na2SO3晶体部分被氧化?
提示 取适量晶体于洁净的试管中,加入足量的稀盐酸溶解,产生刺激性气味的气体,再向所得溶液中滴加氯化钡溶液有白色沉淀产生,证明Na2SO3晶体部分被氧化。
2.关于浓H2SO4与Cu反应的叙述正确的是
A.在反应中,浓H2SO4只表现出氧化性
B.此反应属于复分解反应
C.在反应中,浓H2SO4既表现出氧化性,又表现出酸性
D.每1 mol铜参加反应就有2 mol H2SO4被还原,同时生成2 mol SO2
√
4.如图所示的实验装置中,从实验开始到过一段时间后,对观察到的实验现象叙述不正确的是
A.甲中苹果块会变干瘪
B.乙中胆矾晶体表面有“白斑”
C.丙中小试管内有晶体析出
D.丁中pH试纸变成红色
√
1.高沸点——制取挥发性酸
2.吸水性——做干燥剂
3.脱水性——做催化剂
4.酸性——去金属表面的氧化物、制取硫酸盐、制造化肥
5.强氧化性——制炸药
三、硫酸的用途——化学工业之母
人教版必修(第二册)
第五章 化学生产中的重要非金属元素
第一节 硫及其化合物
第2课时——硫 酸
一、工业制硫酸
H2O+SO3=H2SO4
△
4FeS2 + 11O2 == 2Fe2O3 + 8SO2
△
思考与讨论1:根据上面关于工业制硫酸的介绍,能否写出相关的化学反应方程式。
一、工业制硫酸
问题1:根据标签信息求该硫酸的物质的量浓度?已知该硫酸的质量分数为98.08%
(一) 物理性质
无色
油状液体
338℃
难挥发
比水大
与水任意比混溶, 稀释时释放大量热
1.颜色:
2.状态:
3.沸点:
4.密度:
5.水溶性:
二、浓硫酸的性质
思考与讨论2:稀释浓硫酸时应该如何操作
稀硫酸
完全电离
H2SO4=2H++SO42-
酸的通性
浓度增大
浓硫酸
主要以
分子形式存在
H2SO4
自身特性
二、浓硫酸的性质
蓝色晶体变为白色粉末
现象:
原理:
(二) 化学性质
实验1:
① 2支试管各加入2 mL浓硫酸, 其一敞开久置, 另一密封保存, 观察;
② 向试管中加入少量的胆矾, 再加入2 mL浓硫酸, 观察.
敞口试管溶液体积较密封增大
二、浓硫酸的性质
指浓硫酸具有吸收游离水的性质
(1) 游离水包括: 结晶水、水蒸气;
(2) 吸水本质: nH2O+H2SO4= H2SO4 nH2O;
(3) 吸水放热;
(4) 作某些气体干燥剂。
1、浓硫酸的吸水性:
(二) 化学性质
二、浓硫酸的性质
实验2: 取2g蔗糖放入烧杯中, 滴加几滴水, 搅拌均匀, 然后加入适量浓硫酸, 搅拌, 观察现象。
“黑面包”实验
二、浓硫酸的性质
1.烧杯壁为什么是热的?
3.为什么体积会膨胀?
5.这一过程表现了浓硫酸的什么性质?
4.刺激性气味气体可能含什么?
2.为什么蔗糖会变黑?
浓硫酸吸水放热
蔗糖炭化
有气体生成
脱水性、强氧化性
SO2、CO2
二、浓硫酸的性质
原理:
指浓硫酸能将某些有机物中的H、O原子的组成比(2:1)脱去, 使其炭化的性质。
2.浓硫酸的脱水性:
滴加几滴水的作用
(二) 化学性质
变黑
pH试纸先变红后变黑
思考与讨论3:把少量浓硫酸滴在纸片或火柴梗上,有什么现象?把少量浓硫酸滴在pH试纸上,有什么现象?
二、浓硫酸的性质
蔗糖变黑
放出热量
现象:
产生气体
本质:
脱水性
吸水性
强氧化性
(1) 与非金属单质反应
(例如与C反应)
3. 浓硫酸的强氧化性
(二) 化学性质
二、浓硫酸的性质
3、浓硫酸的强氧化性
【实验5-3】
(二) 化学性质
二、浓硫酸的性质
产生气体, 品红褪色;溶液无色色变成蓝色。试管底部有白色固体生成。
现象:
原理:
说明:
①反应条件:
②浓硫酸显:
(2) 与金属单质反应
浓硫酸, 加热
酸性和强氧化性
(例如与Cu反应)
二、浓硫酸的性质
(1)通过可抽动的铜丝来控制反应的发生或停止。
(2)浸有碱液的棉花团可以吸收多余的SO2,以防止污染环境。
思考与讨论4:回顾刚才的实验,可抽动的铜丝有什么作用?浸有碱液的棉花团有什么作用?
思考与讨论5:
Cu+2H2SO4(浓)
CuSO4+
SO2↑+2H2O
(1) 上述方程式中,谁是氧化剂,谁是还原剂?
(2) 浓硫酸在这个反应中体现了什么性质?
(3) 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
(4)浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
二、浓硫酸的性质
小结:浓硫酸的强氧化性
③与还原性化合物反应,如H2S、HBr等(浓硫酸不能干燥H2S、HBr)
判断正误
(1)可以用稀硫酸洗涤金属表面的氧化物( )
(2)浓硫酸有脱水性,因此可以用于干燥H2、CO2等气体( )
(3)浓硫酸能使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的脱水性( )
(4)金属铜在常温下放入浓硫酸无现象,是浓硫酸把铜钝化了( )
(5)100 mL 18.0 mol·L-1的浓硫酸和足量铜反应生成SO2的分子数目为0.9NA( )
×
√
×
×
×
(6)浓硫酸有强烈的吸水性,因此可以干燥SO2、H2S、HI、NH3等气体( )
(7)蔗糖和浓硫酸的“黑面包”实验中,主要体现了浓硫酸的脱水性和强氧化性( )
√
×
(6)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体____。
应用体验
1.下列各过程主要表现了浓硫酸的哪些性质?请将答案的序号分别填在横线上。
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体___。
③
(2)用磷矿物(主要成分是磷酸钙)和硫酸反应制磷酸_____。
①
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体_______。
(4)常温下可以用铁或铝的容器贮存浓硫酸______。
⑤
②
(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末_____。
⑤
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑______。
②
①④
2.(1)50 mL物质的量浓度为18 mol·L-1的硫酸中加入足量铜片并加热,充分反应,被还原的硫酸_______0.9 mol(填“大于”“等于”或“小于”,下同),消耗铜的物质的量_____0.45 mol。原因是___________________
______________________________。
小于
小于
随着反应的进行,
浓硫酸变稀,稀硫酸不与铜反应
(2)将一定量的锌与100 mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1,则下列叙述正确的是_____(填字母)。
A.气体A为SO2和H2的混合物 B.气体A中SO2和H2的体积比为4∶1
C.反应中共消耗Zn 97.5 g D.反应中共转移3 mol电子
ACD
(2)理论解释
白色
①先加稀盐酸的目的是排除 、 、 等离子的干扰。
②再加入BaCl2溶液,若存在 ,发生反应的离子方程式为
。
Ag+
SO42-检验的正确操作及理解
判断正误
(1)取少量试样溶液,加入用稀盐酸酸化的BaCl2溶液,有白色沉淀生成,则溶液中一定含有 ( )
(2)取少量试样溶液,先加入BaCl2溶液,有白色沉淀生成,再加稀HNO3,沉淀不溶解,则溶液中一定含有 ( )
(3)取少量试样溶液,先加入稀硫酸,无现象,再加入BaCl2,有白色沉淀生成,则溶液中一定含有 ( )
×
×
×
(4)为除去粗盐水中少量的 ,可向溶液中加入过量的K2CO3溶液,然后过滤( )
(5)为除去粗盐中的Mg2+、Ca2+、 ,可依次加入稍过量的NaOH、BaCl2、Na2CO3溶液,过滤后加入稀盐酸调节溶液为中性( )
×
√
深度思考
1.为检验某种阳离子为Na+的溶液中含有的阴离子是 还是OH-、Cl-,下列设计的方案合理的是________________。
方案一:检验 :向待测液中加入足量的稀盐酸产生气泡,将气体通入澄清石灰水中有白色沉淀生成
方案二:检验 :先向待测液中加入稀盐酸至溶液呈酸性,未见沉淀或气体生成,再加入BaCl2溶液出现白色沉淀
方案三:检验OH-:向待测液中加入石蕊溶液,溶液变蓝色
方案四:检验Cl-:向待测溶液中依次加入稀盐酸和AgNO3溶液,有白色沉淀生成
方案二、方案三
2.如何设计实验证明在空气中放置的Na2SO3晶体部分被氧化?
提示 取适量晶体于洁净的试管中,加入足量的稀盐酸溶解,产生刺激性气味的气体,再向所得溶液中滴加氯化钡溶液有白色沉淀产生,证明Na2SO3晶体部分被氧化。
2.关于浓H2SO4与Cu反应的叙述正确的是
A.在反应中,浓H2SO4只表现出氧化性
B.此反应属于复分解反应
C.在反应中,浓H2SO4既表现出氧化性,又表现出酸性
D.每1 mol铜参加反应就有2 mol H2SO4被还原,同时生成2 mol SO2
√
4.如图所示的实验装置中,从实验开始到过一段时间后,对观察到的实验现象叙述不正确的是
A.甲中苹果块会变干瘪
B.乙中胆矾晶体表面有“白斑”
C.丙中小试管内有晶体析出
D.丁中pH试纸变成红色
√
1.高沸点——制取挥发性酸
2.吸水性——做干燥剂
3.脱水性——做催化剂
4.酸性——去金属表面的氧化物、制取硫酸盐、制造化肥
5.强氧化性——制炸药
三、硫酸的用途——化学工业之母
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
