2.1.1共价键课件(共32张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.1共价键课件(共32张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-26 15:06:22 | ||
图片预览






文档简介
(共32张PPT)
高二化学
新人教化学选择性必修2《物质结构与性质》
第二章 分子结构与性质
第一节 共价键
第1课时 共价键
学习目标
1、认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
2、知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
核心素养
1、认识原子间通过原子轨道重叠形成共价键,从微观结构认识分子的产生原因,培养宏观辨识与微观探析的核心素养。
2、根据原子轨道的重叠方式,了解共价键可分为σ键和π键等类型;结合原子轨道的伸展方向,了解共价键具有饱和性和方向性。
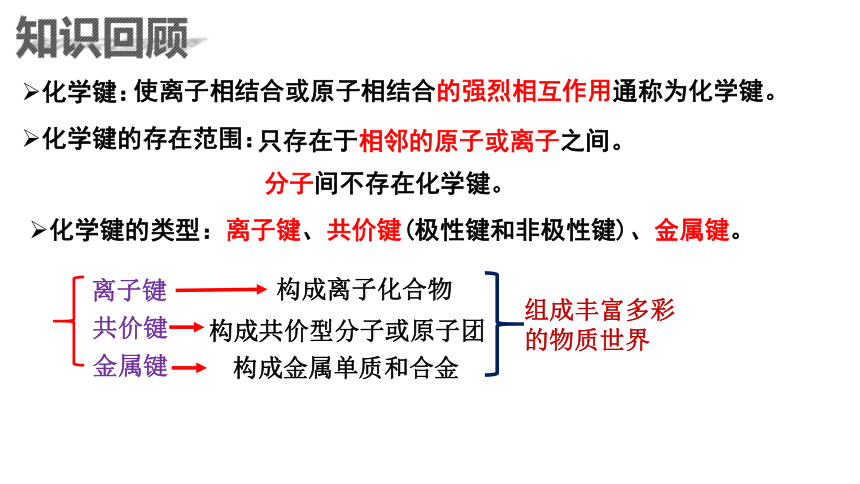
化学键:
知识回顾
化学键的类型:离子键、共价键(极性键和非极性键)、金属键。
化学键的存在范围:
分子间不存在化学键。
离子键
共价键
金属键
构成离子化合物
构成共价型分子或原子团
构成金属单质和合金
组成丰富多彩
的物质世界
使离子相结合或原子相结合的强烈相互作用通称为化学键。
只存在于相邻的原子或离子之间。
H
H
:
:
:
:
Cl
·
:
:
:
Cl
·
+
Na
Na+
:
:
:
:
Cl
·
:
:
:
Cl
·
+
[ ]-
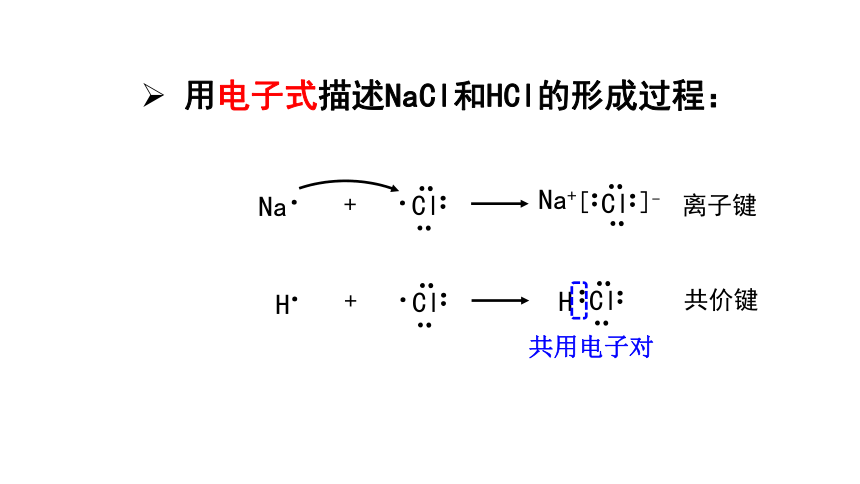
用电子式描述NaCl和HCl的形成过程:
离子键
共价键
共用电子对
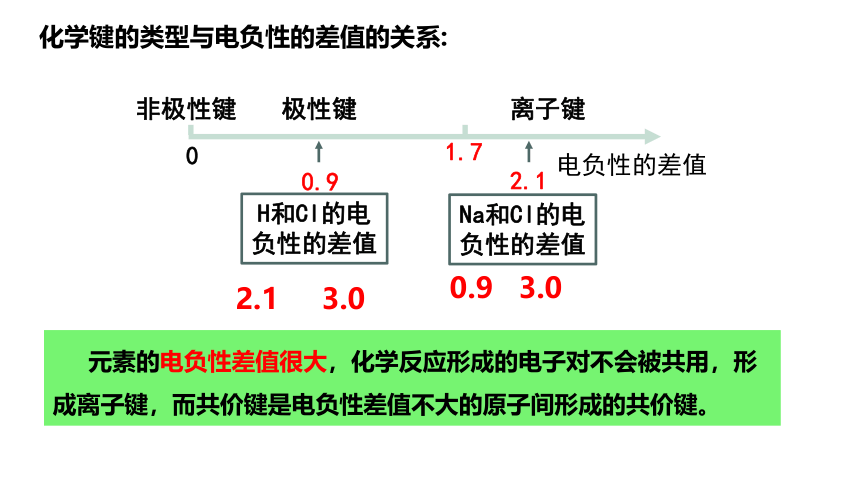
化学键的类型与电负性的差值的关系:
电负性的差值
0
非极性键
极性键
离子键
Na和Cl的电负性的差值
H和Cl的电负性的差值
0.9
2.1
1.7
元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。
0.9 3.0
2.1 3.0
原子间通过共用电子对所形成的强烈相互作用
定义
本质
共价键的本质是原子之间形成共用电子对(或原子轨道的重叠)。自旋方向的未成对电子形成共用电子对。
共价键
(1)成键粒子:原子。
(2)成键实质:共用电子对。
(3)形成条件:一般由非金属元素的原子结合。
【思考与讨论】
H2、HCl、Cl2均通过共用电子对相结合,为什么难以形成H3、H2Cl、Cl3等分子?
由于电子对的共用,H2、HCl、Cl2分子中,各原子核外电子达到饱和。不能再形成H3、H2Cl、Cl3等分子。
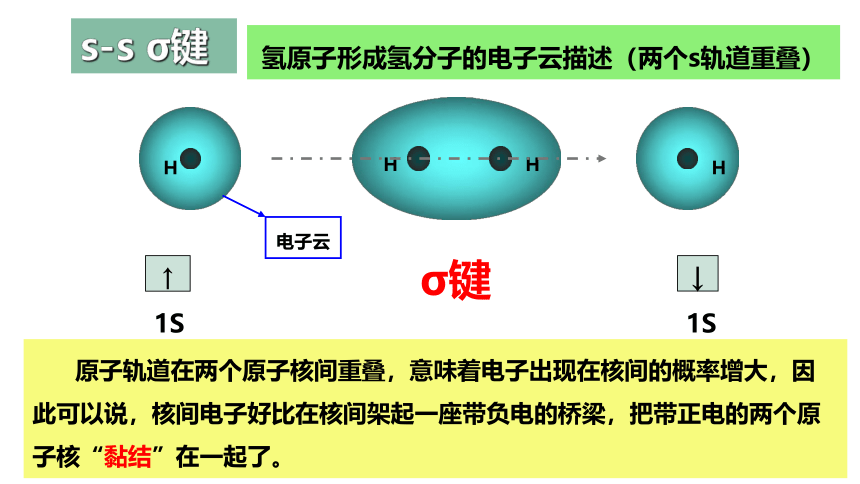
氢原子形成氢分子的过程
H
H
H
H
氢原子形成氢分子的电子云描述(两个s轨道重叠)
σ键
电子云
↑
1S
↓
1S
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,因此可以说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
s-s σ键
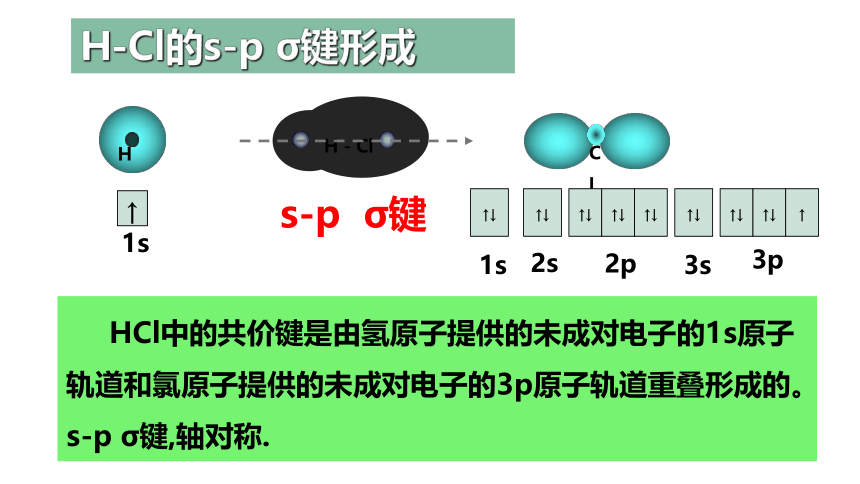
H-Cl的s-p σ键形成
H-Cl的s-p σ键形成
H
Cl
H-Cl
s-p σ键
↑
1s
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
HCl中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道重叠形成的。s-p σ键,轴对称.
Cl-Cl的p-p σ键形成
Cl
Cl
Cl
Cl
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
Cl2中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的。p—p σ键,轴对称.
Cl-Cl的p-p σ键形成
p-p σ键
σ键的重叠方式:“头碰头”
σ键
①概念:σ键是两原子在成键时,原子轨道以“头碰头”的方式
重叠形成的共价键。
②σ键的类型:根据成键时,原子轨道的不同,σ键可分为s-s σ
键、s-p σ键、p-p σ键。
(1)以形成化学键的两原子核的连线为轴作旋转操作,共价键电
子云的图形不变,这种特征称为轴对称。
σ键的特征
(2)形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。
(3)以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,
旋转时并不破坏σ键的结构。
p轨道与p轨道除了能形成σ键外,还能形成π键。
π键的特征是两个原子轨道以平行或“肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧。每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称。
π键
概念:形成共价键的未成对电子的原子轨道,采取“肩并肩”
的方式重叠,这种共价键叫π键,主要类型为p-p π键,
P-P π键的形成过程
π键
(1)每个π键的电子云由两块组成,分别位于由两原子核
构成平面的两侧,如果以它们之间包含原子核的平面
为镜面,它们互为镜像,这种特征称为镜面对称。
π键的特征
(2)形成π键时电子云重叠程度比σ键小,π键不如σ键
牢固。特例:N2分子中的π键比σ键稳定。
(3)以形成π键的两个原子核的连线为轴,任意一个
原子并不能单独旋转,若单独旋转则会破坏π键,
如以py-py π键为例,若旋转其中一个成键原子,
则两原子的py轨道不再平行,也就无法“肩并肩”
地靠近形成π键。
π键的特征
N2中1个p-p σ键和2个p-p π键的形成过程
↑ ↑ ↑
2P3轨道
π键的形成过程
O2 中 p-p σ键和 p-p π键的形成过程
p-p σ键
p-p π键
两队孤对
电子对电子云
↑↓ ↑ ↑
2P4轨道
π键
①s-s电子、s-p电子只形成σ键;p-p电子既形
成σ键,又形成π键;且 p-p电子先形成σ键,
后形成π键。
②共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个是π键。
判断σ键、π键的一般规律
电子所在的原子轨道都具有一定的形状,原子轨道要取得最大重叠决定了共价键必然具有方向性(s-s 轨道重叠形成的共价键无方向性,例外)。
共价键的特征
——决定原子形成分子时相互结合的数量关系
---决定分子的空间结构
——共价键具有饱和性和方向性。
(1)共价键的饱和性
按照共用电子对理论,一个原子有几个未成对电子,便可以与几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
(2)共价键的方向性
例如:只能有H2、HCl、Cl2等,不可能H3、H2Cl和Cl3等
观察下图中乙烷、乙烯和乙炔分子的球棍模型,回答相关问题。
问题思考:
(1)乙烯和乙炔分子中的碳原子间,既存在σ键,又存在π键,σ键和π键的成键方
式有何不同
【思考与讨论】
σ键是原子轨道以“头碰头”方式发生重叠成键;π键是p轨道与p轨道以“肩并肩”方式发生重叠成键。
乙烷、乙烯和乙炔分子中的共价键分别有几个 σ键和几个π键组成?
乙炔分子中由
3个σ键和
2个π键组成。
乙烷分子中由7个σ键组成;
乙烯分子中由
5个σ键和
1个π键组成;
【思考与讨论】
1. C – H 是σ键。
2. C—C 是σ键。
3. C=C 一个σ键,一个π键。
4. C≡C 一个σ键,两个π键。
乙烯、乙炔分子中C—C σ键比较稳定不容易断裂, π键比较容易断裂。
乙烯
乙炔
乙烯、乙炔分子的球棍模型
(3)乙烯和乙炔的化学性质为什么比乙烷活泼
乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。
一、化学键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
特征
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
特征
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
课堂小结
1.正误判断
(1)形成共价键后体系的能量降低,趋于稳定( )
(2)共价键的饱和性是由成键原子的未成对电子数决定的( )
(3)共价键的饱和性决定了分子内部原子的数量关系( )
(4)共价键的方向性是由成键原子轨道的方向性决定的( )
(5)原子轨道在空间都具有方向性( )
√
√
√
√
×
2.下列说法正确的是( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构一样是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
C
【课堂练习】
C
3.下列各组物质中,所有化学键都是共价键的是( )
A.H2S和Na2O2 B.H2O2和CaF2
C.NH3和N2 D.HNO3和NaCl
【课堂练习】
感谢观看!
Thank you!
高二化学
新人教化学选择性必修2《物质结构与性质》
第二章 分子结构与性质
第一节 共价键
第1课时 共价键
学习目标
1、认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
2、知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
核心素养
1、认识原子间通过原子轨道重叠形成共价键,从微观结构认识分子的产生原因,培养宏观辨识与微观探析的核心素养。
2、根据原子轨道的重叠方式,了解共价键可分为σ键和π键等类型;结合原子轨道的伸展方向,了解共价键具有饱和性和方向性。
化学键:
知识回顾
化学键的类型:离子键、共价键(极性键和非极性键)、金属键。
化学键的存在范围:
分子间不存在化学键。
离子键
共价键
金属键
构成离子化合物
构成共价型分子或原子团
构成金属单质和合金
组成丰富多彩
的物质世界
使离子相结合或原子相结合的强烈相互作用通称为化学键。
只存在于相邻的原子或离子之间。
H
H
:
:
:
:
Cl
·
:
:
:
Cl
·
+
Na
Na+
:
:
:
:
Cl
·
:
:
:
Cl
·
+
[ ]-
用电子式描述NaCl和HCl的形成过程:
离子键
共价键
共用电子对
化学键的类型与电负性的差值的关系:
电负性的差值
0
非极性键
极性键
离子键
Na和Cl的电负性的差值
H和Cl的电负性的差值
0.9
2.1
1.7
元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。
0.9 3.0
2.1 3.0
原子间通过共用电子对所形成的强烈相互作用
定义
本质
共价键的本质是原子之间形成共用电子对(或原子轨道的重叠)。自旋方向的未成对电子形成共用电子对。
共价键
(1)成键粒子:原子。
(2)成键实质:共用电子对。
(3)形成条件:一般由非金属元素的原子结合。
【思考与讨论】
H2、HCl、Cl2均通过共用电子对相结合,为什么难以形成H3、H2Cl、Cl3等分子?
由于电子对的共用,H2、HCl、Cl2分子中,各原子核外电子达到饱和。不能再形成H3、H2Cl、Cl3等分子。
氢原子形成氢分子的过程
H
H
H
H
氢原子形成氢分子的电子云描述(两个s轨道重叠)
σ键
电子云
↑
1S
↓
1S
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,因此可以说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
s-s σ键
H-Cl的s-p σ键形成
H-Cl的s-p σ键形成
H
Cl
H-Cl
s-p σ键
↑
1s
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
HCl中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道重叠形成的。s-p σ键,轴对称.
Cl-Cl的p-p σ键形成
Cl
Cl
Cl
Cl
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
Cl2中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的。p—p σ键,轴对称.
Cl-Cl的p-p σ键形成
p-p σ键
σ键的重叠方式:“头碰头”
σ键
①概念:σ键是两原子在成键时,原子轨道以“头碰头”的方式
重叠形成的共价键。
②σ键的类型:根据成键时,原子轨道的不同,σ键可分为s-s σ
键、s-p σ键、p-p σ键。
(1)以形成化学键的两原子核的连线为轴作旋转操作,共价键电
子云的图形不变,这种特征称为轴对称。
σ键的特征
(2)形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。
(3)以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,
旋转时并不破坏σ键的结构。
p轨道与p轨道除了能形成σ键外,还能形成π键。
π键的特征是两个原子轨道以平行或“肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧。每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称。
π键
概念:形成共价键的未成对电子的原子轨道,采取“肩并肩”
的方式重叠,这种共价键叫π键,主要类型为p-p π键,
P-P π键的形成过程
π键
(1)每个π键的电子云由两块组成,分别位于由两原子核
构成平面的两侧,如果以它们之间包含原子核的平面
为镜面,它们互为镜像,这种特征称为镜面对称。
π键的特征
(2)形成π键时电子云重叠程度比σ键小,π键不如σ键
牢固。特例:N2分子中的π键比σ键稳定。
(3)以形成π键的两个原子核的连线为轴,任意一个
原子并不能单独旋转,若单独旋转则会破坏π键,
如以py-py π键为例,若旋转其中一个成键原子,
则两原子的py轨道不再平行,也就无法“肩并肩”
地靠近形成π键。
π键的特征
N2中1个p-p σ键和2个p-p π键的形成过程
↑ ↑ ↑
2P3轨道
π键的形成过程
O2 中 p-p σ键和 p-p π键的形成过程
p-p σ键
p-p π键
两队孤对
电子对电子云
↑↓ ↑ ↑
2P4轨道
π键
①s-s电子、s-p电子只形成σ键;p-p电子既形
成σ键,又形成π键;且 p-p电子先形成σ键,
后形成π键。
②共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个是π键。
判断σ键、π键的一般规律
电子所在的原子轨道都具有一定的形状,原子轨道要取得最大重叠决定了共价键必然具有方向性(s-s 轨道重叠形成的共价键无方向性,例外)。
共价键的特征
——决定原子形成分子时相互结合的数量关系
---决定分子的空间结构
——共价键具有饱和性和方向性。
(1)共价键的饱和性
按照共用电子对理论,一个原子有几个未成对电子,便可以与几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
(2)共价键的方向性
例如:只能有H2、HCl、Cl2等,不可能H3、H2Cl和Cl3等
观察下图中乙烷、乙烯和乙炔分子的球棍模型,回答相关问题。
问题思考:
(1)乙烯和乙炔分子中的碳原子间,既存在σ键,又存在π键,σ键和π键的成键方
式有何不同
【思考与讨论】
σ键是原子轨道以“头碰头”方式发生重叠成键;π键是p轨道与p轨道以“肩并肩”方式发生重叠成键。
乙烷、乙烯和乙炔分子中的共价键分别有几个 σ键和几个π键组成?
乙炔分子中由
3个σ键和
2个π键组成。
乙烷分子中由7个σ键组成;
乙烯分子中由
5个σ键和
1个π键组成;
【思考与讨论】
1. C – H 是σ键。
2. C—C 是σ键。
3. C=C 一个σ键,一个π键。
4. C≡C 一个σ键,两个π键。
乙烯、乙炔分子中C—C σ键比较稳定不容易断裂, π键比较容易断裂。
乙烯
乙炔
乙烯、乙炔分子的球棍模型
(3)乙烯和乙炔的化学性质为什么比乙烷活泼
乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。
一、化学键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
特征
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
特征
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
课堂小结
1.正误判断
(1)形成共价键后体系的能量降低,趋于稳定( )
(2)共价键的饱和性是由成键原子的未成对电子数决定的( )
(3)共价键的饱和性决定了分子内部原子的数量关系( )
(4)共价键的方向性是由成键原子轨道的方向性决定的( )
(5)原子轨道在空间都具有方向性( )
√
√
√
√
×
2.下列说法正确的是( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构一样是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
C
【课堂练习】
C
3.下列各组物质中,所有化学键都是共价键的是( )
A.H2S和Na2O2 B.H2O2和CaF2
C.NH3和N2 D.HNO3和NaCl
【课堂练习】
感谢观看!
Thank you!
