5.2-2氨气 课件 2022-2023学年高一下学期化学人教版(2019)必修第二册(共23张PPT)
文档属性
| 名称 | 5.2-2氨气 课件 2022-2023学年高一下学期化学人教版(2019)必修第二册(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-24 11:17:31 | ||
图片预览






文档简介
(共23张PPT)
第二节 氮及氮的化合物
(第2课时 氨气)
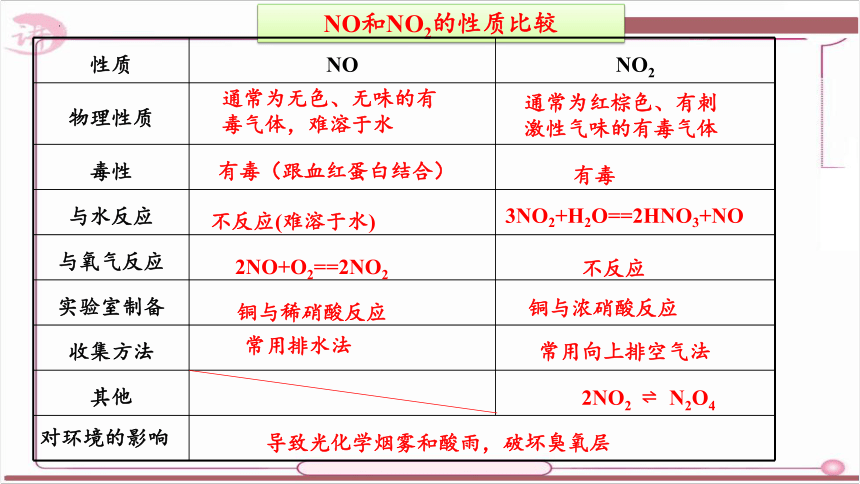
NO和NO2的性质比较
性质 NO NO2
物理性质
毒性
与水反应
与氧气反应
实验室制备
收集方法
其他
对环境的影响
通常为无色、无味的有毒气体,难溶于水
通常为红棕色、有刺激性气味的有毒气体
不反应(难溶于水)
3NO2+H2O==2HNO3+NO
2NO+O2==2NO2
不反应
铜与稀硝酸反应
铜与浓硝酸反应
常用排水法
常用向上排空气法
2NO2 N2O4
导致光化学烟雾和酸雨,破坏臭氧层
有毒(跟血红蛋白结合)
有毒
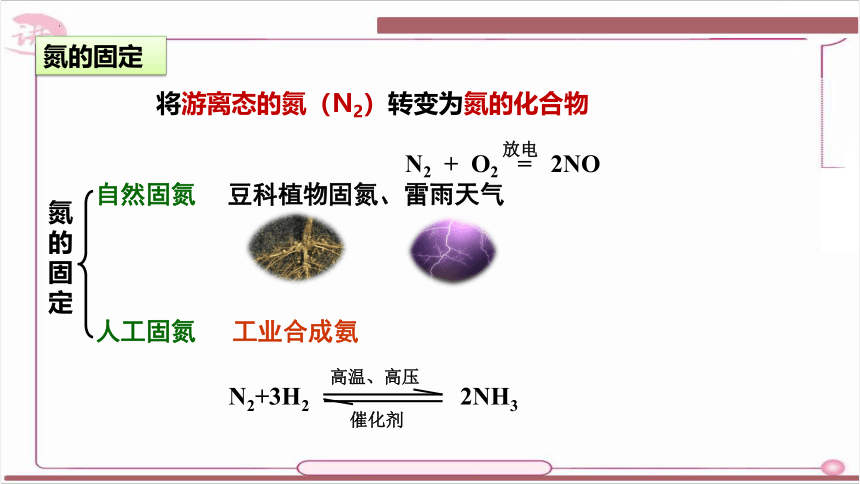
氮的固定
将游离态的氮(N2)转变为氮的化合物
豆科植物固氮、雷雨天气
人工固氮
氮
的
固
定
自然固氮
工业合成氨
N2 + O2 = 2NO
放电
N2+3H2 2NH3
高温、高压
催化剂
知识与技能
1
了解氨的物理性质、化学性质。
3
掌握铵盐的化学性质。
4
掌握铵根离子的检验方法。
2
掌握氨的实验室制法。
2004年4月20日上午10时,杭州市一制冷车间发生氨气泄漏事件,整个厂区是白茫茫的一片,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。厂区内寒气逼人。市消防中心接到报案后立即制定方案,出动上百名消防队员,十余量消防车……
【新闻案件】
杭州市一制冷车间
发生氨气泄漏
【思考】
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能不吸入氨气?
有关氨的研究曾三次获得诺贝尔化学奖
格哈德·埃特尔2007年
弗里茨·哈伯
(合成氨之父)
卡尔·博施
1918 年
1931 年
从1997年和2000年起,担任我国大连化物所《催化学报》顾问和催化基础国家重点实验室国际顾问。
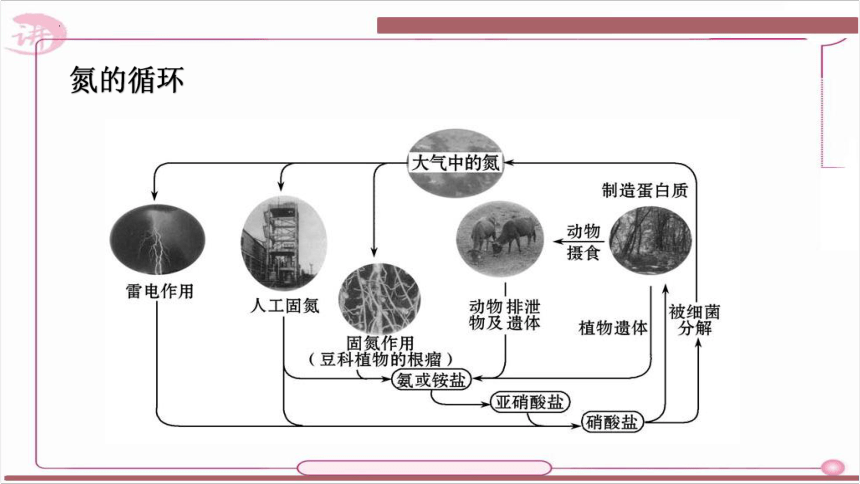
大气的主要成分是什么?
N2
NH3
尿素及动植物遗体
土壤中的微生物
氮素化肥
NO3-
氮气,不能被多数生物直接吸收,多数生物只能吸收含氮元素的化合物。
氮的固定
氮的循环
(一)氨的物理性质
无色、有剌激性气味的气体,比空气轻,极易溶于水(1:700),氨易液化(沸点-33. 35 ℃) ----常作致冷剂
一、氨
氨(沸点-33. 35 ℃)
氯气(沸点-34. 6 ℃)
二氧化硫(沸点-10 ℃)
思考:有哪些物质可作制冷剂?
氨气
液氨
易液化(放出大量热)
汽化(吸收大量热)
(作制冷剂)
--氨气的喷泉实验
实验4-8:演示实验
氨气
酚酞溶液
水由玻璃导管尖嘴喷出,形成喷泉,瓶内液体呈红色。
①先打开止水夹;
②再挤出胶头滴管中的水
氨气极易溶于水(1:700),所得溶液叫“氨水”;氨水呈碱性。
操作:
现象:
结论:
原因:
当滴管中的水挤入到烧瓶中时,烧瓶内的氨溶解,使瓶内压强迅速降低,瓶外的空气将烧杯内的溶液很快压入到烧瓶,形成喷泉。
(二)氨气的化学性质
催化氧化
NH3
与H2O反应
与酸反应
分子 :NH3·H2O 、 NH3 、 H2O
离子: NH4+ 、 OH- 、 H+(极少量)
NH3+H2O NH3·H2O
(一水合氨)
1、与水反应
氨水显碱性的原理
部分电离:NH3·H2O NH4++OH-
成分:
(3种分子、3种离子)
使酚酞溶液变红色或红色石蕊试纸变蓝
2、氨与酸反应
NH3+HCl=NH4Cl
沾有浓盐酸的玻棒
沾有浓氨水的玻棒
HCl
NH3
NH4Cl
书p98页(图4-28)
使两根分别蘸有浓氨水和浓盐酸的玻璃棒接近(不要接触)
步骤:
两根玻璃棒靠近时产生大量白烟。
现 象:
氨水挥发的NH3与盐酸挥发的HCl生成固体小颗粒NH4Cl的缘故
结 论:
方程式:
空瓶生烟
挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;难挥发性酸H2SO4、H3PO4无此现象。
NH3 能不能用浓硫酸干燥?
3、氨的催化氧化
【思考】哪些酸可与氨气产生空瓶生白烟的实验?
N2
NH3
O2
NO
O2
NO2
H2O
HNO3
思考与交流:氨经一系列反应可以得到硝酸,如下图所示
1、试写出以下每一步转化的反应方程式。
2、分析上述每一步反应中氮元素化合价的变化,指出氮元素发生的是氧化反应还是还原反应。
H2
4、氨的用途
①工业制化肥
②有机合成的重要化工原料
③作制冷剂
二、氨的制备
(一)氨的工业制备
N2 +3 H2 2NH3
高温高压
催化剂
3、装置:
固+固加热型
4、收集:
向下排空气法
5、验满:
(与氧气的制取装置相同)
1、药品:
氯化铵晶体、消石灰固体
2、原理:
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
(二)氨的实验室制法
将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,说明氨气已集满。
6、尾气吸收:
浓硫酸吸收多余的氨气.
——装置:倒扣漏斗(防止倒吸)
7、干燥装置:
CaO、碱石灰等碱性干燥剂
NH4+的检验:
加热时,能与碱液反应产生使湿润的红色石蕊试纸变蓝的气体的物质一定是铵盐
棉花的作用:
防止对流,提高集气速度和纯度。
干燥氨气的常用试剂:
CaO、碱石灰等碱性干燥剂
实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法
(装置与实验室制氯气的发生装置相同)
NaOH和CaO的混合物
思考:
②浓氨水加碱石灰法
(碱石灰吸水、溶解时放热)
CaO
浓氨水
NH3·H2O===H2O+NH3↑
△
三 、铵盐
由NH4+和酸根离子组成的化合物叫铵盐
铵盐都易溶于水(了解:溶于水时水温降低。)
(1)热不稳定性:受热易分解
2、化学性质:
注意:NH4Cl受热分解,产物冷却又生成NH4Cl
注意:不是所有的铵盐受热分解都生成氨气;像NH4NO3生成N2.
(NH4)2CO3 = 2NH3 ↑ + H2O + CO2 ↑
△
1、物理性质:
(2)与碱反应
(NH4)2SO4 + 2NaOH == Na2SO4 + 2NH3↑+ 2H2O
△
NH4NO3 + NaOH == NaNO3 + NH3↑+ H2O
△
——生成氨气 +H2O
原理:
讨论: NH4+的检验
(1)取少许样品于试管中,向样品中加入碱溶液,加热,若放出的气体能使湿润的红色石蕊试纸变蓝,证明含NH4+。
(2)取少许样品于试管中,加入碱后加热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+.
操作:
利用与碱的反应检验NH4+离子的存在
[练习1]下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
A、C
第二节 氮及氮的化合物
(第2课时 氨气)
NO和NO2的性质比较
性质 NO NO2
物理性质
毒性
与水反应
与氧气反应
实验室制备
收集方法
其他
对环境的影响
通常为无色、无味的有毒气体,难溶于水
通常为红棕色、有刺激性气味的有毒气体
不反应(难溶于水)
3NO2+H2O==2HNO3+NO
2NO+O2==2NO2
不反应
铜与稀硝酸反应
铜与浓硝酸反应
常用排水法
常用向上排空气法
2NO2 N2O4
导致光化学烟雾和酸雨,破坏臭氧层
有毒(跟血红蛋白结合)
有毒
氮的固定
将游离态的氮(N2)转变为氮的化合物
豆科植物固氮、雷雨天气
人工固氮
氮
的
固
定
自然固氮
工业合成氨
N2 + O2 = 2NO
放电
N2+3H2 2NH3
高温、高压
催化剂
知识与技能
1
了解氨的物理性质、化学性质。
3
掌握铵盐的化学性质。
4
掌握铵根离子的检验方法。
2
掌握氨的实验室制法。
2004年4月20日上午10时,杭州市一制冷车间发生氨气泄漏事件,整个厂区是白茫茫的一片,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。厂区内寒气逼人。市消防中心接到报案后立即制定方案,出动上百名消防队员,十余量消防车……
【新闻案件】
杭州市一制冷车间
发生氨气泄漏
【思考】
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能不吸入氨气?
有关氨的研究曾三次获得诺贝尔化学奖
格哈德·埃特尔2007年
弗里茨·哈伯
(合成氨之父)
卡尔·博施
1918 年
1931 年
从1997年和2000年起,担任我国大连化物所《催化学报》顾问和催化基础国家重点实验室国际顾问。
大气的主要成分是什么?
N2
NH3
尿素及动植物遗体
土壤中的微生物
氮素化肥
NO3-
氮气,不能被多数生物直接吸收,多数生物只能吸收含氮元素的化合物。
氮的固定
氮的循环
(一)氨的物理性质
无色、有剌激性气味的气体,比空气轻,极易溶于水(1:700),氨易液化(沸点-33. 35 ℃) ----常作致冷剂
一、氨
氨(沸点-33. 35 ℃)
氯气(沸点-34. 6 ℃)
二氧化硫(沸点-10 ℃)
思考:有哪些物质可作制冷剂?
氨气
液氨
易液化(放出大量热)
汽化(吸收大量热)
(作制冷剂)
--氨气的喷泉实验
实验4-8:演示实验
氨气
酚酞溶液
水由玻璃导管尖嘴喷出,形成喷泉,瓶内液体呈红色。
①先打开止水夹;
②再挤出胶头滴管中的水
氨气极易溶于水(1:700),所得溶液叫“氨水”;氨水呈碱性。
操作:
现象:
结论:
原因:
当滴管中的水挤入到烧瓶中时,烧瓶内的氨溶解,使瓶内压强迅速降低,瓶外的空气将烧杯内的溶液很快压入到烧瓶,形成喷泉。
(二)氨气的化学性质
催化氧化
NH3
与H2O反应
与酸反应
分子 :NH3·H2O 、 NH3 、 H2O
离子: NH4+ 、 OH- 、 H+(极少量)
NH3+H2O NH3·H2O
(一水合氨)
1、与水反应
氨水显碱性的原理
部分电离:NH3·H2O NH4++OH-
成分:
(3种分子、3种离子)
使酚酞溶液变红色或红色石蕊试纸变蓝
2、氨与酸反应
NH3+HCl=NH4Cl
沾有浓盐酸的玻棒
沾有浓氨水的玻棒
HCl
NH3
NH4Cl
书p98页(图4-28)
使两根分别蘸有浓氨水和浓盐酸的玻璃棒接近(不要接触)
步骤:
两根玻璃棒靠近时产生大量白烟。
现 象:
氨水挥发的NH3与盐酸挥发的HCl生成固体小颗粒NH4Cl的缘故
结 论:
方程式:
空瓶生烟
挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;难挥发性酸H2SO4、H3PO4无此现象。
NH3 能不能用浓硫酸干燥?
3、氨的催化氧化
【思考】哪些酸可与氨气产生空瓶生白烟的实验?
N2
NH3
O2
NO
O2
NO2
H2O
HNO3
思考与交流:氨经一系列反应可以得到硝酸,如下图所示
1、试写出以下每一步转化的反应方程式。
2、分析上述每一步反应中氮元素化合价的变化,指出氮元素发生的是氧化反应还是还原反应。
H2
4、氨的用途
①工业制化肥
②有机合成的重要化工原料
③作制冷剂
二、氨的制备
(一)氨的工业制备
N2 +3 H2 2NH3
高温高压
催化剂
3、装置:
固+固加热型
4、收集:
向下排空气法
5、验满:
(与氧气的制取装置相同)
1、药品:
氯化铵晶体、消石灰固体
2、原理:
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
(二)氨的实验室制法
将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,说明氨气已集满。
6、尾气吸收:
浓硫酸吸收多余的氨气.
——装置:倒扣漏斗(防止倒吸)
7、干燥装置:
CaO、碱石灰等碱性干燥剂
NH4+的检验:
加热时,能与碱液反应产生使湿润的红色石蕊试纸变蓝的气体的物质一定是铵盐
棉花的作用:
防止对流,提高集气速度和纯度。
干燥氨气的常用试剂:
CaO、碱石灰等碱性干燥剂
实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法
(装置与实验室制氯气的发生装置相同)
NaOH和CaO的混合物
思考:
②浓氨水加碱石灰法
(碱石灰吸水、溶解时放热)
CaO
浓氨水
NH3·H2O===H2O+NH3↑
△
三 、铵盐
由NH4+和酸根离子组成的化合物叫铵盐
铵盐都易溶于水(了解:溶于水时水温降低。)
(1)热不稳定性:受热易分解
2、化学性质:
注意:NH4Cl受热分解,产物冷却又生成NH4Cl
注意:不是所有的铵盐受热分解都生成氨气;像NH4NO3生成N2.
(NH4)2CO3 = 2NH3 ↑ + H2O + CO2 ↑
△
1、物理性质:
(2)与碱反应
(NH4)2SO4 + 2NaOH == Na2SO4 + 2NH3↑+ 2H2O
△
NH4NO3 + NaOH == NaNO3 + NH3↑+ H2O
△
——生成氨气 +H2O
原理:
讨论: NH4+的检验
(1)取少许样品于试管中,向样品中加入碱溶液,加热,若放出的气体能使湿润的红色石蕊试纸变蓝,证明含NH4+。
(2)取少许样品于试管中,加入碱后加热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+.
操作:
利用与碱的反应检验NH4+离子的存在
[练习1]下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
A、C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
