3.3金属晶体与离子晶体(共13张PPT)2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.3金属晶体与离子晶体(共13张PPT)2022-2023学年高二下学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 61.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-24 11:18:52 | ||
图片预览





文档简介
(共13张PPT)
(第一课时 金属晶体与离子晶体)
第三节 金属晶体与离子晶体
在金属晶体中,原子就像很多硬球一层一层紧密堆积,每一个金属原子的周围有较多的原子围绕着,所以金属晶体中不存在单个分子或原子,一般用化学式表示金属晶体
一、金属键与金属晶体
金属晶体
概念:原子间通过金属键相互结合形成的晶体
构成粒子:
金属阳离子和自由电子
存在作用力:
金属键
①金属晶体熔化时破坏金属键
②金属晶体无分子式
常见的金属晶体:金属单质(除晶体锗、灰锡外)或合金
大多数合金是以一种金属为主要组成。如:以铁为主要成分的碳钢、锰钢、不锈钢等,以铜为主要成分的黄铜、青铜、白铜等
黄铜(铜、锌合金)、青铜(铜锡合金)、白铜(铜、镍合金)
注:常温下汞不属于
金属晶体
铝锂合金用于C919飞机的外壳
国家体育场的钢架结构
铜电缆
应用广泛的金属
问题1:金属有哪些通性
金属物理性质
大多金属具有金属光泽、较好的导电性、导热性、延展性等
问题:2:金属的这些通性与什么有关
①自由电子不是专属于某个特定的金属阳离子,
而是形成“电子气”,被所有原子共用
金属键的特征:
②金属键没有方向性和饱和性,且键能差异性较大
成键粒子:
金属阳离子、自由电子
金属键
成键本质:
金属阳离子与自由电子之间的强烈的静电作用
“电子气”
“电子气理论”
不同金属晶体,由于金属键键能差异大,金属晶体熔沸点和硬度差异很大
如Hg(汞常温下为液态)、W(钨熔点3410℃)
一、金属键与金属晶体
思考2:影响金属键键能强弱的因素有哪些?
金属原子的半径
金属的价电子数
金属原子半径越小,价电子数越多,金属键越强,金属晶体的熔沸点越高
Al>Mg>Na
练习1:试比较Na、Mg、Al三种金属晶体的熔沸点大小
问题3:如何用“电子气理论”解释金属的通性?
例1:试比较Li、Na、K、Rb、Cs三种金属晶体的熔沸点大小
“电子气理论”解释金属的物理性质
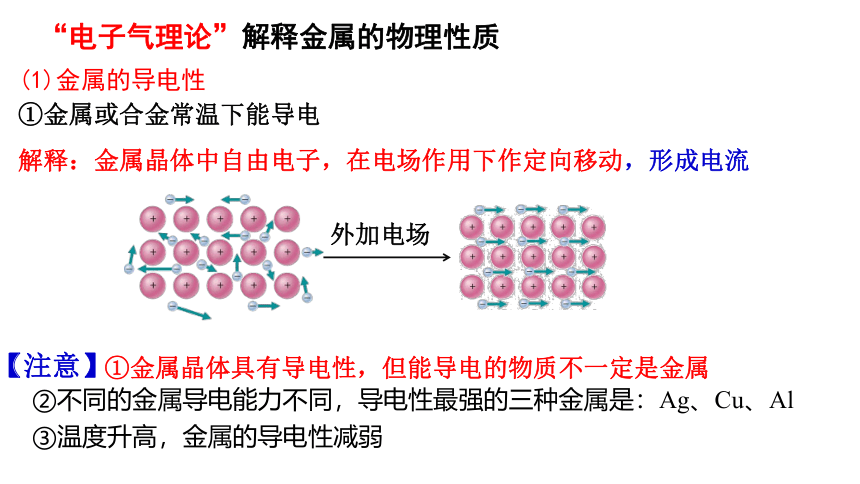
(1)金属的导电性
①金属或合金常温下能导电
解释:金属晶体中自由电子,在电场作用下作定向移动,形成电流
外加电场
①金属晶体具有导电性,但能导电的物质不一定是金属
②不同的金属导电能力不同,导电性最强的三种金属是:Ag、Cu、Al
【注意】
③温度升高,金属的导电性减弱
“电子气理论”解释金属的物理性质
(2)金属或合金的导热性很好
自由电子运动时会与金属离子相互碰撞的过程中发生能量交换。当金属的某一端受热时,该区域获得能量的电子会向别处运动并发生碰撞,将能量从温度高的区域迅速的传递到温度低的区域,最后使整块金属的温度趋于一致。
(3)金属的延展性很好 P86
外力
当金属受到外力作用时,电子气可以起到类似轴承中滚珠之间润滑剂的作用,晶体中的各原子层会发生相对滑动,但原来的排列方式不变,电子气也没有被破坏,
注:熔融状态下,金属具
有流动性无延展性
“电子气理论”解释金属的物理性质
金属材料形成合金以后性能会发生改变,这是为什么?
提示:当向金属晶体中掺入不同的金属或非金属原子(形成合金)时,就像在滚珠之间掺入了细小而坚硬的沙土或碎石一样,会使这种金属的延展性(变差)、熔点(变低)、硬度(增大)等发生改变。
[拓展提升]
(4)金属大多有特殊的金属光泽
金属晶体内部存在自由电子,当光线投射到金属表面时,自由电子吸收可见光,然后又把各种波长的光大部分再反射出来,使绝大多数金属呈现银灰色或银白色光泽。
金属在粉末状态时,金属原子的取向杂乱,排列不规则,吸收可见光后反射不出去,所以金属粉末常呈暗灰色或黑色
思考3:金属粉末常呈暗灰色或黑色,为什么呢?
二、离子键与离子晶体
离子晶体
概念:由阴离子和阳离子相互作用(离子键)而形成的晶体
无单个分子存在;
构成粒子:
存在作用力:
阳离子和阴离子构成,有的还存在电中性的分子(如H2O、NH3等)。阳离子或阴离子不仅指单原子离子,还包括复杂离子,如NH4+、SO42-
一定含离子键(可能含有共价键、氢键等)
①离子晶体熔化时离子键
②离子晶体无分子式
强碱、活泼金属的氧化物和过氧化物、大多数盐
常见的离子晶体(含离子键的化合物)
离子晶体的物理性质
①熔沸点较高 ②硬度较大 ③水溶液或者熔融状态下导电
二、离子键与离子晶体
离子键 概念:阴阳离子间通过静电作用所形成的强烈的相互作用
成键粒子:
键的本质:
特征:离子键没有方向性和饱和性
影响因素:
一般说来,电荷数越多,离子半径越小,离子键越强
阴阳离子
静电作用(包括静电引力和斥力)
阴、阳离子的电荷数、离子半径
NaCl晶体结构(化学式的由来)
每个晶胞含钠离子和氯离子的个数:
钠离子和氯离子的个数比为
4、4
1:1
二、离子键与离子晶体
NaCl晶胞
每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
6
12
6
12
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
配位数:一个离子周围最邻近的
异电性离子的数目
Na+
Cl-
若晶胞参数为a pm,则氯化钠晶体的密度为_________________________g·cm-3
234/ (a*10-10)3·NA
Cs+的配位数为 ;Cl-的配位数为 。
每个晶胞中所含铯离子:1个 氯离子:1个
Cl-
Cs+
8
8
CsCl晶体结构(化学式的由来)
二、离子键与离子晶体
若晶胞参数为a pm,则CsCl晶体的密度为_________________________g·cm-3
1pm=10-10cm
168.5/ (a*10-10)3·NA
(第一课时 金属晶体与离子晶体)
第三节 金属晶体与离子晶体
在金属晶体中,原子就像很多硬球一层一层紧密堆积,每一个金属原子的周围有较多的原子围绕着,所以金属晶体中不存在单个分子或原子,一般用化学式表示金属晶体
一、金属键与金属晶体
金属晶体
概念:原子间通过金属键相互结合形成的晶体
构成粒子:
金属阳离子和自由电子
存在作用力:
金属键
①金属晶体熔化时破坏金属键
②金属晶体无分子式
常见的金属晶体:金属单质(除晶体锗、灰锡外)或合金
大多数合金是以一种金属为主要组成。如:以铁为主要成分的碳钢、锰钢、不锈钢等,以铜为主要成分的黄铜、青铜、白铜等
黄铜(铜、锌合金)、青铜(铜锡合金)、白铜(铜、镍合金)
注:常温下汞不属于
金属晶体
铝锂合金用于C919飞机的外壳
国家体育场的钢架结构
铜电缆
应用广泛的金属
问题1:金属有哪些通性
金属物理性质
大多金属具有金属光泽、较好的导电性、导热性、延展性等
问题:2:金属的这些通性与什么有关
①自由电子不是专属于某个特定的金属阳离子,
而是形成“电子气”,被所有原子共用
金属键的特征:
②金属键没有方向性和饱和性,且键能差异性较大
成键粒子:
金属阳离子、自由电子
金属键
成键本质:
金属阳离子与自由电子之间的强烈的静电作用
“电子气”
“电子气理论”
不同金属晶体,由于金属键键能差异大,金属晶体熔沸点和硬度差异很大
如Hg(汞常温下为液态)、W(钨熔点3410℃)
一、金属键与金属晶体
思考2:影响金属键键能强弱的因素有哪些?
金属原子的半径
金属的价电子数
金属原子半径越小,价电子数越多,金属键越强,金属晶体的熔沸点越高
Al>Mg>Na
练习1:试比较Na、Mg、Al三种金属晶体的熔沸点大小
问题3:如何用“电子气理论”解释金属的通性?
例1:试比较Li、Na、K、Rb、Cs三种金属晶体的熔沸点大小
“电子气理论”解释金属的物理性质
(1)金属的导电性
①金属或合金常温下能导电
解释:金属晶体中自由电子,在电场作用下作定向移动,形成电流
外加电场
①金属晶体具有导电性,但能导电的物质不一定是金属
②不同的金属导电能力不同,导电性最强的三种金属是:Ag、Cu、Al
【注意】
③温度升高,金属的导电性减弱
“电子气理论”解释金属的物理性质
(2)金属或合金的导热性很好
自由电子运动时会与金属离子相互碰撞的过程中发生能量交换。当金属的某一端受热时,该区域获得能量的电子会向别处运动并发生碰撞,将能量从温度高的区域迅速的传递到温度低的区域,最后使整块金属的温度趋于一致。
(3)金属的延展性很好 P86
外力
当金属受到外力作用时,电子气可以起到类似轴承中滚珠之间润滑剂的作用,晶体中的各原子层会发生相对滑动,但原来的排列方式不变,电子气也没有被破坏,
注:熔融状态下,金属具
有流动性无延展性
“电子气理论”解释金属的物理性质
金属材料形成合金以后性能会发生改变,这是为什么?
提示:当向金属晶体中掺入不同的金属或非金属原子(形成合金)时,就像在滚珠之间掺入了细小而坚硬的沙土或碎石一样,会使这种金属的延展性(变差)、熔点(变低)、硬度(增大)等发生改变。
[拓展提升]
(4)金属大多有特殊的金属光泽
金属晶体内部存在自由电子,当光线投射到金属表面时,自由电子吸收可见光,然后又把各种波长的光大部分再反射出来,使绝大多数金属呈现银灰色或银白色光泽。
金属在粉末状态时,金属原子的取向杂乱,排列不规则,吸收可见光后反射不出去,所以金属粉末常呈暗灰色或黑色
思考3:金属粉末常呈暗灰色或黑色,为什么呢?
二、离子键与离子晶体
离子晶体
概念:由阴离子和阳离子相互作用(离子键)而形成的晶体
无单个分子存在;
构成粒子:
存在作用力:
阳离子和阴离子构成,有的还存在电中性的分子(如H2O、NH3等)。阳离子或阴离子不仅指单原子离子,还包括复杂离子,如NH4+、SO42-
一定含离子键(可能含有共价键、氢键等)
①离子晶体熔化时离子键
②离子晶体无分子式
强碱、活泼金属的氧化物和过氧化物、大多数盐
常见的离子晶体(含离子键的化合物)
离子晶体的物理性质
①熔沸点较高 ②硬度较大 ③水溶液或者熔融状态下导电
二、离子键与离子晶体
离子键 概念:阴阳离子间通过静电作用所形成的强烈的相互作用
成键粒子:
键的本质:
特征:离子键没有方向性和饱和性
影响因素:
一般说来,电荷数越多,离子半径越小,离子键越强
阴阳离子
静电作用(包括静电引力和斥力)
阴、阳离子的电荷数、离子半径
NaCl晶体结构(化学式的由来)
每个晶胞含钠离子和氯离子的个数:
钠离子和氯离子的个数比为
4、4
1:1
二、离子键与离子晶体
NaCl晶胞
每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
6
12
6
12
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
配位数:一个离子周围最邻近的
异电性离子的数目
Na+
Cl-
若晶胞参数为a pm,则氯化钠晶体的密度为_________________________g·cm-3
234/ (a*10-10)3·NA
Cs+的配位数为 ;Cl-的配位数为 。
每个晶胞中所含铯离子:1个 氯离子:1个
Cl-
Cs+
8
8
CsCl晶体结构(化学式的由来)
二、离子键与离子晶体
若晶胞参数为a pm,则CsCl晶体的密度为_________________________g·cm-3
1pm=10-10cm
168.5/ (a*10-10)3·NA
