人教版九年级化学下册第10单元课题1《常见的酸和碱》(第2课时)(课件23页)
文档属性
| 名称 | 人教版九年级化学下册第10单元课题1《常见的酸和碱》(第2课时)(课件23页) |  | |
| 格式 | pptx | ||
| 文件大小 | 41.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-26 22:45:03 | ||
图片预览








文档简介
(共23张PPT)
常见的酸和碱
第2课时 浓硫酸的腐蚀性 酸的化学性质
1.浓硫酸、浓硫酸的物理性质
复习回顾
(1)打开盛有浓盐酸的试剂瓶后,观察到瓶口出现白雾,这是因为浓盐酸具有_______
(2)浓硫酸可作气体干燥剂,这是因为浓硫酸具有____
挥发性
吸水性
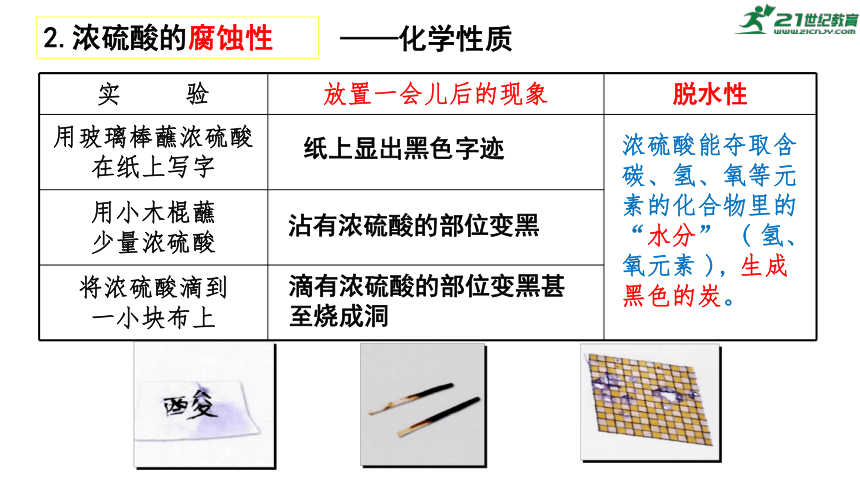
2.浓硫酸的腐蚀性
2.浓硫酸的腐蚀性
实 验 放置一会儿后的现象 脱水性
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸 少量浓硫酸 将浓硫酸滴到 一小块布上 浓硫酸能夺取含碳、氢、氧等元素的化合物里的“水分” ( 氢、氧元素 ), 生成黑色的炭。
纸上显出黑色字迹
沾有浓硫酸的部位变黑
滴有浓硫酸的部位变黑甚至烧成洞
——化学性质
如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理
如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理
应立即用大量水冲洗,然后涂上3%—5%的碳酸氢钠溶液。
用大量的水冲洗。
不要将浓硫酸沾到皮肤上或衣服上!
如何稀释浓硫酸?
是将水注入浓硫酸呢
还是将浓硫酸注入水呢
注意!在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里。
×
酸入水、勤搅拌,杯壁下流
课堂练习
1. 下列叙述正确的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.把鼻孔凑到容器口闻气体的气味
D.稀硫酸沾到皮肤或衣服上,处理无需处理
B
2. 如何鉴别区分浓盐酸和浓硫酸?
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
变红色
变红色
不变色
不变色
结论:酸能与指示剂反应,使石蕊溶液变红,
不能使酚酞溶液变色
酸的化学性质
1、酸与指示剂的反应
2、酸与活泼金属的反应
与稀盐酸反应 与稀硫酸的反应
镁
锌
铁
铜
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
2、酸与活泼金属的反应
制取氢气
讨论:这些反应的生成物有什么共同之处?
回顾下利用盐酸可以制取什么气体?
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
石灰石
(主要成分CaCO3)
稀盐酸
(溶质为HCl)
盐酸与硫酸用于金属表面除锈。
⒊ 酸溶液能与金属氧化物反应:
现 象 化学方程式
铁锈+ 稀盐酸
铁锈+ 稀硫酸
铁锈消失,铁钉变得光亮,溶液由无色变为黄色
讨论:这些反应的生成物有什么共同之处?
Fe2O3+6HCl=2FeCl3+3H2O
+3
+3
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
+3
+3
1.除锈时,能否将铁制品长时间浸在酸中,为什么?
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
不能,因为铁与酸会继续反应,造成铁制品的腐蚀
2.如果将铁制品长时间浸在酸中可能会看到什么现象?
产生气泡,溶液变为浅绿色
根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式。并推测反应的现象
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
现象:黑色粉末逐渐消失,溶液由无色变为蓝色
类比迁移
酸具有的一些相似性质:
(1)能使酸碱指示剂显示不同的颜色
(2)能与多种活泼金属反应,生成氢气
Zn + 2HCl = ZnCl2 + H2↑
(3)酸能与某些金属氧化物反应,生成水
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
微观解释
为什么稀盐酸、稀硫酸具有相似的化学性质?
资料卡片
含Fe2+的溶液 浅绿色
含Fe3+的溶液 黄色
H+
Cl-
SO42-
H+
Cl-
Cl-
H+
SO42-
H+
H+
H+
H+
HCl
H2SO4
“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色
石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫
B.变红后颜色不再改变
C.先变无色后变红
D.先变红后变紫
D
学以致用1
小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉不见了,你知道为什么吗?用两个化学方程式表示出来。
用途:盐酸和硫酸可用于金属表面除锈
学以致用2
生锈铁钉消失的原因
1、 Fe2O3+6HCl == 2FeCl3+ 3H2O
2、 Fe + 2HCl ==FeCl2 + H2↑
铁锈溶解 铁溶解 溶解完全
你能用哪些方法鉴别水和稀硫酸?
提供试剂:紫色石蕊溶液、无色酚酞溶液、
镁条、锌粒、氧化铁、氧化铜
学以致用2
常见的酸和碱
第2课时 浓硫酸的腐蚀性 酸的化学性质
1.浓硫酸、浓硫酸的物理性质
复习回顾
(1)打开盛有浓盐酸的试剂瓶后,观察到瓶口出现白雾,这是因为浓盐酸具有_______
(2)浓硫酸可作气体干燥剂,这是因为浓硫酸具有____
挥发性
吸水性
2.浓硫酸的腐蚀性
2.浓硫酸的腐蚀性
实 验 放置一会儿后的现象 脱水性
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸 少量浓硫酸 将浓硫酸滴到 一小块布上 浓硫酸能夺取含碳、氢、氧等元素的化合物里的“水分” ( 氢、氧元素 ), 生成黑色的炭。
纸上显出黑色字迹
沾有浓硫酸的部位变黑
滴有浓硫酸的部位变黑甚至烧成洞
——化学性质
如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理
如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理
应立即用大量水冲洗,然后涂上3%—5%的碳酸氢钠溶液。
用大量的水冲洗。
不要将浓硫酸沾到皮肤上或衣服上!
如何稀释浓硫酸?
是将水注入浓硫酸呢
还是将浓硫酸注入水呢
注意!在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里。
×
酸入水、勤搅拌,杯壁下流
课堂练习
1. 下列叙述正确的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.把鼻孔凑到容器口闻气体的气味
D.稀硫酸沾到皮肤或衣服上,处理无需处理
B
2. 如何鉴别区分浓盐酸和浓硫酸?
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
变红色
变红色
不变色
不变色
结论:酸能与指示剂反应,使石蕊溶液变红,
不能使酚酞溶液变色
酸的化学性质
1、酸与指示剂的反应
2、酸与活泼金属的反应
与稀盐酸反应 与稀硫酸的反应
镁
锌
铁
铜
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
2、酸与活泼金属的反应
制取氢气
讨论:这些反应的生成物有什么共同之处?
回顾下利用盐酸可以制取什么气体?
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
石灰石
(主要成分CaCO3)
稀盐酸
(溶质为HCl)
盐酸与硫酸用于金属表面除锈。
⒊ 酸溶液能与金属氧化物反应:
现 象 化学方程式
铁锈+ 稀盐酸
铁锈+ 稀硫酸
铁锈消失,铁钉变得光亮,溶液由无色变为黄色
讨论:这些反应的生成物有什么共同之处?
Fe2O3+6HCl=2FeCl3+3H2O
+3
+3
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
+3
+3
1.除锈时,能否将铁制品长时间浸在酸中,为什么?
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
不能,因为铁与酸会继续反应,造成铁制品的腐蚀
2.如果将铁制品长时间浸在酸中可能会看到什么现象?
产生气泡,溶液变为浅绿色
根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式。并推测反应的现象
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
现象:黑色粉末逐渐消失,溶液由无色变为蓝色
类比迁移
酸具有的一些相似性质:
(1)能使酸碱指示剂显示不同的颜色
(2)能与多种活泼金属反应,生成氢气
Zn + 2HCl = ZnCl2 + H2↑
(3)酸能与某些金属氧化物反应,生成水
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
微观解释
为什么稀盐酸、稀硫酸具有相似的化学性质?
资料卡片
含Fe2+的溶液 浅绿色
含Fe3+的溶液 黄色
H+
Cl-
SO42-
H+
Cl-
Cl-
H+
SO42-
H+
H+
H+
H+
HCl
H2SO4
“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色
石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫
B.变红后颜色不再改变
C.先变无色后变红
D.先变红后变紫
D
学以致用1
小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉不见了,你知道为什么吗?用两个化学方程式表示出来。
用途:盐酸和硫酸可用于金属表面除锈
学以致用2
生锈铁钉消失的原因
1、 Fe2O3+6HCl == 2FeCl3+ 3H2O
2、 Fe + 2HCl ==FeCl2 + H2↑
铁锈溶解 铁溶解 溶解完全
你能用哪些方法鉴别水和稀硫酸?
提供试剂:紫色石蕊溶液、无色酚酞溶液、
镁条、锌粒、氧化铁、氧化铜
学以致用2
同课章节目录
