第二章第三节第2课时分子间的作用力课件(共26张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章第三节第2课时分子间的作用力课件(共26张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-26 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
第三节 分子结构与物质的性质
第二章 分子结构与性质
第2课时:分子间作用力 溶解性 手性分子
1.范德华力:
①定义:
分子之间普遍存在的一种相互作用力,它使得许多物质能以一定的凝聚态(如液态或固态)存在。
②特点:
范德华力很弱,比化学键键能小 1 ~ 2 个数量级;
一、分子间作用力
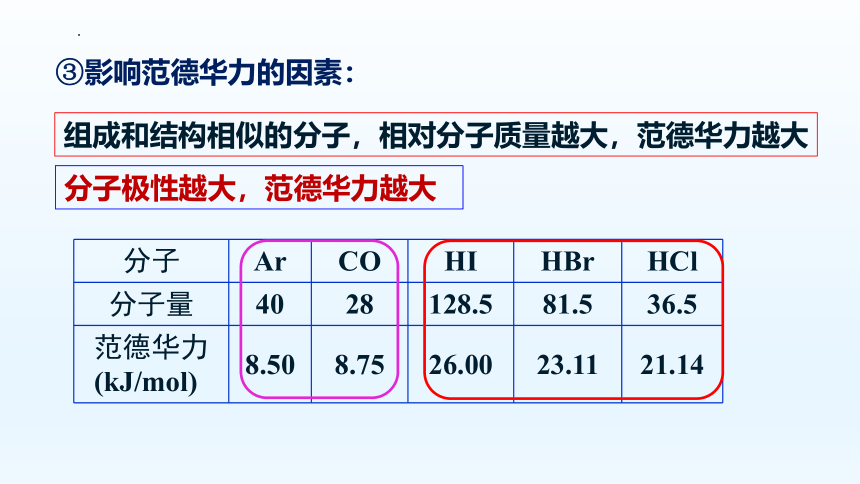
③影响范德华力的因素:
分子 Ar CO HI HBr HCl
分子量 40 28 128.5 81.5 36.5
范德华力(kJ/mol) 8.50 8.75 26.00 23.11 21.14
组成和结构相似的分子,相对分子质量越大,范德华力越大
分子极性越大,范德华力越大
④范德华力只影响物质的物理性质,如熔、沸点。
组成和结构相似,相对分子质量越大,范德华力越大,
熔、沸点越高。
增大
2.氢键:
⑴定义:
已经与电负性很大的原子形成共价键的氢原子,与另一个分子中电负性很大的原子之间形成的一种分子间作用力。
说明:这里电负性很大的原子是指N、F、O 。
⑵表示: 氢键通常用X—H Y —来表示, “—”表示共价键 , “…”表示形成的氢键(X、Y为N、O、F)。
…
O—H…O
N—H…N
F—H…F
(3)氢键的强度:
氢键的键能比化学键的键能小1~2个数量级,氢键不是化学键。
共价键 > 氢键 >范德华力
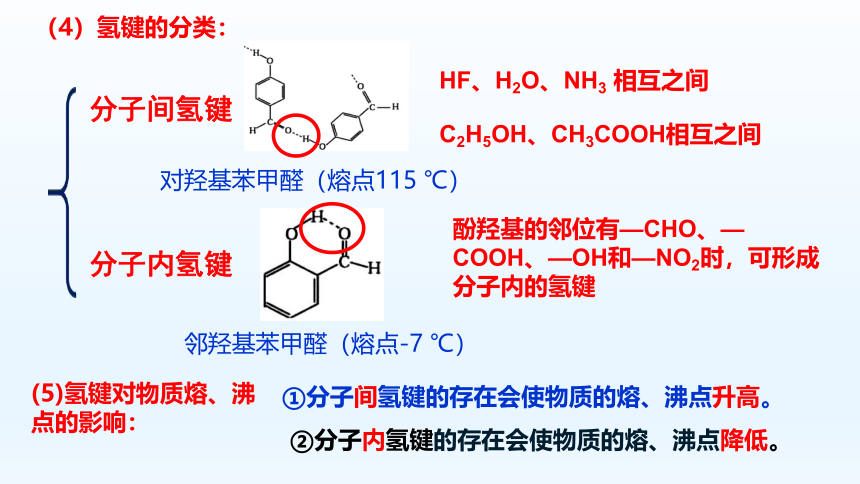
(4)氢键的分类:
分子间氢键
分子内氢键
HF、H2O、NH3 相互之间
C2H5OH、CH3COOH相互之间
酚羟基的邻位有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键
①分子间氢键的存在会使物质的熔、沸点升高。
②分子内氢键的存在会使物质的熔、沸点降低。
对羟基苯甲醛(熔点115 ℃)
邻羟基苯甲醛(熔点-7 ℃)
(5)氢键对物质熔、沸点的影响:
1.范德华力:(分子间作用力)分子的组成和结构相似,相对分子质量越大,分子间作用力越大,沸点越高。
2.氢键:分子间存在氢键使物质的熔、沸点升高
分子内存在氢键使物质的熔、沸点降低
小结:影响物质的熔、沸点:
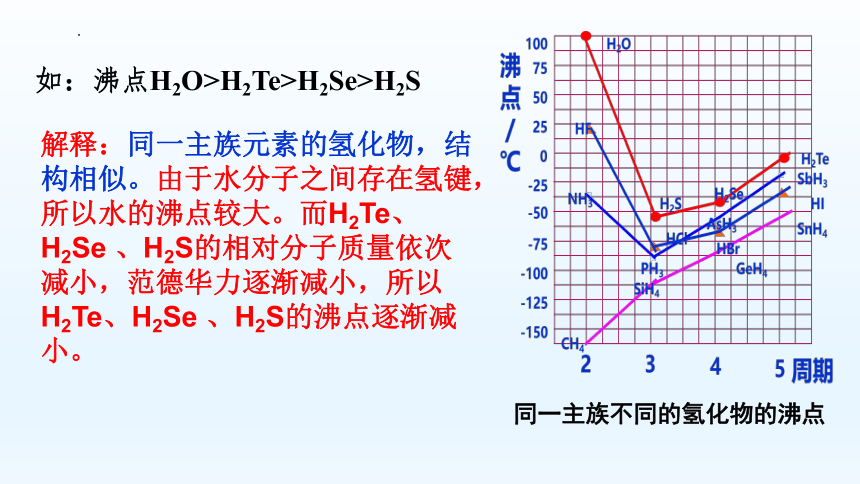
如:沸点H2O>H2Te>H2Se>H2S
解释:同一主族元素的氢化物,结构相似。由于水分子之间存在氢键,所以水的沸点较大。而H2Te、H2Se 、H2S的相对分子质量依次减小,范德华力逐渐减小,所以H2Te、H2Se 、H2S的沸点逐渐减小。
同一主族不同的氢化物的沸点
水的特殊物理性质
熔点/℃ 沸点/℃ ρ(0℃) ρ(4℃) ρ(20℃) ρ(100℃)
0.00 100.00 0.999841 1.000000 0.998203 0.958354
氢键对水分子性质的影响
特性:水的熔沸点比较高、冰的密度比液态水小、水在4℃时密度最大、测定的相对分子质量比按化学式计算的大。
在水蒸气中,水以单个的H2O分子形式存在;无氢键。
在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n;
在固态水(冰)中,水分子大范围地以氢键互相联结.
生物大分子中的氢键
生命体中许多大分也存在氢键(如图2-28),而且对生命物质的高级结构和生物活动具有重要的意义。例如,氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也正是通过氢键相互结合的(如图2-29)。
没有氢键就没有生命
(6)氢键对溶解度的影响
溶质与溶剂间形成氢键可以使溶解度增大。
练习1:
在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,所涉及的4种物质中,沸点从高到低的顺序为 :
H2O>CH3OH>CO2>H2
原因是:
H2O与CH3OH分子间均存在氢键,水分子间含氢键比甲醇中多;CO2与H2分子间均不存在氢键,CO2相对分子质量较大,范德华力较大
①相似相溶原理:非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂。
溶质和溶剂分子间存在氢键,作用力越大,溶解性增大。
3.溶解性
如:1.NH3为极性分子,易溶于极性溶剂水中;且氨分子易与水分子之间形成氢键。
2.碘易溶于CCl4 ,却难溶于水。原因是碘和CCl4 为非极性分子,而水是极性分子
3.甲醇可以与水以任意比例互溶,因为甲醇分子与水分子间可以形成分子间氢键
如低级醇与水互溶,而高级醇在水中的溶解度却很小
原因:乙醇CH3CH2OH分子中的—OH与水分子的—OH相近,因而乙醇能与水互溶;而戊醇CH3CH2CH2CH2CH2OH的烃基较大,其中的—OH与水分子的—OH的相似因素小得多了,因而它在水中的溶解度明显减小。
②“相似相溶”还适用于分子结构的相似性
【实验探究】
I2 + I- I3-
加入 CCl4
振荡
加入 KI 溶液
振荡
碘水呈棕黄色
溶液分层,下层
溶液呈紫红色
上层浅黄色变深,
下层紫红色变浅
结论:I2 在 CCl4 中溶解性比在水中好,I2 在与I-反应生产I3- ,溶解度增大。
③如果溶质与水反应,则可增大其溶解度。
总结:影响溶解性的因素
①溶质与溶剂的极性:相似相溶原理
③温度和压强等外部因素。
固体在水中的溶解度主要受温度影响;
气体溶解度主要受温度、压强影响。
② 溶质与溶剂之间能形成氢键;
溶质和溶剂的分子结构相似;
溶质与水反应。
均可增大溶解度
为什么需要用乙醚来提取青蒿素,用水不可以呢?
CH3CH2—O—CH2CH3
乙醚
青蒿素
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
二、分子的手性
人的左、右手互为实物 和 镜像,但彼此不能重合。
具有完全相同的组成和原子排列的一对分子,犹如实物和镜像,但彼此不能重合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
物质的这种特征叫手性
1.手性分子
如 CHFClBr的空间结构
绕轴旋转
不能叠合
2.手性碳原子
当碳原子连接4 个不同的原子或基团时,该碳原子就是一个手性中心,称为手性碳原子,标记为﹡。手性碳原子一定是饱和碳原子。
HOOC—CH—CH3
OH
﹡
1.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
B.丙氨酸
C.葡萄糖
D.甘油醛
A.苹果酸
HOOC—CH2—CHOH—COOH
*
CH3—CH—COOH
NH2
—
*
CH2—CH—CH—CH—CH—CHO
OH
—
—
OH
—
OH
—
OH
OH
—
*
CH2OH
—
CHOH
CHO
—
*
A
学习评价:
1.合成手性药物
3.手性分子的应用:
2.利用手性催化剂进行手性合成
课堂小结1
作用力类型 范德华力 氢键 共价键
作用微粒 分子 H与N、O、F 原子
强度比较 共价键>氢键>范德华力 影响因素 组成和结构相似的物质,相对分子质量越大,范德华力越大 形成氢键元素的电负性 原子半径
对性质 的影响 影响物质的熔点、沸点、溶解度等物理性质 分子间氢键使熔、沸点升高,溶解度增大 键能越大,稳定性越强
影响溶解性的因素
①溶质与溶剂的极性:相似相溶原理
③温度和压强等外部因素。
固体在水中的溶解度主要受温度影响;
气体溶解度主要受温度、压强影响。
② 溶质与溶剂之间能形成氢键;
溶质和溶剂的分子结构相似;
溶质与水反应。
均可增大溶解度
课堂小结2
2.手性碳原子
当碳原子连接4 个不同的原子或基团时,该碳原子就是一个手性中心,称为手性碳原子,标记为﹡。手性碳原子一定是饱和碳原子。
1.分子的手性
课堂小结3
具有完全相同的组成和原子排列的一对分子,犹如实物和镜像,但彼此不能重合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
3.手性分子的应用
第三节 分子结构与物质的性质
第二章 分子结构与性质
第2课时:分子间作用力 溶解性 手性分子
1.范德华力:
①定义:
分子之间普遍存在的一种相互作用力,它使得许多物质能以一定的凝聚态(如液态或固态)存在。
②特点:
范德华力很弱,比化学键键能小 1 ~ 2 个数量级;
一、分子间作用力
③影响范德华力的因素:
分子 Ar CO HI HBr HCl
分子量 40 28 128.5 81.5 36.5
范德华力(kJ/mol) 8.50 8.75 26.00 23.11 21.14
组成和结构相似的分子,相对分子质量越大,范德华力越大
分子极性越大,范德华力越大
④范德华力只影响物质的物理性质,如熔、沸点。
组成和结构相似,相对分子质量越大,范德华力越大,
熔、沸点越高。
增大
2.氢键:
⑴定义:
已经与电负性很大的原子形成共价键的氢原子,与另一个分子中电负性很大的原子之间形成的一种分子间作用力。
说明:这里电负性很大的原子是指N、F、O 。
⑵表示: 氢键通常用X—H Y —来表示, “—”表示共价键 , “…”表示形成的氢键(X、Y为N、O、F)。
…
O—H…O
N—H…N
F—H…F
(3)氢键的强度:
氢键的键能比化学键的键能小1~2个数量级,氢键不是化学键。
共价键 > 氢键 >范德华力
(4)氢键的分类:
分子间氢键
分子内氢键
HF、H2O、NH3 相互之间
C2H5OH、CH3COOH相互之间
酚羟基的邻位有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键
①分子间氢键的存在会使物质的熔、沸点升高。
②分子内氢键的存在会使物质的熔、沸点降低。
对羟基苯甲醛(熔点115 ℃)
邻羟基苯甲醛(熔点-7 ℃)
(5)氢键对物质熔、沸点的影响:
1.范德华力:(分子间作用力)分子的组成和结构相似,相对分子质量越大,分子间作用力越大,沸点越高。
2.氢键:分子间存在氢键使物质的熔、沸点升高
分子内存在氢键使物质的熔、沸点降低
小结:影响物质的熔、沸点:
如:沸点H2O>H2Te>H2Se>H2S
解释:同一主族元素的氢化物,结构相似。由于水分子之间存在氢键,所以水的沸点较大。而H2Te、H2Se 、H2S的相对分子质量依次减小,范德华力逐渐减小,所以H2Te、H2Se 、H2S的沸点逐渐减小。
同一主族不同的氢化物的沸点
水的特殊物理性质
熔点/℃ 沸点/℃ ρ(0℃) ρ(4℃) ρ(20℃) ρ(100℃)
0.00 100.00 0.999841 1.000000 0.998203 0.958354
氢键对水分子性质的影响
特性:水的熔沸点比较高、冰的密度比液态水小、水在4℃时密度最大、测定的相对分子质量比按化学式计算的大。
在水蒸气中,水以单个的H2O分子形式存在;无氢键。
在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n;
在固态水(冰)中,水分子大范围地以氢键互相联结.
生物大分子中的氢键
生命体中许多大分也存在氢键(如图2-28),而且对生命物质的高级结构和生物活动具有重要的意义。例如,氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也正是通过氢键相互结合的(如图2-29)。
没有氢键就没有生命
(6)氢键对溶解度的影响
溶质与溶剂间形成氢键可以使溶解度增大。
练习1:
在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,所涉及的4种物质中,沸点从高到低的顺序为 :
H2O>CH3OH>CO2>H2
原因是:
H2O与CH3OH分子间均存在氢键,水分子间含氢键比甲醇中多;CO2与H2分子间均不存在氢键,CO2相对分子质量较大,范德华力较大
①相似相溶原理:非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂。
溶质和溶剂分子间存在氢键,作用力越大,溶解性增大。
3.溶解性
如:1.NH3为极性分子,易溶于极性溶剂水中;且氨分子易与水分子之间形成氢键。
2.碘易溶于CCl4 ,却难溶于水。原因是碘和CCl4 为非极性分子,而水是极性分子
3.甲醇可以与水以任意比例互溶,因为甲醇分子与水分子间可以形成分子间氢键
如低级醇与水互溶,而高级醇在水中的溶解度却很小
原因:乙醇CH3CH2OH分子中的—OH与水分子的—OH相近,因而乙醇能与水互溶;而戊醇CH3CH2CH2CH2CH2OH的烃基较大,其中的—OH与水分子的—OH的相似因素小得多了,因而它在水中的溶解度明显减小。
②“相似相溶”还适用于分子结构的相似性
【实验探究】
I2 + I- I3-
加入 CCl4
振荡
加入 KI 溶液
振荡
碘水呈棕黄色
溶液分层,下层
溶液呈紫红色
上层浅黄色变深,
下层紫红色变浅
结论:I2 在 CCl4 中溶解性比在水中好,I2 在与I-反应生产I3- ,溶解度增大。
③如果溶质与水反应,则可增大其溶解度。
总结:影响溶解性的因素
①溶质与溶剂的极性:相似相溶原理
③温度和压强等外部因素。
固体在水中的溶解度主要受温度影响;
气体溶解度主要受温度、压强影响。
② 溶质与溶剂之间能形成氢键;
溶质和溶剂的分子结构相似;
溶质与水反应。
均可增大溶解度
为什么需要用乙醚来提取青蒿素,用水不可以呢?
CH3CH2—O—CH2CH3
乙醚
青蒿素
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
二、分子的手性
人的左、右手互为实物 和 镜像,但彼此不能重合。
具有完全相同的组成和原子排列的一对分子,犹如实物和镜像,但彼此不能重合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
物质的这种特征叫手性
1.手性分子
如 CHFClBr的空间结构
绕轴旋转
不能叠合
2.手性碳原子
当碳原子连接4 个不同的原子或基团时,该碳原子就是一个手性中心,称为手性碳原子,标记为﹡。手性碳原子一定是饱和碳原子。
HOOC—CH—CH3
OH
﹡
1.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
B.丙氨酸
C.葡萄糖
D.甘油醛
A.苹果酸
HOOC—CH2—CHOH—COOH
*
CH3—CH—COOH
NH2
—
*
CH2—CH—CH—CH—CH—CHO
OH
—
—
OH
—
OH
—
OH
OH
—
*
CH2OH
—
CHOH
CHO
—
*
A
学习评价:
1.合成手性药物
3.手性分子的应用:
2.利用手性催化剂进行手性合成
课堂小结1
作用力类型 范德华力 氢键 共价键
作用微粒 分子 H与N、O、F 原子
强度比较 共价键>氢键>范德华力 影响因素 组成和结构相似的物质,相对分子质量越大,范德华力越大 形成氢键元素的电负性 原子半径
对性质 的影响 影响物质的熔点、沸点、溶解度等物理性质 分子间氢键使熔、沸点升高,溶解度增大 键能越大,稳定性越强
影响溶解性的因素
①溶质与溶剂的极性:相似相溶原理
③温度和压强等外部因素。
固体在水中的溶解度主要受温度影响;
气体溶解度主要受温度、压强影响。
② 溶质与溶剂之间能形成氢键;
溶质和溶剂的分子结构相似;
溶质与水反应。
均可增大溶解度
课堂小结2
2.手性碳原子
当碳原子连接4 个不同的原子或基团时,该碳原子就是一个手性中心,称为手性碳原子,标记为﹡。手性碳原子一定是饱和碳原子。
1.分子的手性
课堂小结3
具有完全相同的组成和原子排列的一对分子,犹如实物和镜像,但彼此不能重合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
3.手性分子的应用
