第三章第一节物质的聚集状态与晶体的常识第二课时晶胞和晶体结构的测定课件(共31张ppt)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章第一节物质的聚集状态与晶体的常识第二课时晶胞和晶体结构的测定课件(共31张ppt)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-26 00:00:00 | ||
图片预览





文档简介
第一节 物质的聚集状态和晶体的常识
第三章 晶体结构和性质
第二课时 晶胞、晶胞结构的测定
学习目标
1.认识简单的晶胞。
2.通过典型晶胞的学习,形成分析晶胞结构的思维模型,利用思维模型,类推其他晶胞的分析方法。
3.学会晶胞中微粒数的计算方法(均摊法),能根据晶胞的结构确定晶体的化学式,初步学习晶体密度计算的方法。
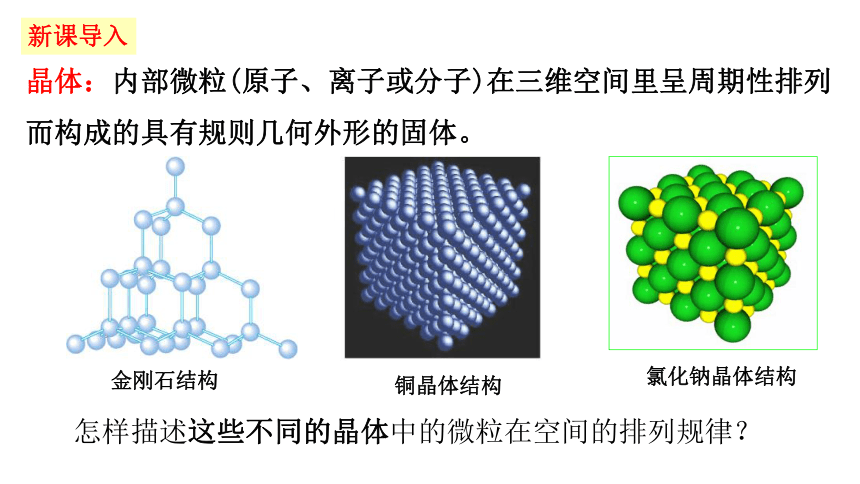
怎样描述这些不同的晶体中的微粒在空间的排列规律?
氯化钠晶体结构
铜晶体结构
晶体:内部微粒(原子、离子或分子)在三维空间里呈周期性排列而构成的具有规则几何外形的固体。
金刚石结构
新课导入
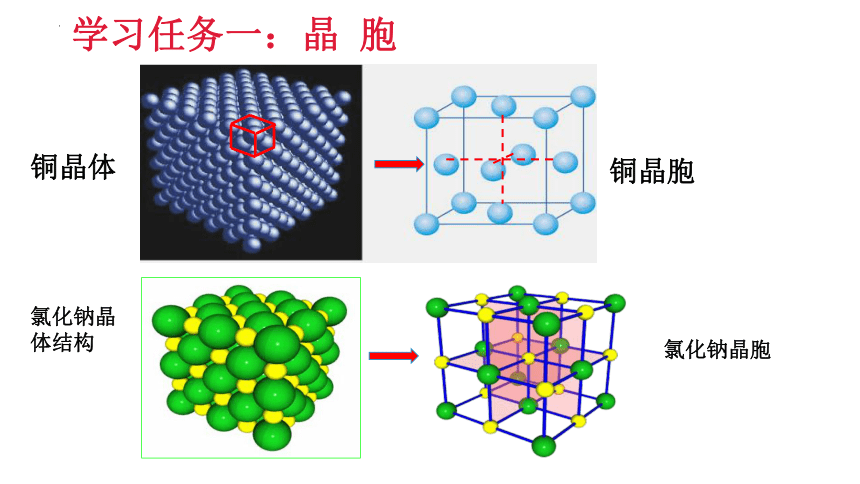
铜晶体
铜晶胞
学习任务一:晶 胞
氯化钠晶体结构
氯化钠晶胞
铜晶体
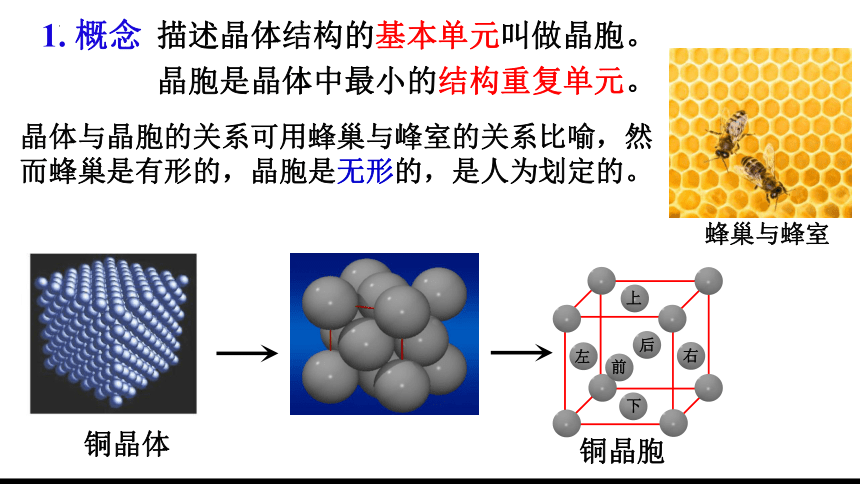
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定的。
蜂巢与蜂室
铜晶胞
上
前
后
左
右
下
1. 概念
描述晶体结构的基本单元叫做晶胞。
晶胞是晶体中最小的结构重复单元。
6
12
8
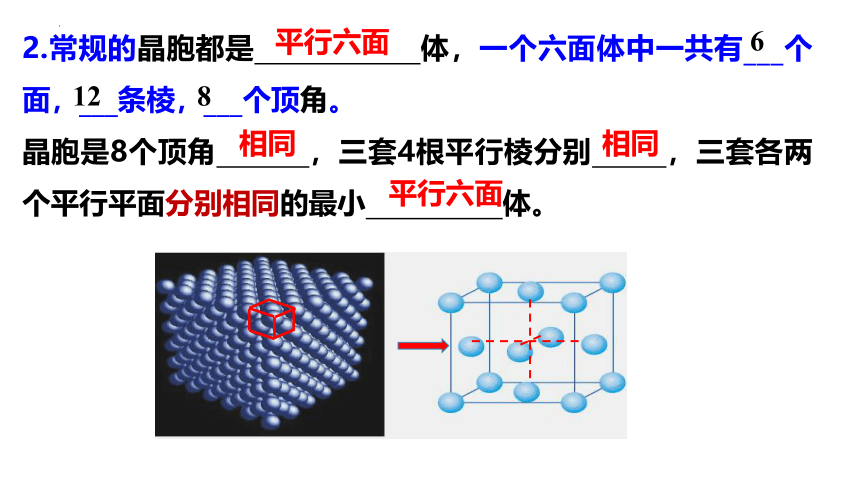
2.常规的晶胞都是 体,一个六面体中一共有___个面,___条棱,___个顶角。
晶胞是8个顶角 ,三套4根平行棱分别 ,三套各两个平行平面分别相同的最小 体。
平行六面
相同
相同
平行六面
3.晶体与晶胞的关系
整块晶体可看作无数个晶胞“无隙并置”而成
所有晶胞的_____及其内部的原子 及几何排列是完全相同的。
形状
种类、个数
晶胞
晶体
晶胞间无间隙,平行排列,取向相同
铜晶体
铜晶胞
上
前
后
左
右
下
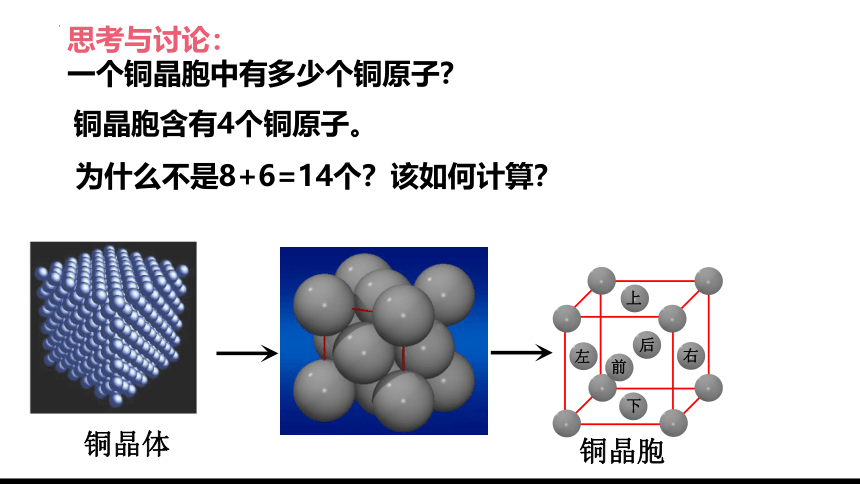
思考与讨论:
一个铜晶胞中有多少个铜原子?
铜晶胞含有4个铜原子。
为什么不是8+6=14个?该如何计算?
每个顶点:1/8
每个面心:1/2
金属铜一个晶胞的铜原子数:
8×1/8+6×1/2=4
铜晶胞中含有8个顶点、6个面心
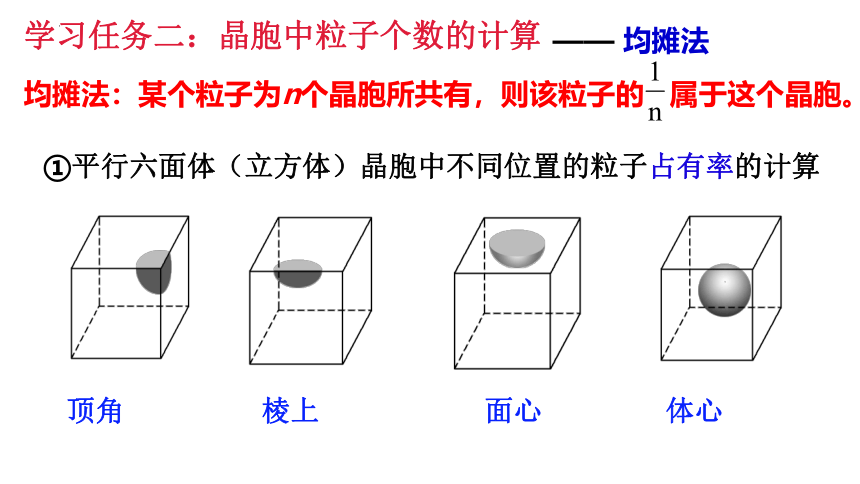
学习任务二:晶胞中粒子个数的计算
计算出这个铜晶胞平均含有的铜原子数目
—— 均摊法
均摊法:某个粒子为n个晶胞所共有,则该粒子的 属于这个晶胞。
学习任务二:晶胞中粒子个数的计算
—— 均摊法
面心
体心
棱上
顶角
①平行六面体(立方体)晶胞中不同位置的粒子占有率的计算
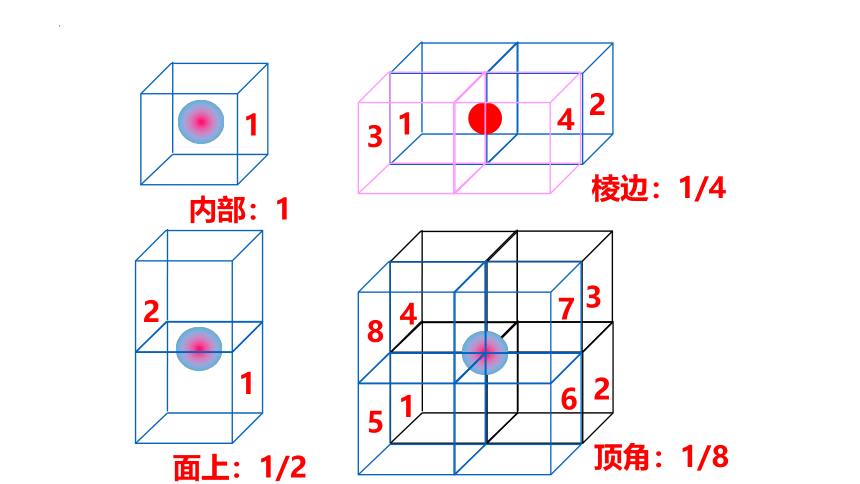
1
内部:1
1
2
面上:1/2
2
1
3
4
棱边:1/4
1
2
4
3
7
6
8
5
顶角:1/8
某个粒子为n个晶胞所共有,则该粒子的 属于这个晶胞
④顶角:由8个晶胞共同拥有,各晶胞各分享其1/8
③棱上:由4个晶胞共同拥有,各晶胞各分享其1/4
①内部:由1个晶胞拥有,该晶胞独自拥有该粒子
②面上:由2个晶胞共同拥有,各晶胞各分享其1/2
①平行六面体(立方体)晶胞中不同位置的粒子占有率的计算
均摊法计算立方晶胞原子数目原则
铜晶胞
学习任务二:晶胞中粒子个数的计算
思考与讨论:P74
课堂练习1.
(2)数一数,它们分别平均含有几个原子?
金属钠(Na) 金属锌(Zn) 碘(I2) 金刚石(C)
课堂练习2:请计算出NaCl晶胞Na+和Cl-的个数。
Na+数=12× +1 =4
1
4
1
8
Cl-数=8× +6 × =4
1
2
Na+数: Cl-数=1:1
氯化钠的化学式为NaCl
一个晶胞含4个NaCl
应用:根据晶胞确定化学式。
图中X=____,Y=____, Z=____,该物质化学式为 。
1
3
1
XY3Z
—X, —Y, —Z
应用1:计算晶胞原子个数→求化学式
注意:求晶胞或晶体的化学式用各类粒子的最简整数比
课堂练习3:根据晶体的晶胞结构,判断下列晶体的化学式:(A表示阳离子)
A
B
化学式:
AB
化学式:
AB2
C
化学式:
ABC3
②六棱柱晶胞中粒子的计算方法
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
—— 均摊法
学习任务二:晶胞中粒子个数的计算
③三棱柱晶胞中粒子的计算方法
顶点:1/12
侧棱:1/6
内部:1
上下棱:1/4
—— 均摊法
学习任务二:晶胞中粒子个数的计算
晶胞1
晶胞2
X:6/12=1/2
Y:6/4+3/6=2
Z:1
Mg:12/6+2/2=3
B:(在体内) 6
课堂练习4:计算下列晶胞中原子数目,确定化学式。
化学式:X2ZY4
化学式:MgB2
小结:均摊法计算晶胞的组成
{5940675A-B579-460E-94D1-54222C63F5DA}
顶点
棱边
面心
体心
立方体
1/8
1/4
1/2
1
三棱柱
六棱柱
1/12
上下棱1/4 侧棱1/6
1/6
上下棱1/4 侧棱1/3
1/2
1
1/2
1
方法:某个粒子为n个晶胞所共有,则该粒子有1/n属于该晶胞
ρ= =
N · M
abc · NA
N · M
V · NA
晶体的密度
ρ:晶体的密度(一般是g·cm?3)
N:1个晶胞中化学式数目
M:化学式的摩尔质量(g·mol?1)
V: 1个晶胞的体积(一般是cm3)
NA:阿伏伽德罗常数(mol?1)
abc:晶胞参数(一般是pm或nm)
单位换算:1cm=107nm=1010pm
注意晶胞体积计算时的单位换算
m
V
=
nM
V
=
学习任务三:晶体密度的计算
解:晶胞的边长为a pm
例题1:已知CsCl的摩尔质量为168.5gmol,其晶胞如图所示。晶胞边长为a pm。阿伏伽德罗常数为NA,则CsCl晶体的密度为 g/cm3
=a×10-10 cm
体积V=(a×10-10 )3 cm3
CsCl的摩尔质量M=168.5g/mol
晶胞中含CsCl个数:1个
晶体的密度= =
m
V
g
168.5
NA
(a×10-10 )3 cm3
最后化简
顶点-Cs+ 中心-Cl﹣
应用2:计算晶胞原子个数→求晶胞的密度(g/cm3)
=1
8×
18
?
晶胞Cs+的原子数
=
晶胞Cl﹣的原子数
=1
N · M
V · NA
=
例题2:如图所示是钙钛矿的晶胞,则其化学式为 。若晶胞参数(晶胞的边长)为a pm。阿伏伽德罗常数为NA,则晶体的密度为 g/cm3
解:晶胞的边长为a pm
=a×10-10 cm
体积V=(a×10-10 )3 cm3
1mol CaTiO3的质量m=136g
CaTiO3
晶胞的质量= g
136
NA
晶体的密度ρ= =
m
V
g
136
NA
(a×10-10 )3 cm3
最后化简
晶胞中含CaTiO3个数:1个
应用2:计算晶胞原子个数→求晶胞的密度(g/cm3)
例题3: Cu2O的晶胞如图所示。晶胞边长为a pm。阿伏伽德罗常数为NA,Cu2O的摩尔质量为Mg/mol,则Cu2O晶体的密度为 g/cm3
解:晶胞的边长为a pm
=a×10-10 cm
体积V=(a×10-10 )3 cm3
1mol Cu2O的质量m=M g
晶胞的质量= g
M
NA
×2
晶体的密度= =
m
V
2M×1030
aNA
g/ cm3
晶胞中含4个Cu原子,2个O原子,即,含2个Cu2O
题型:计算晶胞的密度(g/cm3)
Na+
Cl-
计算该晶胞中,若两个距离最近的Na+核间距为a cm, 则晶体的密度ρ= ___g·cm?3
acm
晶胞的边长:
晶胞的体积:
ρ = =
Z · M
abc · NA
4×58·5
2√2 a3 ×NA
√2 a cm
2√2 a3 cm3
=
58·5√2
a3 · NA
g·cm?3
2acm
ρ= =
N · M
abc · NA
N · M
V · NA
课堂练习5:
X射线管
铅板
晶体
1.测定晶体结构仪器、方法及原理
X射线衍射原理:单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
最常用的仪器是X射线衍射仪
学习任务四:晶胞结构的测定
图3-13 单晶衍射图
图3-14 非晶态和晶态SiO2粉末X射线衍射图谱的对比
衍射图
计算获得
晶胞形状和大小
分子或原子在微观空间有序排列呈现的对称类型
⒉X射线衍射图谱的应用
①X射线衍射实验获得晶胞信息
晶体的周期性结构
衍射图
计算获得
晶胞形状和大小
分子或原子在微观空间有序排列呈现的对称类型
原子在晶胞里的数目和位置
结合晶体化学组成的信息推出原子之间的相互关系
②X射线衍射实验获得分子信息
根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
乙酸晶体
乙酸晶胞
图3-15乙酸分子的空间结构
如图:乙酸晶体和乙酸晶胞
第三章 晶体结构和性质
第二课时 晶胞、晶胞结构的测定
学习目标
1.认识简单的晶胞。
2.通过典型晶胞的学习,形成分析晶胞结构的思维模型,利用思维模型,类推其他晶胞的分析方法。
3.学会晶胞中微粒数的计算方法(均摊法),能根据晶胞的结构确定晶体的化学式,初步学习晶体密度计算的方法。
怎样描述这些不同的晶体中的微粒在空间的排列规律?
氯化钠晶体结构
铜晶体结构
晶体:内部微粒(原子、离子或分子)在三维空间里呈周期性排列而构成的具有规则几何外形的固体。
金刚石结构
新课导入
铜晶体
铜晶胞
学习任务一:晶 胞
氯化钠晶体结构
氯化钠晶胞
铜晶体
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定的。
蜂巢与蜂室
铜晶胞
上
前
后
左
右
下
1. 概念
描述晶体结构的基本单元叫做晶胞。
晶胞是晶体中最小的结构重复单元。
6
12
8
2.常规的晶胞都是 体,一个六面体中一共有___个面,___条棱,___个顶角。
晶胞是8个顶角 ,三套4根平行棱分别 ,三套各两个平行平面分别相同的最小 体。
平行六面
相同
相同
平行六面
3.晶体与晶胞的关系
整块晶体可看作无数个晶胞“无隙并置”而成
所有晶胞的_____及其内部的原子 及几何排列是完全相同的。
形状
种类、个数
晶胞
晶体
晶胞间无间隙,平行排列,取向相同
铜晶体
铜晶胞
上
前
后
左
右
下
思考与讨论:
一个铜晶胞中有多少个铜原子?
铜晶胞含有4个铜原子。
为什么不是8+6=14个?该如何计算?
每个顶点:1/8
每个面心:1/2
金属铜一个晶胞的铜原子数:
8×1/8+6×1/2=4
铜晶胞中含有8个顶点、6个面心
学习任务二:晶胞中粒子个数的计算
计算出这个铜晶胞平均含有的铜原子数目
—— 均摊法
均摊法:某个粒子为n个晶胞所共有,则该粒子的 属于这个晶胞。
学习任务二:晶胞中粒子个数的计算
—— 均摊法
面心
体心
棱上
顶角
①平行六面体(立方体)晶胞中不同位置的粒子占有率的计算
1
内部:1
1
2
面上:1/2
2
1
3
4
棱边:1/4
1
2
4
3
7
6
8
5
顶角:1/8
某个粒子为n个晶胞所共有,则该粒子的 属于这个晶胞
④顶角:由8个晶胞共同拥有,各晶胞各分享其1/8
③棱上:由4个晶胞共同拥有,各晶胞各分享其1/4
①内部:由1个晶胞拥有,该晶胞独自拥有该粒子
②面上:由2个晶胞共同拥有,各晶胞各分享其1/2
①平行六面体(立方体)晶胞中不同位置的粒子占有率的计算
均摊法计算立方晶胞原子数目原则
铜晶胞
学习任务二:晶胞中粒子个数的计算
思考与讨论:P74
课堂练习1.
(2)数一数,它们分别平均含有几个原子?
金属钠(Na) 金属锌(Zn) 碘(I2) 金刚石(C)
课堂练习2:请计算出NaCl晶胞Na+和Cl-的个数。
Na+数=12× +1 =4
1
4
1
8
Cl-数=8× +6 × =4
1
2
Na+数: Cl-数=1:1
氯化钠的化学式为NaCl
一个晶胞含4个NaCl
应用:根据晶胞确定化学式。
图中X=____,Y=____, Z=____,该物质化学式为 。
1
3
1
XY3Z
—X, —Y, —Z
应用1:计算晶胞原子个数→求化学式
注意:求晶胞或晶体的化学式用各类粒子的最简整数比
课堂练习3:根据晶体的晶胞结构,判断下列晶体的化学式:(A表示阳离子)
A
B
化学式:
AB
化学式:
AB2
C
化学式:
ABC3
②六棱柱晶胞中粒子的计算方法
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
—— 均摊法
学习任务二:晶胞中粒子个数的计算
③三棱柱晶胞中粒子的计算方法
顶点:1/12
侧棱:1/6
内部:1
上下棱:1/4
—— 均摊法
学习任务二:晶胞中粒子个数的计算
晶胞1
晶胞2
X:6/12=1/2
Y:6/4+3/6=2
Z:1
Mg:12/6+2/2=3
B:(在体内) 6
课堂练习4:计算下列晶胞中原子数目,确定化学式。
化学式:X2ZY4
化学式:MgB2
小结:均摊法计算晶胞的组成
{5940675A-B579-460E-94D1-54222C63F5DA}
顶点
棱边
面心
体心
立方体
1/8
1/4
1/2
1
三棱柱
六棱柱
1/12
上下棱1/4 侧棱1/6
1/6
上下棱1/4 侧棱1/3
1/2
1
1/2
1
方法:某个粒子为n个晶胞所共有,则该粒子有1/n属于该晶胞
ρ= =
N · M
abc · NA
N · M
V · NA
晶体的密度
ρ:晶体的密度(一般是g·cm?3)
N:1个晶胞中化学式数目
M:化学式的摩尔质量(g·mol?1)
V: 1个晶胞的体积(一般是cm3)
NA:阿伏伽德罗常数(mol?1)
abc:晶胞参数(一般是pm或nm)
单位换算:1cm=107nm=1010pm
注意晶胞体积计算时的单位换算
m
V
=
nM
V
=
学习任务三:晶体密度的计算
解:晶胞的边长为a pm
例题1:已知CsCl的摩尔质量为168.5gmol,其晶胞如图所示。晶胞边长为a pm。阿伏伽德罗常数为NA,则CsCl晶体的密度为 g/cm3
=a×10-10 cm
体积V=(a×10-10 )3 cm3
CsCl的摩尔质量M=168.5g/mol
晶胞中含CsCl个数:1个
晶体的密度= =
m
V
g
168.5
NA
(a×10-10 )3 cm3
最后化简
顶点-Cs+ 中心-Cl﹣
应用2:计算晶胞原子个数→求晶胞的密度(g/cm3)
=1
8×
18
?
晶胞Cs+的原子数
=
晶胞Cl﹣的原子数
=1
N · M
V · NA
=
例题2:如图所示是钙钛矿的晶胞,则其化学式为 。若晶胞参数(晶胞的边长)为a pm。阿伏伽德罗常数为NA,则晶体的密度为 g/cm3
解:晶胞的边长为a pm
=a×10-10 cm
体积V=(a×10-10 )3 cm3
1mol CaTiO3的质量m=136g
CaTiO3
晶胞的质量= g
136
NA
晶体的密度ρ= =
m
V
g
136
NA
(a×10-10 )3 cm3
最后化简
晶胞中含CaTiO3个数:1个
应用2:计算晶胞原子个数→求晶胞的密度(g/cm3)
例题3: Cu2O的晶胞如图所示。晶胞边长为a pm。阿伏伽德罗常数为NA,Cu2O的摩尔质量为Mg/mol,则Cu2O晶体的密度为 g/cm3
解:晶胞的边长为a pm
=a×10-10 cm
体积V=(a×10-10 )3 cm3
1mol Cu2O的质量m=M g
晶胞的质量= g
M
NA
×2
晶体的密度= =
m
V
2M×1030
aNA
g/ cm3
晶胞中含4个Cu原子,2个O原子,即,含2个Cu2O
题型:计算晶胞的密度(g/cm3)
Na+
Cl-
计算该晶胞中,若两个距离最近的Na+核间距为a cm, 则晶体的密度ρ= ___g·cm?3
acm
晶胞的边长:
晶胞的体积:
ρ = =
Z · M
abc · NA
4×58·5
2√2 a3 ×NA
√2 a cm
2√2 a3 cm3
=
58·5√2
a3 · NA
g·cm?3
2acm
ρ= =
N · M
abc · NA
N · M
V · NA
课堂练习5:
X射线管
铅板
晶体
1.测定晶体结构仪器、方法及原理
X射线衍射原理:单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
最常用的仪器是X射线衍射仪
学习任务四:晶胞结构的测定
图3-13 单晶衍射图
图3-14 非晶态和晶态SiO2粉末X射线衍射图谱的对比
衍射图
计算获得
晶胞形状和大小
分子或原子在微观空间有序排列呈现的对称类型
⒉X射线衍射图谱的应用
①X射线衍射实验获得晶胞信息
晶体的周期性结构
衍射图
计算获得
晶胞形状和大小
分子或原子在微观空间有序排列呈现的对称类型
原子在晶胞里的数目和位置
结合晶体化学组成的信息推出原子之间的相互关系
②X射线衍射实验获得分子信息
根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
乙酸晶体
乙酸晶胞
图3-15乙酸分子的空间结构
如图:乙酸晶体和乙酸晶胞
