到实验室去:探究金属的性质 同步练习(有答案) 2022-2023学年鲁教版九年级下册化学
文档属性
| 名称 | 到实验室去:探究金属的性质 同步练习(有答案) 2022-2023学年鲁教版九年级下册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 123.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-25 00:00:40 | ||
图片预览




文档简介
到实验室去:探究金属的性质 同步练习
一、单选题
1.下列物质的转化(“→”表示一种物质转化为另一种物质)中,每次转化只通过一步反应,不可能全部实现的是( )
A.H2O2→O2→CO2→H2CO3 B.NaOH→NaNO3→Na2CO3→NaCl
C.CaCO3→CaO→Ca(OH)2→KOH D.Mg→H2→HCl→AlCl3
2.下列有关金属性质的说法错误的是( )
A.常温下所有金属都是银白色的固体
B.在空气中灼烧铜丝,其表面会变黑
C.铜、银等金属具有良好的导电性
D.埋在潮湿、疏松、透气的酸性土壤中的铸铁管容易被腐蚀
3.从化学角度看,下列叙述不正确的是( )
A.厨房煤气泄漏应立即关闭阀门并打开门窗
B.扑灭图书档案火灾最适宜用液态二氧化碳灭火器
C.在铵态氮肥中加入熟石灰研磨可以闻到刺激性气味
D.常用钢丝球擦洗铝壶可以使其光亮洁净和更加耐用
4.下列图象不能正确反映其对应操作的是()
A B C D
在一定量的Na2CO3溶液中逐滴加入Ca(OH)2溶液 等质量的Zn和Mg分别与等质量、等质量分数的稀硫酸(足量)反应 向NaOH溶液中逐滴加入稀盐酸 向一定量硫酸和硫酸铜混合溶液中逐滴滴加氢氧化钠溶液
A.A B.B
C.C D.D
5.下列各选项与如图所示曲线相符的是( )
选项 横 坐 标 纵 坐 标
A 向一定量稀硫酸中加入锌粉的质量 溶液中氢元素的质量
B 向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量 产生气体的质量
C 向一定量的澄清石灰水中加入碳酸钠溶液的质量 生成沉淀的质量
D 在一定温度下,向一定量的不饱和硝酸钾溶液中加入硝酸钾固体的质量 溶液中溶质的质量分数
A.A B.B C.C D.D
6.下列叙述与对应的示意图表示正确的是( )
A B C D
向一定量的硫酸铜溶液中加铁粉 向一定量pH=2的盐 酸中逐滴加水稀释 电解一定质量的水 等质量的锌、铁与足量等浓度稀硫酸反应
A.A B.B C.C D.D
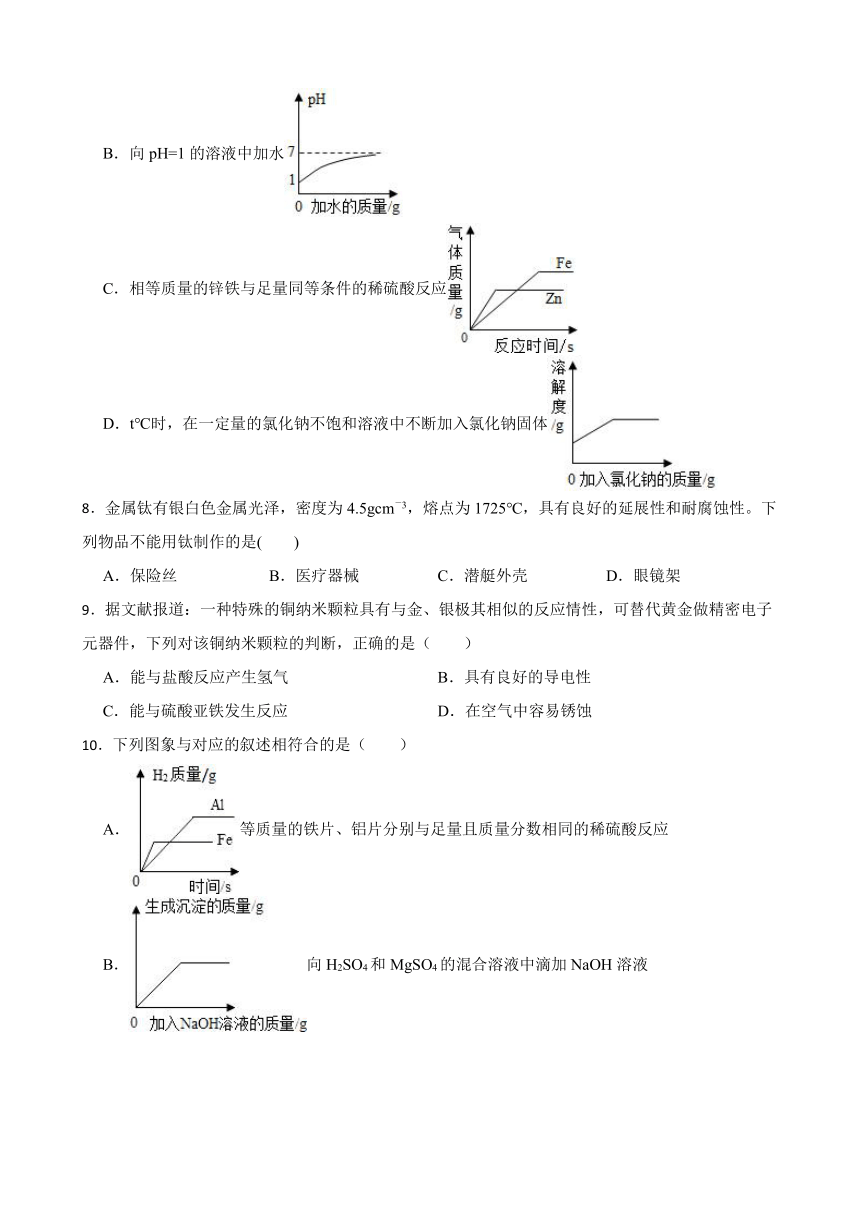
7.与以下四个变化过程对应的四个图象中,不正确的是( )
A.一定量的饱和石灰水中加入一定量的氧化钙,溶液质量与加入后时间的关系
B.向pH=1的溶液中加水
C.相等质量的锌铁与足量同等条件的稀硫酸反应
D.t℃时,在一定量的氯化钠不饱和溶液中不断加入氯化钠固体
8.金属钛有银白色金属光泽,密度为4.5gcm-3,熔点为1725℃,具有良好的延展性和耐腐蚀性。下列物品不能用钛制作的是( )
A.保险丝 B.医疗器械 C.潜艇外壳 D.眼镜架
9.据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应情性,可替代黄金做精密电子元器件,下列对该铜纳米颗粒的判断,正确的是( )
A.能与盐酸反应产生氢气 B.具有良好的导电性
C.能与硫酸亚铁发生反应 D.在空气中容易锈蚀
10.下列图象与对应的叙述相符合的是( )
A.等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
B.向H2SO4和MgSO4的混合溶液中滴加NaOH溶液
C.向pH=13的氢氧化钠溶液中不断加水稀释
D.化学反应中,原子总数随时间的变化
11.化学是以实验为基础的学科,下列有关实验现象的描述中,正确的是( )
A.硫粉在空气中燃烧产生明亮的蓝紫色火焰
B.电解水实验中正极与负极产生的气体体积比是1:8
C.氧气还原铜丝表面的氧化铜,铜丝表面由黑色变红色
D.将铁钉浸到硫酸铜溶液中,铁钉表面会有红色固体生成,溶液变成无色
12.往AgNO3和Cu(NO3)2的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生,根据上述现象分析,你认为下面结论错误的是( )
A.滤渣中一定有镁粉 B.滤渣中一定有铜和银
C.滤液中一定有Mg2+ D.滤液中一定有Ag+和Cu2+
二、填空题
13.除去下列各物质中混有的少量杂质,所用试剂正确的是
序号 物质 杂质 所用试剂
A N2 O2 灼热的铜网
B CO2 H2O 碱石灰
C CaO CaCO3 适量的稀盐酸
D NaCl溶液 Na2CO3
14.近年来,广西开展“美丽广西,清洁乡村”行动,环境质量得到大大改善.请根据所学知识回答下列问题:
(1)政府鼓励并支持乡村使用沼气作为燃料,沼气的主要成分是 (填化学式);
(2)村里的生活用水大多是硬水,将硬水软化常用的方法是 ;
(3)天气闷热时,村里鱼塘的鱼总是接近水面游动是由于 ;
(4)农村中长期堆放的干草易引起火灾.从燃烧条件分析“干草”是 ;
(5)2014年百色“农博会”上有一种在塑料中添加土豆淀粉制成的“土豆农膜”. 村民种植农作物使用土豆农膜比普通塑料农膜 (填“难”或“易”)降解.
15.铁制品生锈的条件是与 (填写化学式)接触,工业上常用稀盐酸除去铁锈,反应的化学方程式是 ;如果把铁制品长时间浸泡在盐酸中,还会发生的反应方程式为 。
16.物质的性质决定了物质的用途,请在右栏中找出能正确说明左栏物质用途的相应性质,并用线段一对一连接起来.
A.用干冰作制冷剂 a.常温下化学性质稳定
B.在食品袋中充氮气 b.有助燃性
C.氧气用于火箭发射 c.能和铁发生反应
D.硫酸铜用于湿法冶金 d.易升华吸收大量的热
17.铁、铜、铝、锌是生产生活中常用的金属.
(1)铝能制成铝箔是因为铝具有良好的 性;
(2)在金属活动性顺序中,铁、铜、铝、锌由强到弱排列的顺序是 (填元素符号)
(3)任写出一个稀盐酸能与上述金属能发生反应的化学方程式 .
18.学习化学知识的目的之一是分析和解决实际问题.
(1)在日常生活中,厨房常用的由金属材料制成的物品有 (写出一种).
(2)沼气与天然气的主要成分都是甲烷,其完全燃烧的化学方程式为 .
(3)吸烟有害健康.香烟烟气中含有几百种对人体有害的物质,如尼古丁、焦油、一氧化碳等,其中与血红蛋白结合能力强的有毒气体是 .
(4)用洗涤剂清洗油污,是利用了洗涤剂的 作用.
三、综合题
19.已知:铝能与氢氧化钠溶液反应,生成偏铝酸钠(NaAlO2) 和氢气;铁、铜不能与氢氧化钠溶液反应。把上述三种金属样品分别编号为X、Y、Z,若把X、Y、Z分别放入稀硫酸中,则X、Y溶解,Z不溶解,另取X、Y分别放入氢氧化钠溶液中,Y不溶解,X溶解,请回答:
(1)写出铝与氢氧化钠溶液反应的化学方程式。
(2)Y与硝酸银溶液反应后溶液质量如何变化
(3)描述X与Z的硫酸盐溶液反应的现象。
20.铁及其化合物在生产生活有广泛的应用。
(1)一、铁的相关知识
磁铁矿是早期司南(如图)的材料,磁铁矿中所含铁的氧化物主要是 。
(2)西汉有“曾青得铁化为铜”之说,用化学方程式表示其原理 。
(3)某钢中含有少量Mn。MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(4)用铁锅加热食物,说明铁具良好的有 性。
(5)铁锈主要成分是Fe2O3·nH2O,铁生锈主要与空气中的 有关。
(6)二、废铁屑的利用
草酸铁钾晶体[K3Fe(C2O4)3·xH2O]是一种光敏材料。用废铁屑(主要成分为Fe,含少量Fe2O3)制备该晶体主要流程如下:
“酸溶”时,产生的气体X为 。
(7)“转化1”中加入铁粉是将+3价的铁转化为+2价的铁,该反应的化学方程式为 。
(8)“转化2”反应生成FeC2O4·nH2O的化学方程式是 。
(9)“转化3”需控制一定的温度,但温度不能太高的原因是 。
(10)三、草酸铁钾晶体的实验
称取9.82g草酸铁钾晶体,用下图装置进行热分解实验。
【资料】①Mr[K3Fe(C2O4)3]=437
②草酸铁钾晶体在110℃时失去全部结晶水,230℃时完全分解生成K2CO3、Fe、FeO、CO、CO2。
连接好装置后,要先 。
(11)控制温度对A中固体加热,加热前后及过程中均需通入N2。当加热到110℃后,通入N2的目的是防止倒吸和 。
(12)数据处理:测得B、C装置在不同温度下的质量,如下表所示。230℃反应结束后,A中剩余固体5.42g。
温度/℃ 室温 110 230
B装置/g 200.00 201.08 201.08
C装置/g 200.00 200.00 202.20
计算:①x= 。
②5.42g剩余固体中单质Fe的质量为 g。
③上述K3Fe(C2O4)3热分解的化学方程式 。
21.金属材料与人类的生产和生活密切相关.
2015年5月12日,海西高速公路网的重要组成部分:福建省最长跨海大桥﹣泉州湾大桥正式通车.大桥的建设及通行涉及到许多的化学知识.
(1)制造大桥护栏和斜拉索等重要器件的材料都是钢,钢属于 (选填“金属”或“无机非金属”)材料.
(2)工人给大桥钢铁器件喷上油漆,目的是为了防止铁与 发生反应而生锈.
(3)A,B,C,D四中金属单质,A能从B的化合物溶液中置换出B,但A不能与稀盐酸反应.相同条件下,C,D能与稀盐酸反应产生氢气,且D比C反应剧烈.则四种金属的活动性由强到弱的顺序是: .
(4)锌铜合金中是铜合金中的一种,用途较为广泛.为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4═ZnSO4+H2↑.多次实验后,取平均值所得数据如表:
反应前 充分反应后装置及反应剩余物质质量
装置和足量的稀硫酸质量 锌铜合金质量
342.10g 16.00g 357.70g
若不考虑干燥剂吸收空气中的水蒸气,计算:
ⅰ根据质量守恒定律求生成氢气的质量是多少g?
ⅱ该合金中锌的质量分数是多少?(请写出计算过程)
22.金属在日常生活,工农业生产和科学研究方面应用广泛.
(1)铜可用来制作导线,是因为其具有良好的延展性和 .
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是 .
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a: b: c:
(4)小明将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液.
①锌和硝酸银溶液反应的化学方程式是 .
②若滤液为蓝色,则滤液中一定含有的金属离子是 (写离子符号).
答案解析部分
1.【答案】B
2.【答案】A
3.【答案】D
4.【答案】C
5.【答案】C
6.【答案】D
7.【答案】D
8.【答案】A
9.【答案】B
10.【答案】D
11.【答案】C
12.【答案】D
13.【答案】A;适量的稀盐酸
14.【答案】(1)CH4
(2)加热煮沸
(3)天气闷热,气压低且气温高,氧气在水中溶解度减小,所以鱼要靠近水面游动,以呼吸更多的氧气
(4)可燃物
(5)易
15.【答案】O2;H2O;Fe2O3+6HCl=2FeCl3+3H3O,Fe+2HCl=FeCl2+H2↑
16.【答案】d;a;b;c
17.【答案】延展;Al Zn Fe Cu;Zn+2HCl═ZnCl2+H2↑
18.【答案】铁锅;CH4+2O2CO2+2H2O;一氧化碳;乳化
19.【答案】(1)
(2)溶液质量减轻
(3)在铝的表面上有红色物质生成,溶液由蓝色变为无色
20.【答案】(1)四氧化三铁(或Fe3O4)
(2)
(3)
(4)导热
(5)氧气和水
(6)氢气
(7)
(8)
(9)过氧化氢受热易分解
(10)检查装置气密性
(11)排出装置中的空气,防止空气中的氧气和二氧化碳干扰实验
(12)3;0.56;
21.【答案】(1)金属
(2)O2、H2O
(3)D>C>A>B
(4)ⅰ依题意可得:氢气的质量=342.10g+16.00g﹣357.70g=0.4g;
ii设该合金中锌的质量为x.
Zn+H2SO4 ═ZnSO4+H2↑
65 2
x 0.4g
该合金中锌的质量分数是= =81.25%
答:ⅰ根据质量守恒定律求生成氢气的质量是0.4g;
ⅱ该合金中锌的质量分数为81.25%.
22.【答案】(1)导电性
(2)氧化铝
(3)金属活动性,活动性越强,反应速率越快;金属与酸的接触面,接触面越大,反应越快;酸的浓度,酸的浓度越大,反应越快
(4)Zn+2AgNO3═Zn(NO3)2+2Ag;Zn2+、Cu2+
一、单选题
1.下列物质的转化(“→”表示一种物质转化为另一种物质)中,每次转化只通过一步反应,不可能全部实现的是( )
A.H2O2→O2→CO2→H2CO3 B.NaOH→NaNO3→Na2CO3→NaCl
C.CaCO3→CaO→Ca(OH)2→KOH D.Mg→H2→HCl→AlCl3
2.下列有关金属性质的说法错误的是( )
A.常温下所有金属都是银白色的固体
B.在空气中灼烧铜丝,其表面会变黑
C.铜、银等金属具有良好的导电性
D.埋在潮湿、疏松、透气的酸性土壤中的铸铁管容易被腐蚀
3.从化学角度看,下列叙述不正确的是( )
A.厨房煤气泄漏应立即关闭阀门并打开门窗
B.扑灭图书档案火灾最适宜用液态二氧化碳灭火器
C.在铵态氮肥中加入熟石灰研磨可以闻到刺激性气味
D.常用钢丝球擦洗铝壶可以使其光亮洁净和更加耐用
4.下列图象不能正确反映其对应操作的是()
A B C D
在一定量的Na2CO3溶液中逐滴加入Ca(OH)2溶液 等质量的Zn和Mg分别与等质量、等质量分数的稀硫酸(足量)反应 向NaOH溶液中逐滴加入稀盐酸 向一定量硫酸和硫酸铜混合溶液中逐滴滴加氢氧化钠溶液
A.A B.B
C.C D.D
5.下列各选项与如图所示曲线相符的是( )
选项 横 坐 标 纵 坐 标
A 向一定量稀硫酸中加入锌粉的质量 溶液中氢元素的质量
B 向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量 产生气体的质量
C 向一定量的澄清石灰水中加入碳酸钠溶液的质量 生成沉淀的质量
D 在一定温度下,向一定量的不饱和硝酸钾溶液中加入硝酸钾固体的质量 溶液中溶质的质量分数
A.A B.B C.C D.D
6.下列叙述与对应的示意图表示正确的是( )
A B C D
向一定量的硫酸铜溶液中加铁粉 向一定量pH=2的盐 酸中逐滴加水稀释 电解一定质量的水 等质量的锌、铁与足量等浓度稀硫酸反应
A.A B.B C.C D.D
7.与以下四个变化过程对应的四个图象中,不正确的是( )
A.一定量的饱和石灰水中加入一定量的氧化钙,溶液质量与加入后时间的关系
B.向pH=1的溶液中加水
C.相等质量的锌铁与足量同等条件的稀硫酸反应
D.t℃时,在一定量的氯化钠不饱和溶液中不断加入氯化钠固体
8.金属钛有银白色金属光泽,密度为4.5gcm-3,熔点为1725℃,具有良好的延展性和耐腐蚀性。下列物品不能用钛制作的是( )
A.保险丝 B.医疗器械 C.潜艇外壳 D.眼镜架
9.据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应情性,可替代黄金做精密电子元器件,下列对该铜纳米颗粒的判断,正确的是( )
A.能与盐酸反应产生氢气 B.具有良好的导电性
C.能与硫酸亚铁发生反应 D.在空气中容易锈蚀
10.下列图象与对应的叙述相符合的是( )
A.等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
B.向H2SO4和MgSO4的混合溶液中滴加NaOH溶液
C.向pH=13的氢氧化钠溶液中不断加水稀释
D.化学反应中,原子总数随时间的变化
11.化学是以实验为基础的学科,下列有关实验现象的描述中,正确的是( )
A.硫粉在空气中燃烧产生明亮的蓝紫色火焰
B.电解水实验中正极与负极产生的气体体积比是1:8
C.氧气还原铜丝表面的氧化铜,铜丝表面由黑色变红色
D.将铁钉浸到硫酸铜溶液中,铁钉表面会有红色固体生成,溶液变成无色
12.往AgNO3和Cu(NO3)2的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生,根据上述现象分析,你认为下面结论错误的是( )
A.滤渣中一定有镁粉 B.滤渣中一定有铜和银
C.滤液中一定有Mg2+ D.滤液中一定有Ag+和Cu2+
二、填空题
13.除去下列各物质中混有的少量杂质,所用试剂正确的是
序号 物质 杂质 所用试剂
A N2 O2 灼热的铜网
B CO2 H2O 碱石灰
C CaO CaCO3 适量的稀盐酸
D NaCl溶液 Na2CO3
14.近年来,广西开展“美丽广西,清洁乡村”行动,环境质量得到大大改善.请根据所学知识回答下列问题:
(1)政府鼓励并支持乡村使用沼气作为燃料,沼气的主要成分是 (填化学式);
(2)村里的生活用水大多是硬水,将硬水软化常用的方法是 ;
(3)天气闷热时,村里鱼塘的鱼总是接近水面游动是由于 ;
(4)农村中长期堆放的干草易引起火灾.从燃烧条件分析“干草”是 ;
(5)2014年百色“农博会”上有一种在塑料中添加土豆淀粉制成的“土豆农膜”. 村民种植农作物使用土豆农膜比普通塑料农膜 (填“难”或“易”)降解.
15.铁制品生锈的条件是与 (填写化学式)接触,工业上常用稀盐酸除去铁锈,反应的化学方程式是 ;如果把铁制品长时间浸泡在盐酸中,还会发生的反应方程式为 。
16.物质的性质决定了物质的用途,请在右栏中找出能正确说明左栏物质用途的相应性质,并用线段一对一连接起来.
A.用干冰作制冷剂 a.常温下化学性质稳定
B.在食品袋中充氮气 b.有助燃性
C.氧气用于火箭发射 c.能和铁发生反应
D.硫酸铜用于湿法冶金 d.易升华吸收大量的热
17.铁、铜、铝、锌是生产生活中常用的金属.
(1)铝能制成铝箔是因为铝具有良好的 性;
(2)在金属活动性顺序中,铁、铜、铝、锌由强到弱排列的顺序是 (填元素符号)
(3)任写出一个稀盐酸能与上述金属能发生反应的化学方程式 .
18.学习化学知识的目的之一是分析和解决实际问题.
(1)在日常生活中,厨房常用的由金属材料制成的物品有 (写出一种).
(2)沼气与天然气的主要成分都是甲烷,其完全燃烧的化学方程式为 .
(3)吸烟有害健康.香烟烟气中含有几百种对人体有害的物质,如尼古丁、焦油、一氧化碳等,其中与血红蛋白结合能力强的有毒气体是 .
(4)用洗涤剂清洗油污,是利用了洗涤剂的 作用.
三、综合题
19.已知:铝能与氢氧化钠溶液反应,生成偏铝酸钠(NaAlO2) 和氢气;铁、铜不能与氢氧化钠溶液反应。把上述三种金属样品分别编号为X、Y、Z,若把X、Y、Z分别放入稀硫酸中,则X、Y溶解,Z不溶解,另取X、Y分别放入氢氧化钠溶液中,Y不溶解,X溶解,请回答:
(1)写出铝与氢氧化钠溶液反应的化学方程式。
(2)Y与硝酸银溶液反应后溶液质量如何变化
(3)描述X与Z的硫酸盐溶液反应的现象。
20.铁及其化合物在生产生活有广泛的应用。
(1)一、铁的相关知识
磁铁矿是早期司南(如图)的材料,磁铁矿中所含铁的氧化物主要是 。
(2)西汉有“曾青得铁化为铜”之说,用化学方程式表示其原理 。
(3)某钢中含有少量Mn。MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(4)用铁锅加热食物,说明铁具良好的有 性。
(5)铁锈主要成分是Fe2O3·nH2O,铁生锈主要与空气中的 有关。
(6)二、废铁屑的利用
草酸铁钾晶体[K3Fe(C2O4)3·xH2O]是一种光敏材料。用废铁屑(主要成分为Fe,含少量Fe2O3)制备该晶体主要流程如下:
“酸溶”时,产生的气体X为 。
(7)“转化1”中加入铁粉是将+3价的铁转化为+2价的铁,该反应的化学方程式为 。
(8)“转化2”反应生成FeC2O4·nH2O的化学方程式是 。
(9)“转化3”需控制一定的温度,但温度不能太高的原因是 。
(10)三、草酸铁钾晶体的实验
称取9.82g草酸铁钾晶体,用下图装置进行热分解实验。
【资料】①Mr[K3Fe(C2O4)3]=437
②草酸铁钾晶体在110℃时失去全部结晶水,230℃时完全分解生成K2CO3、Fe、FeO、CO、CO2。
连接好装置后,要先 。
(11)控制温度对A中固体加热,加热前后及过程中均需通入N2。当加热到110℃后,通入N2的目的是防止倒吸和 。
(12)数据处理:测得B、C装置在不同温度下的质量,如下表所示。230℃反应结束后,A中剩余固体5.42g。
温度/℃ 室温 110 230
B装置/g 200.00 201.08 201.08
C装置/g 200.00 200.00 202.20
计算:①x= 。
②5.42g剩余固体中单质Fe的质量为 g。
③上述K3Fe(C2O4)3热分解的化学方程式 。
21.金属材料与人类的生产和生活密切相关.
2015年5月12日,海西高速公路网的重要组成部分:福建省最长跨海大桥﹣泉州湾大桥正式通车.大桥的建设及通行涉及到许多的化学知识.
(1)制造大桥护栏和斜拉索等重要器件的材料都是钢,钢属于 (选填“金属”或“无机非金属”)材料.
(2)工人给大桥钢铁器件喷上油漆,目的是为了防止铁与 发生反应而生锈.
(3)A,B,C,D四中金属单质,A能从B的化合物溶液中置换出B,但A不能与稀盐酸反应.相同条件下,C,D能与稀盐酸反应产生氢气,且D比C反应剧烈.则四种金属的活动性由强到弱的顺序是: .
(4)锌铜合金中是铜合金中的一种,用途较为广泛.为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4═ZnSO4+H2↑.多次实验后,取平均值所得数据如表:
反应前 充分反应后装置及反应剩余物质质量
装置和足量的稀硫酸质量 锌铜合金质量
342.10g 16.00g 357.70g
若不考虑干燥剂吸收空气中的水蒸气,计算:
ⅰ根据质量守恒定律求生成氢气的质量是多少g?
ⅱ该合金中锌的质量分数是多少?(请写出计算过程)
22.金属在日常生活,工农业生产和科学研究方面应用广泛.
(1)铜可用来制作导线,是因为其具有良好的延展性和 .
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是 .
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a: b: c:
(4)小明将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液.
①锌和硝酸银溶液反应的化学方程式是 .
②若滤液为蓝色,则滤液中一定含有的金属离子是 (写离子符号).
答案解析部分
1.【答案】B
2.【答案】A
3.【答案】D
4.【答案】C
5.【答案】C
6.【答案】D
7.【答案】D
8.【答案】A
9.【答案】B
10.【答案】D
11.【答案】C
12.【答案】D
13.【答案】A;适量的稀盐酸
14.【答案】(1)CH4
(2)加热煮沸
(3)天气闷热,气压低且气温高,氧气在水中溶解度减小,所以鱼要靠近水面游动,以呼吸更多的氧气
(4)可燃物
(5)易
15.【答案】O2;H2O;Fe2O3+6HCl=2FeCl3+3H3O,Fe+2HCl=FeCl2+H2↑
16.【答案】d;a;b;c
17.【答案】延展;Al Zn Fe Cu;Zn+2HCl═ZnCl2+H2↑
18.【答案】铁锅;CH4+2O2CO2+2H2O;一氧化碳;乳化
19.【答案】(1)
(2)溶液质量减轻
(3)在铝的表面上有红色物质生成,溶液由蓝色变为无色
20.【答案】(1)四氧化三铁(或Fe3O4)
(2)
(3)
(4)导热
(5)氧气和水
(6)氢气
(7)
(8)
(9)过氧化氢受热易分解
(10)检查装置气密性
(11)排出装置中的空气,防止空气中的氧气和二氧化碳干扰实验
(12)3;0.56;
21.【答案】(1)金属
(2)O2、H2O
(3)D>C>A>B
(4)ⅰ依题意可得:氢气的质量=342.10g+16.00g﹣357.70g=0.4g;
ii设该合金中锌的质量为x.
Zn+H2SO4 ═ZnSO4+H2↑
65 2
x 0.4g
该合金中锌的质量分数是= =81.25%
答:ⅰ根据质量守恒定律求生成氢气的质量是0.4g;
ⅱ该合金中锌的质量分数为81.25%.
22.【答案】(1)导电性
(2)氧化铝
(3)金属活动性,活动性越强,反应速率越快;金属与酸的接触面,接触面越大,反应越快;酸的浓度,酸的浓度越大,反应越快
(4)Zn+2AgNO3═Zn(NO3)2+2Ag;Zn2+、Cu2+
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
