第一节 反应热 课时2 热化学方程式 课件(共14张PPT)
文档属性
| 名称 | 第一节 反应热 课时2 热化学方程式 课件(共14张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 849.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-26 18:12:27 | ||
图片预览





文档简介
(共14张PPT)
课时2
热化学方程式
第一节 反应热
01
学习目标
CONTENT
热化学方程式的定义及意义
02
热化学方程式的应用
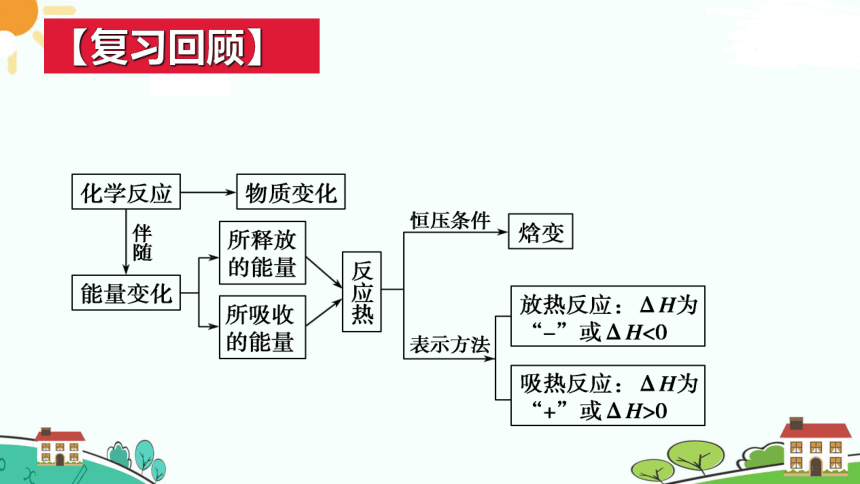
【复习回顾】
【课程引入】
化学反应中的物质变化
没能表明反应中的能量变化
我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?
化学方程式可以表明什么?
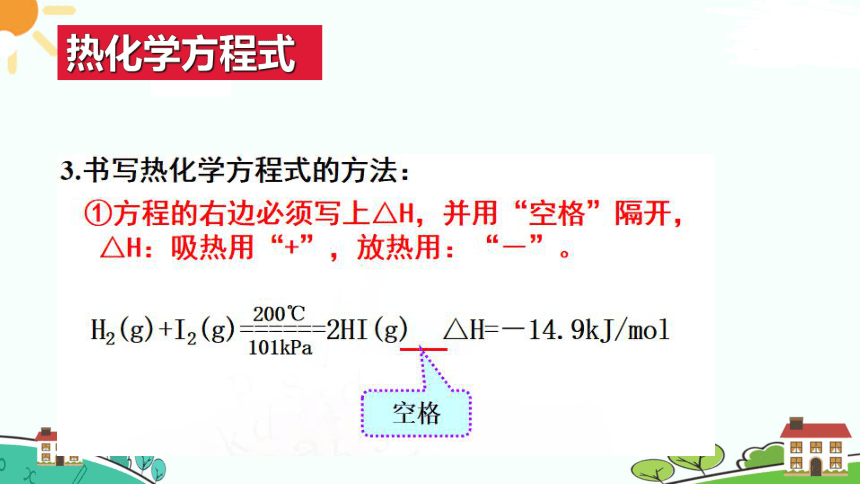
热化学方程式
【思考与讨论】
热化学方程式
热化学方程式
热化学方程式
热化学方程式
热化学方程式
【课堂练习】
(2)
1. 25℃ (1.01×105)Pa下,4g CO在氧气中燃烧
CO2,放出 9. 6kJ热量,写出CO燃烧的
(1)反应方程式;
(2)热化学反应方程式。
2CO (g) + O2 (g) === 2CO2 (g) △H =134.4 kJ/mol
解: (1) 2CO + O2 === 2CO2
2、在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2(g) + O2 (g) = 2H2O (l) H= – 572 kJ/mol
C3H8(g) +5O2(g)= 3CO2 (g) +4H2O (l) H= – 2 220kJ/mol
5mol 氢气和丙烷的混合气完全燃烧时放热3 847kJ,则氢气和甲烷的体积比为( )
A. 1:3 B. 3:1 C. 1:4 D. 1:1
B
【课堂练习】
3、已知
(1)H2(g)+1/2O2 (g) = H2O (g) ΔH1 = a kJ/mol
(2)2H2(g)+O2 (g) =2H2O (g) ΔH2 = b kJ/mol
(3) H2(g)+1/2O2 (g) = H2O (l) ΔH3 = c kJ/mol
(4) 2H2(g)+O2 (g) =2H2O (l) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是( )
A、ad>0
C、2a=b< 0 D、2c=d>0
C
【课堂练习】
课时2
热化学方程式
第一节 反应热
01
学习目标
CONTENT
热化学方程式的定义及意义
02
热化学方程式的应用
【复习回顾】
【课程引入】
化学反应中的物质变化
没能表明反应中的能量变化
我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?
化学方程式可以表明什么?
热化学方程式
【思考与讨论】
热化学方程式
热化学方程式
热化学方程式
热化学方程式
热化学方程式
【课堂练习】
(2)
1. 25℃ (1.01×105)Pa下,4g CO在氧气中燃烧
CO2,放出 9. 6kJ热量,写出CO燃烧的
(1)反应方程式;
(2)热化学反应方程式。
2CO (g) + O2 (g) === 2CO2 (g) △H =134.4 kJ/mol
解: (1) 2CO + O2 === 2CO2
2、在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2(g) + O2 (g) = 2H2O (l) H= – 572 kJ/mol
C3H8(g) +5O2(g)= 3CO2 (g) +4H2O (l) H= – 2 220kJ/mol
5mol 氢气和丙烷的混合气完全燃烧时放热3 847kJ,则氢气和甲烷的体积比为( )
A. 1:3 B. 3:1 C. 1:4 D. 1:1
B
【课堂练习】
3、已知
(1)H2(g)+1/2O2 (g) = H2O (g) ΔH1 = a kJ/mol
(2)2H2(g)+O2 (g) =2H2O (g) ΔH2 = b kJ/mol
(3) H2(g)+1/2O2 (g) = H2O (l) ΔH3 = c kJ/mol
(4) 2H2(g)+O2 (g) =2H2O (l) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是( )
A、a
C、2a=b< 0 D、2c=d>0
C
【课堂练习】
