2022-2023学年人教版九年级化学下册 第九单元考点解读(解析版)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 第九单元考点解读(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 239.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-25 22:09:08 | ||
图片预览



文档简介
第九单元考点解读
例1 把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
例2 下列有关溶液的说法正确的是( )
A.将植物油加入水中搅拌,可得到溶液
B.溶液一定是无色透明的液体
C.蔗糖溶液中,蔗糖是溶质,水是溶剂
D.饱和溶液中一定不能再溶解其他物质
例3 下列物质溶解或稀释过程中,溶液温度没有明显改变的是( )
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
例4 (2019 青岛)下列与洗涤有关的做法不合理的是( )
A.用洗洁精洗去餐具上的油污
B.用汽油洗去沾在衣服上的油渍
C.用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D.用纯碱溶液洗去铁制品表面的铁锈
例5 (2019 温州)如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是 ( )
A.砂糖水颜色很深
B.砂糖水味道很甜
C.砂糖溶解得很快
D.砂糖固体有剩余
例6 20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl-个数一定相等
C.溶液质量为100克
D.溶质与溶剂质量比为9﹕25
例7 a、b两物质的溶解度曲线如右图所示。下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.在t1℃时,a、b两物质饱和溶液的溶质质量分数相等
C.a、b两物质的溶液从t2℃降温至t1℃一定有晶体析出
D.在t2℃时,60g a物质与100g水充分混合后所得溶液的总质量为160g
例8 配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)写出图中标号 a 仪器的名称:_______。
(2)配制 50g 质量分数为 15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠_______g,水_______g。
(3)称量氯化钠时,氯化钠应放在托盘天平的_______盘。(填“左”或“右”)
(4)溶解过程中玻璃棒的作用是_______。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有_______。(填序号)
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
(6)把 50g 质量分数为 15%的氯化钠溶液稀释成 5%的氯化钠溶液,需要水的质量是_______g。
例9 向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示,请根据关系图分析并计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
例10把少量下列物质分别放入水中,充分搅拌,可以形成溶液的是( )
A.碘 B.汽油 C.高锰酸钾 D.面粉
例11 溶液与人们的生活息息相关。下列有关溶液说法正确的是( )
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t℃时的不饱和溶液
例12 取某固体物质5g加入20mL水中,测得溶液的温度随时间变化曲线如右图所示。该固体物质可能是( )
A.NaCl
B.NaOH
C.NH4NO3
D.CaCO3
例13 下列液体去除油污效果最好的是( )
A.洗洁精 B.食盐水 C.白醋 D.自来水
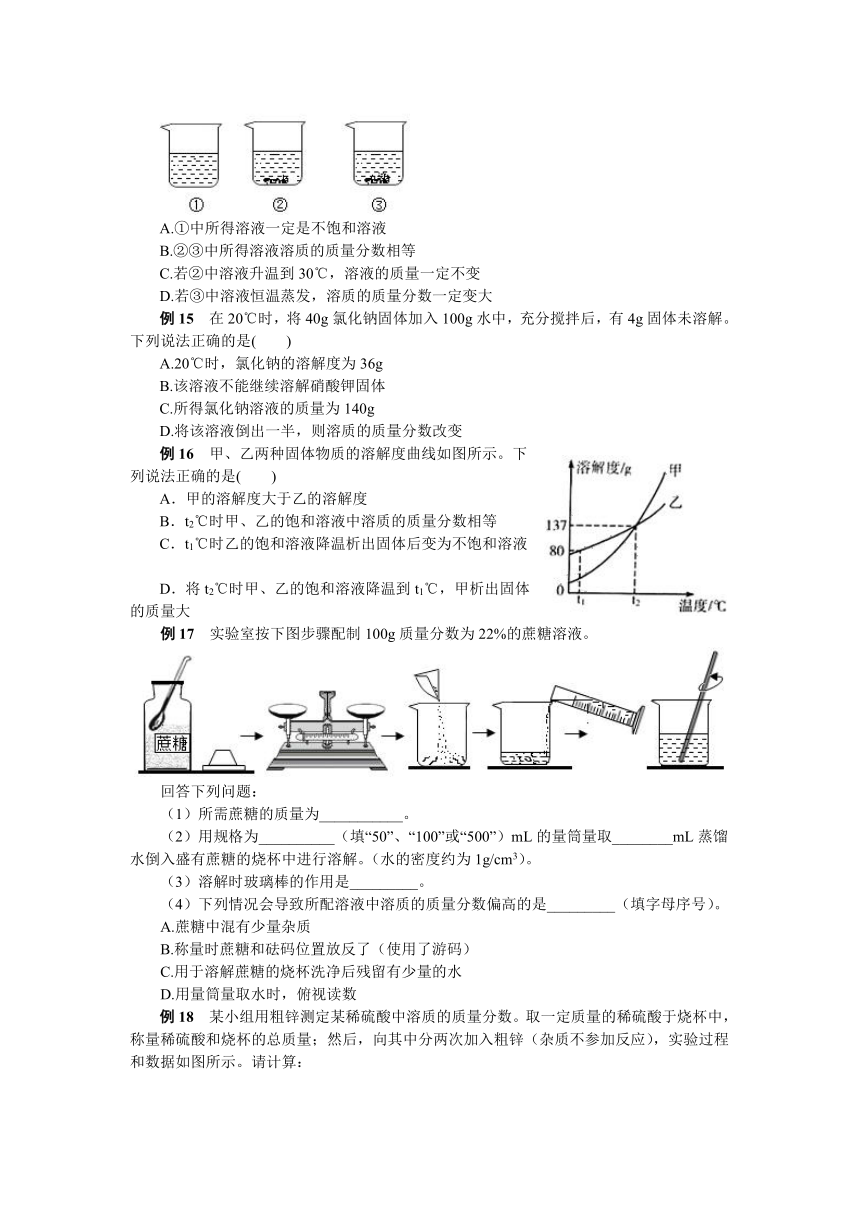
例14 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( )
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30℃,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
例15 在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是( )
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
例16 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.t2℃时甲、乙的饱和溶液中溶质的质量分数相等
C.t1℃时乙的饱和溶液降温析出固体后变为不饱和溶液
D.将t2℃时甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大
例17 实验室按下图步骤配制100g质量分数为22%的蔗糖溶液。
回答下列问题:
(1)所需蔗糖的质量为___________。
(2)用规格为__________(填“50”、“100”或“500”)mL的量筒量取________mL蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1g/cm3)。
(3)溶解时玻璃棒的作用是_________。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是_________(填字母序号)。
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
D.用量筒量取水时,俯视读数
例18 某小组用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
答案和解析
例1 把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
解析 溶液是均一、稳定的混合物。面粉不溶于水,与水混合形成悬浊液;牛奶、植物油也不溶于水,与水混合形成乳浊液;蔗糖易溶于水,放入水中能形成均一、稳定的混合物,因此能形成溶液。
答案 C
例2 下列有关溶液的说法正确的是( )
A.将植物油加入水中搅拌,可得到溶液
B.溶液一定是无色透明的液体
C.蔗糖溶液中,蔗糖是溶质,水是溶剂
D.饱和溶液中一定不能再溶解其他物质
解析 植物油难溶于水,将植物油加入水中搅拌,不能得到溶液,A错误。溶液是均一、稳定的混合物,溶液不一定是无色透明的液体,如硫酸铜溶液是蓝色的,B错误。饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,饱和溶液中还能再溶解其他物质,D错误。
答案 C
例3 下列物质溶解或稀释过程中,溶液温度没有明显改变的是( )
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
解析 氢氧化钠固体、浓硫酸溶于水,都放出热量,会使溶液的温度升高;硝酸铵溶于水,吸收热量,会使溶液的温度降低;氯化钠溶于水既不吸热也不放热,温度基本保持不变。
答案 D
例4 (2019 青岛)下列与洗涤有关的做法不合理的是( )
A.用洗洁精洗去餐具上的油污
B.用汽油洗去沾在衣服上的油渍
C.用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D.用纯碱溶液洗去铁制品表面的铁锈
解析 洗洁精含有乳化剂,能乳化餐具上的油污;汽油能溶解油污;白醋中的醋酸能与水垢中的碳酸钙、氢氧化镁反应而除去水垢;铁锈的主要成分是氧化铁,并不能与纯碱反应。
答案 D
例5 (2019 温州)如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是 ( )
A.砂糖水颜色很深
B.砂糖水味道很甜
C.砂糖溶解得很快
D.砂糖固体有剩余
解析 将红砂糖倒入一杯开水中,充分溶解,如果砂糖固体有剩余,说明此时的溶液再也不能溶解砂糖,即这时的砂糖水是饱和溶液。
答案 D
例6 20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl-个数一定相等
C.溶液质量为100克
D.溶质与溶剂质量比为9﹕25
解析 20℃时氯化钠的溶解度为36克 ,即100克水中最多溶解36克氯化钠,所以 把36克氯化钠放入64克水中,氯化钠不能全部溶解,所得溶液为饱和溶液,A正确;氯化钠中钠离子和氯离子个数比为1﹕1,则溶液中钠离子和氯离子个数一定相等,B正确;氯化钠不能全部溶解,所得溶液质量小于100克,C错误;溶液为饱和溶液,所以溶质与溶剂质量比为36﹕100=9﹕25,D正确。
答案 C
例7 a、b两物质的溶解度曲线如右图所示。下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.在t1℃时,a、b两物质饱和溶液的溶质质量分数相等
C.a、b两物质的溶液从t2℃降温至t1℃一定有晶体析出
D.在t2℃时,60g a物质与100g水充分混合后所得溶液的总质量为160g
解析 判断不同物质的溶解度大小,需在同一温度下进行比较,不在同一温度下无法比较物质的溶解度大小,A错误。t1℃时,a、b两物质的溶解度相等,在该温度下的两物质的饱和溶液中溶质的质量分数相等,B正确。由于无法确定a、b两物质的溶液是否达到饱和状态也就无法确定二者降温后是否有晶体析出,C错误。t2℃时,a物质的溶解度是50g,在该温度下,100g水中最多溶解a物质的质量是50g,因此,在该温度下,60ga物质与100g水充分混合所得溶液的质量为150g,D错误。
答案 B
例8 配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)写出图中标号 a 仪器的名称:_______。
(2)配制 50g 质量分数为 15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠_______g,水_______g。
(3)称量氯化钠时,氯化钠应放在托盘天平的_______盘。(填“左”或“右”)
(4)溶解过程中玻璃棒的作用是_______。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有_______。(填序号)
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
(6)把 50g 质量分数为 15%的氯化钠溶液稀释成 5%的氯化钠溶液,需要水的质量是_______g。
解析 (1)由图示可知,标号a仪器的名称是量筒。(2)配制50g质量分数为15%的氯化钠溶液,需要氯化钠:50g×15%=7.5g,水:50g-7.5g=42.5g。(3)称量氯化钠时,氯化钠应放在托盘天平的左盘。(4)溶解过程中玻璃棒的作用是搅拌,加快溶解的速率。(5)称量时,药品与砝码放反了 称取食盐的质量偏少,会使溶质质量分数偏小;量取水的体积时,仰视读数,量取的水偏多,会使溶质质量分数偏小;装瓶时,有少量溶液洒出,不会影响溶质的质量分数。(6)设需要水的质量是x,50g×15%=(50g+x)×5%,解得x=100g。
答案 (1)量筒 (2)7.5g 42.5g (3)左 (4)搅拌,加快溶解的速率 (5)AB (6)100
例9 向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示,请根据关系图分析并计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
解析 (1)由图像可知,铁粉反应完时,产生的氢气的质量为0.08g。
(2)设10g稀硫酸溶液中溶质的质量为x。
Fe+H2SO4=FeSO4+H2↑
98 2
x 0.04g
解得x=1.96g
稀硫酸溶液的溶质质量分数==19.6%
答案 (1)0.08 (2)19.6%
例10把少量下列物质分别放入水中,充分搅拌,可以形成溶液的是( )
A.碘 B.汽油 C.高锰酸钾 D.面粉
解析 溶液是均一、稳定的混合物。碘、面粉均不溶于水,与水混合形成悬浊液;汽油也不溶于水,与水混合形成乳浊液;高锰酸钾易溶于水,放入水中能形成均一、稳定的混合物,因此能形成溶液。
答案 C
例11 溶液与人们的生活息息相关。下列有关溶液说法正确的是( )
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t℃时的不饱和溶液
解析 气体、液体和固体都可以作溶质,A正确;汽油难溶于水,将汽油与水充分混合,不能形成溶液,B错误;将10%的某溶液倒出一半,剩余溶液中溶质的质量分数仍为10%,C错误;某饱和溶液降温到t℃析出晶体后,析出晶体后的溶液不能继续溶解该溶质,得到的溶液是t℃时的饱和溶液,D错误。
答案 A
例12 取某固体物质5g加入20mL水中,测得溶液的温度随时间变化曲线如右图所示。该固体物质可能是( )
A.NaCl
B.NaOH
C.NH4NO3
D.CaCO3
解析 氯化钠溶于水既不吸热也不放热,温度基本保持不变;氢氧化钠固体溶于水,放出热量,会使溶液的温度升高;硝酸铵溶于水,吸收热量,会使溶液的温度降低;碳酸钙不溶于水。根据图像可知,该固体物质溶于水,溶液的温度明显降低,可能是硝酸铵。
答案 C
例13 下列液体去除油污效果最好的是( )
A.洗洁精 B.食盐水 C.白醋 D.自来水
解析 洗衣洁精具有乳化作用,能将大的油滴分散成小的油滴随水冲走,去除油污的效果较好;油污不能与食盐水反应,食盐水不能去除油污;白醋不能与油污反应,白醋不能去除油污;油污难溶于水,用自来水不能去除油污。
答案 A
例14 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( )
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30℃,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
解析 依据饱和溶液的概念可知,②、③中有固体出现,一定是饱和溶液,①中没有固体出现,可能是恰好溶解,则可能是饱和溶液,A错误;②③溶液都是相同温度下的饱和溶液,所以溶液的溶质质量分数一定相等,B正确;烧杯②中溶液升温至30℃,固体继续溶解,溶液的质量一定变大,C错误;恒温蒸发溶剂,饱和溶液析出晶体,但溶液仍为饱和溶液,相同温度下的同种物质的饱和溶液溶质质量分数因溶解度相等而相等,溶质质量分数不变,D错误。
答案 B
例15 在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是( )
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
解析 20℃时,40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解,说明此时的溶液为饱和溶液,则溶解的氯化钠质量为40g-4g=36g,因此20℃时,氯化钠的溶解度为36g,A正确;此时的溶液仅为氯化钠的饱和溶液,仍可继续溶解硝酸钾,B错误;此时的溶液为饱和溶液,多余的4g未溶解的氯化钠不能酸溶液,因此溶液质量为100g+40g-4g=136g,C错误;将此时溶液倒出一半后,所余溶液仍是饱和溶液,温度溶剂均为变,因此溶质质量分数未变,D错误。
答案 A
例16 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.t2℃时甲、乙的饱和溶液中溶质的质量分数相等
C.t1℃时乙的饱和溶液降温析出固体后变为不饱和溶液
D.将t2℃时甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大
【解析】比较两种物质的溶解度大小,必须指明相同温度,A错误;饱和溶液中溶质质量分数=×100%,t2℃时甲、乙的溶解度相等,则t2℃时饱和溶液中溶质的质量分数相等,B正确;乙的溶解度随着温度的降低而减小,t1℃时乙的饱和溶液降温析出固体后,仍为饱和溶液,C错误;D没有指明溶液的质量,将t2℃时甲、乙的饱和溶液降温到t1℃,无法比较析出固体的质量大小,错误。
【答案】B
例17 实验室按下图步骤配制100g质量分数为22%的蔗糖溶液。
回答下列问题:
(1)所需蔗糖的质量为___________。
(2)用规格为__________(填“50”、“100”或“500”)mL的量筒量取________mL蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1g/cm3)。
(3)溶解时玻璃棒的作用是_________。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是_________(填字母序号)。
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
D.用量筒量取水时,俯视读数
解析 (1)所需蔗糖质量为100g×22%=22g,水的质量为100g-22g=78g,则水的体积为78g÷1g/mL=78mL。(2)需要水的体积为78mL,故应该选用规格为100mL的量筒。(3)溶解时玻璃棒的作用是搅拌,加速溶解。(4)蔗糖中混有少量杂质,则所称量的蔗糖偏少,溶质质量分数偏低,A不符合题意;称量时蔗糖和砝码位置放反了(使用了游码),则所称量的蔗糖质量偏少,溶质质量分数偏低,B不符合题意;用于溶解蔗糖的烧杯洗净后残留有少量的水,会造成溶剂的量偏多,溶质质量分数偏低,C不符合题意;用量筒量取水时,俯视读数,则量取的水的体积偏少,溶剂的量偏少,溶质质量分数偏高,D符合题意。
答案 (1)22g (2)100 78 (3)搅拌,加速溶解 (4)D
例18 某小组用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
解析 (1)根据质量守恒定律,反应产生氢气的质量=205.6g+8g+2g-215.4g=0.2g。
(2)设稀硫酸中溶质的质量分数为x,加入稀硫酸的质量为205.6g-105.6g=100g。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2g
98:2=x:0.2g
x=9.8g
稀硫酸中溶质的质量分数为9.8g/100g×100%=9.8%
答案 (1)0.2g (2)9.8%
例1 把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
例2 下列有关溶液的说法正确的是( )
A.将植物油加入水中搅拌,可得到溶液
B.溶液一定是无色透明的液体
C.蔗糖溶液中,蔗糖是溶质,水是溶剂
D.饱和溶液中一定不能再溶解其他物质
例3 下列物质溶解或稀释过程中,溶液温度没有明显改变的是( )
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
例4 (2019 青岛)下列与洗涤有关的做法不合理的是( )
A.用洗洁精洗去餐具上的油污
B.用汽油洗去沾在衣服上的油渍
C.用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D.用纯碱溶液洗去铁制品表面的铁锈
例5 (2019 温州)如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是 ( )
A.砂糖水颜色很深
B.砂糖水味道很甜
C.砂糖溶解得很快
D.砂糖固体有剩余
例6 20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl-个数一定相等
C.溶液质量为100克
D.溶质与溶剂质量比为9﹕25
例7 a、b两物质的溶解度曲线如右图所示。下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.在t1℃时,a、b两物质饱和溶液的溶质质量分数相等
C.a、b两物质的溶液从t2℃降温至t1℃一定有晶体析出
D.在t2℃时,60g a物质与100g水充分混合后所得溶液的总质量为160g
例8 配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)写出图中标号 a 仪器的名称:_______。
(2)配制 50g 质量分数为 15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠_______g,水_______g。
(3)称量氯化钠时,氯化钠应放在托盘天平的_______盘。(填“左”或“右”)
(4)溶解过程中玻璃棒的作用是_______。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有_______。(填序号)
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
(6)把 50g 质量分数为 15%的氯化钠溶液稀释成 5%的氯化钠溶液,需要水的质量是_______g。
例9 向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示,请根据关系图分析并计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
例10把少量下列物质分别放入水中,充分搅拌,可以形成溶液的是( )
A.碘 B.汽油 C.高锰酸钾 D.面粉
例11 溶液与人们的生活息息相关。下列有关溶液说法正确的是( )
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t℃时的不饱和溶液
例12 取某固体物质5g加入20mL水中,测得溶液的温度随时间变化曲线如右图所示。该固体物质可能是( )
A.NaCl
B.NaOH
C.NH4NO3
D.CaCO3
例13 下列液体去除油污效果最好的是( )
A.洗洁精 B.食盐水 C.白醋 D.自来水
例14 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( )
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30℃,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
例15 在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是( )
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
例16 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.t2℃时甲、乙的饱和溶液中溶质的质量分数相等
C.t1℃时乙的饱和溶液降温析出固体后变为不饱和溶液
D.将t2℃时甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大
例17 实验室按下图步骤配制100g质量分数为22%的蔗糖溶液。
回答下列问题:
(1)所需蔗糖的质量为___________。
(2)用规格为__________(填“50”、“100”或“500”)mL的量筒量取________mL蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1g/cm3)。
(3)溶解时玻璃棒的作用是_________。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是_________(填字母序号)。
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
D.用量筒量取水时,俯视读数
例18 某小组用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
答案和解析
例1 把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
解析 溶液是均一、稳定的混合物。面粉不溶于水,与水混合形成悬浊液;牛奶、植物油也不溶于水,与水混合形成乳浊液;蔗糖易溶于水,放入水中能形成均一、稳定的混合物,因此能形成溶液。
答案 C
例2 下列有关溶液的说法正确的是( )
A.将植物油加入水中搅拌,可得到溶液
B.溶液一定是无色透明的液体
C.蔗糖溶液中,蔗糖是溶质,水是溶剂
D.饱和溶液中一定不能再溶解其他物质
解析 植物油难溶于水,将植物油加入水中搅拌,不能得到溶液,A错误。溶液是均一、稳定的混合物,溶液不一定是无色透明的液体,如硫酸铜溶液是蓝色的,B错误。饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,饱和溶液中还能再溶解其他物质,D错误。
答案 C
例3 下列物质溶解或稀释过程中,溶液温度没有明显改变的是( )
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
解析 氢氧化钠固体、浓硫酸溶于水,都放出热量,会使溶液的温度升高;硝酸铵溶于水,吸收热量,会使溶液的温度降低;氯化钠溶于水既不吸热也不放热,温度基本保持不变。
答案 D
例4 (2019 青岛)下列与洗涤有关的做法不合理的是( )
A.用洗洁精洗去餐具上的油污
B.用汽油洗去沾在衣服上的油渍
C.用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D.用纯碱溶液洗去铁制品表面的铁锈
解析 洗洁精含有乳化剂,能乳化餐具上的油污;汽油能溶解油污;白醋中的醋酸能与水垢中的碳酸钙、氢氧化镁反应而除去水垢;铁锈的主要成分是氧化铁,并不能与纯碱反应。
答案 D
例5 (2019 温州)如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是 ( )
A.砂糖水颜色很深
B.砂糖水味道很甜
C.砂糖溶解得很快
D.砂糖固体有剩余
解析 将红砂糖倒入一杯开水中,充分溶解,如果砂糖固体有剩余,说明此时的溶液再也不能溶解砂糖,即这时的砂糖水是饱和溶液。
答案 D
例6 20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl-个数一定相等
C.溶液质量为100克
D.溶质与溶剂质量比为9﹕25
解析 20℃时氯化钠的溶解度为36克 ,即100克水中最多溶解36克氯化钠,所以 把36克氯化钠放入64克水中,氯化钠不能全部溶解,所得溶液为饱和溶液,A正确;氯化钠中钠离子和氯离子个数比为1﹕1,则溶液中钠离子和氯离子个数一定相等,B正确;氯化钠不能全部溶解,所得溶液质量小于100克,C错误;溶液为饱和溶液,所以溶质与溶剂质量比为36﹕100=9﹕25,D正确。
答案 C
例7 a、b两物质的溶解度曲线如右图所示。下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.在t1℃时,a、b两物质饱和溶液的溶质质量分数相等
C.a、b两物质的溶液从t2℃降温至t1℃一定有晶体析出
D.在t2℃时,60g a物质与100g水充分混合后所得溶液的总质量为160g
解析 判断不同物质的溶解度大小,需在同一温度下进行比较,不在同一温度下无法比较物质的溶解度大小,A错误。t1℃时,a、b两物质的溶解度相等,在该温度下的两物质的饱和溶液中溶质的质量分数相等,B正确。由于无法确定a、b两物质的溶液是否达到饱和状态也就无法确定二者降温后是否有晶体析出,C错误。t2℃时,a物质的溶解度是50g,在该温度下,100g水中最多溶解a物质的质量是50g,因此,在该温度下,60ga物质与100g水充分混合所得溶液的质量为150g,D错误。
答案 B
例8 配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)写出图中标号 a 仪器的名称:_______。
(2)配制 50g 质量分数为 15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠_______g,水_______g。
(3)称量氯化钠时,氯化钠应放在托盘天平的_______盘。(填“左”或“右”)
(4)溶解过程中玻璃棒的作用是_______。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有_______。(填序号)
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
(6)把 50g 质量分数为 15%的氯化钠溶液稀释成 5%的氯化钠溶液,需要水的质量是_______g。
解析 (1)由图示可知,标号a仪器的名称是量筒。(2)配制50g质量分数为15%的氯化钠溶液,需要氯化钠:50g×15%=7.5g,水:50g-7.5g=42.5g。(3)称量氯化钠时,氯化钠应放在托盘天平的左盘。(4)溶解过程中玻璃棒的作用是搅拌,加快溶解的速率。(5)称量时,药品与砝码放反了 称取食盐的质量偏少,会使溶质质量分数偏小;量取水的体积时,仰视读数,量取的水偏多,会使溶质质量分数偏小;装瓶时,有少量溶液洒出,不会影响溶质的质量分数。(6)设需要水的质量是x,50g×15%=(50g+x)×5%,解得x=100g。
答案 (1)量筒 (2)7.5g 42.5g (3)左 (4)搅拌,加快溶解的速率 (5)AB (6)100
例9 向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示,请根据关系图分析并计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
解析 (1)由图像可知,铁粉反应完时,产生的氢气的质量为0.08g。
(2)设10g稀硫酸溶液中溶质的质量为x。
Fe+H2SO4=FeSO4+H2↑
98 2
x 0.04g
解得x=1.96g
稀硫酸溶液的溶质质量分数==19.6%
答案 (1)0.08 (2)19.6%
例10把少量下列物质分别放入水中,充分搅拌,可以形成溶液的是( )
A.碘 B.汽油 C.高锰酸钾 D.面粉
解析 溶液是均一、稳定的混合物。碘、面粉均不溶于水,与水混合形成悬浊液;汽油也不溶于水,与水混合形成乳浊液;高锰酸钾易溶于水,放入水中能形成均一、稳定的混合物,因此能形成溶液。
答案 C
例11 溶液与人们的生活息息相关。下列有关溶液说法正确的是( )
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t℃时的不饱和溶液
解析 气体、液体和固体都可以作溶质,A正确;汽油难溶于水,将汽油与水充分混合,不能形成溶液,B错误;将10%的某溶液倒出一半,剩余溶液中溶质的质量分数仍为10%,C错误;某饱和溶液降温到t℃析出晶体后,析出晶体后的溶液不能继续溶解该溶质,得到的溶液是t℃时的饱和溶液,D错误。
答案 A
例12 取某固体物质5g加入20mL水中,测得溶液的温度随时间变化曲线如右图所示。该固体物质可能是( )
A.NaCl
B.NaOH
C.NH4NO3
D.CaCO3
解析 氯化钠溶于水既不吸热也不放热,温度基本保持不变;氢氧化钠固体溶于水,放出热量,会使溶液的温度升高;硝酸铵溶于水,吸收热量,会使溶液的温度降低;碳酸钙不溶于水。根据图像可知,该固体物质溶于水,溶液的温度明显降低,可能是硝酸铵。
答案 C
例13 下列液体去除油污效果最好的是( )
A.洗洁精 B.食盐水 C.白醋 D.自来水
解析 洗衣洁精具有乳化作用,能将大的油滴分散成小的油滴随水冲走,去除油污的效果较好;油污不能与食盐水反应,食盐水不能去除油污;白醋不能与油污反应,白醋不能去除油污;油污难溶于水,用自来水不能去除油污。
答案 A
例14 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( )
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30℃,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
解析 依据饱和溶液的概念可知,②、③中有固体出现,一定是饱和溶液,①中没有固体出现,可能是恰好溶解,则可能是饱和溶液,A错误;②③溶液都是相同温度下的饱和溶液,所以溶液的溶质质量分数一定相等,B正确;烧杯②中溶液升温至30℃,固体继续溶解,溶液的质量一定变大,C错误;恒温蒸发溶剂,饱和溶液析出晶体,但溶液仍为饱和溶液,相同温度下的同种物质的饱和溶液溶质质量分数因溶解度相等而相等,溶质质量分数不变,D错误。
答案 B
例15 在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是( )
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
解析 20℃时,40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解,说明此时的溶液为饱和溶液,则溶解的氯化钠质量为40g-4g=36g,因此20℃时,氯化钠的溶解度为36g,A正确;此时的溶液仅为氯化钠的饱和溶液,仍可继续溶解硝酸钾,B错误;此时的溶液为饱和溶液,多余的4g未溶解的氯化钠不能酸溶液,因此溶液质量为100g+40g-4g=136g,C错误;将此时溶液倒出一半后,所余溶液仍是饱和溶液,温度溶剂均为变,因此溶质质量分数未变,D错误。
答案 A
例16 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.t2℃时甲、乙的饱和溶液中溶质的质量分数相等
C.t1℃时乙的饱和溶液降温析出固体后变为不饱和溶液
D.将t2℃时甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大
【解析】比较两种物质的溶解度大小,必须指明相同温度,A错误;饱和溶液中溶质质量分数=×100%,t2℃时甲、乙的溶解度相等,则t2℃时饱和溶液中溶质的质量分数相等,B正确;乙的溶解度随着温度的降低而减小,t1℃时乙的饱和溶液降温析出固体后,仍为饱和溶液,C错误;D没有指明溶液的质量,将t2℃时甲、乙的饱和溶液降温到t1℃,无法比较析出固体的质量大小,错误。
【答案】B
例17 实验室按下图步骤配制100g质量分数为22%的蔗糖溶液。
回答下列问题:
(1)所需蔗糖的质量为___________。
(2)用规格为__________(填“50”、“100”或“500”)mL的量筒量取________mL蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1g/cm3)。
(3)溶解时玻璃棒的作用是_________。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是_________(填字母序号)。
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
D.用量筒量取水时,俯视读数
解析 (1)所需蔗糖质量为100g×22%=22g,水的质量为100g-22g=78g,则水的体积为78g÷1g/mL=78mL。(2)需要水的体积为78mL,故应该选用规格为100mL的量筒。(3)溶解时玻璃棒的作用是搅拌,加速溶解。(4)蔗糖中混有少量杂质,则所称量的蔗糖偏少,溶质质量分数偏低,A不符合题意;称量时蔗糖和砝码位置放反了(使用了游码),则所称量的蔗糖质量偏少,溶质质量分数偏低,B不符合题意;用于溶解蔗糖的烧杯洗净后残留有少量的水,会造成溶剂的量偏多,溶质质量分数偏低,C不符合题意;用量筒量取水时,俯视读数,则量取的水的体积偏少,溶剂的量偏少,溶质质量分数偏高,D符合题意。
答案 (1)22g (2)100 78 (3)搅拌,加速溶解 (4)D
例18 某小组用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
解析 (1)根据质量守恒定律,反应产生氢气的质量=205.6g+8g+2g-215.4g=0.2g。
(2)设稀硫酸中溶质的质量分数为x,加入稀硫酸的质量为205.6g-105.6g=100g。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2g
98:2=x:0.2g
x=9.8g
稀硫酸中溶质的质量分数为9.8g/100g×100%=9.8%
答案 (1)0.2g (2)9.8%
同课章节目录
