1.3氧化还原反应课件(共17张PPT)2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应课件(共17张PPT)2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | zip | ||
| 文件大小 | 11.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 10:27:20 | ||
图片预览




文档简介
(共17张PPT)
氧化还原反应
人教版高中化学必修第一册第一章第三节
1
2
学
习
目
标
通过氧化还原反应本质的分析和探究,培养由现象到本质的科学探究意识。
通过分析化学反应中元素化合价的变化,重新认识、理解氧化还原反应的相关概念 ,能正确表示氧化还原反应。培养用发展的眼光、科学的态度、勇于探索化学的品质;
生活中的氧化还原反应
氧化还原反应
1
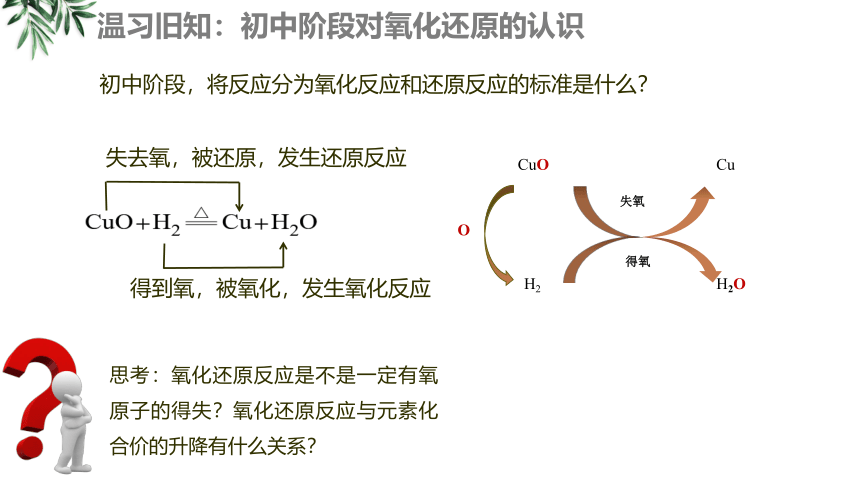
温习旧知:初中阶段对氧化还原的认识
初中阶段,将反应分为氧化反应和还原反应的标准是什么?
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
CuO
Cu
H2
H2O
O
失氧
得氧
思考:氧化还原反应是不是一定有氧原子的得失?氧化还原反应与元素化合价的升降有什么关系?
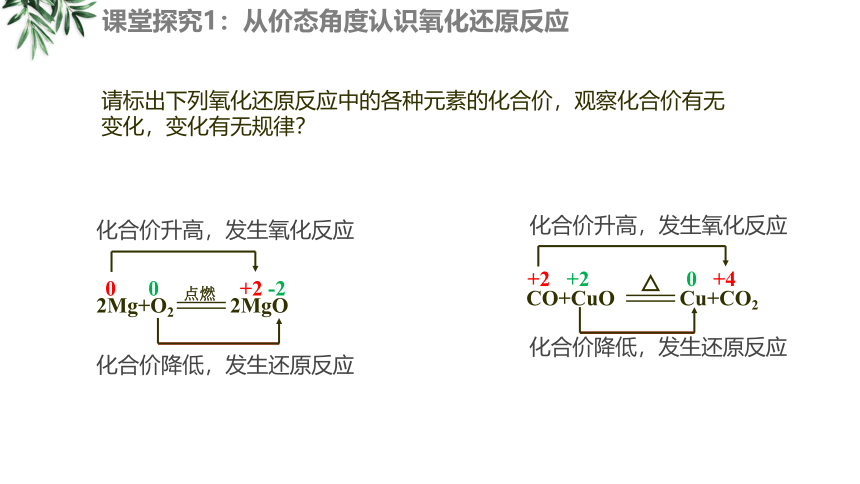
+2 +2 0 +4
化合价升高,发生氧化反应
化合价降低,发生还原反应
CO+CuO Cu+CO2
化合价升高,发生氧化反应
化合价降低,发生还原反应
2Mg+O2 2MgO
点燃
0 0 +2 -2
请标出下列氧化还原反应中的各种元素的化合价,观察化合价有无变化,变化有无规律?
课堂探究1:从价态角度认识氧化还原反应
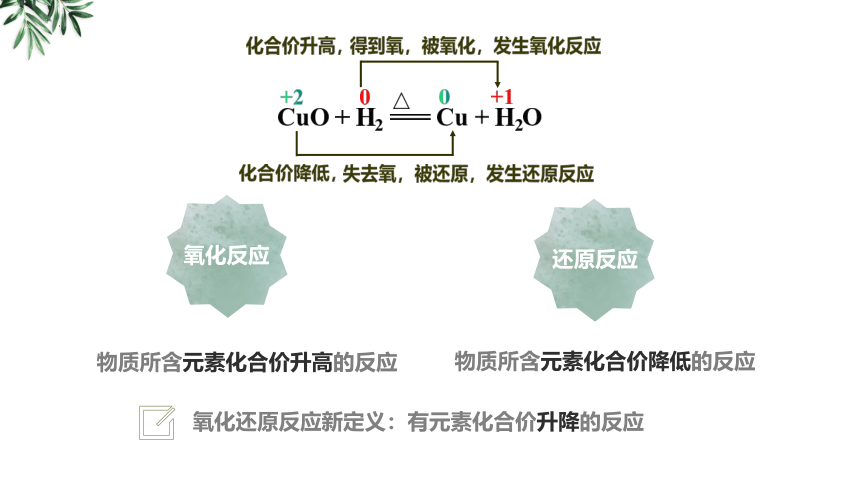
氧化反应
还原反应
物质所含元素化合价升高的反应
物质所含元素化合价降低的反应
CuO + H2 === Cu + H2O
△
+2
0
0
+1
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
化合价升高,
化合价降低,
氧化还原反应新定义:有元素化合价升降的反应
课堂探究2:四种基本反应类型与氧化还原反应之间关系
氧化还原
反应
非氧化还
原反应
化合反应
复分解反应
置换反应
复分解反应
置换反应
分解反应
化合反应
分解反应
化学反应
四种反应类型
说出以下反应的反应类型及判断是否属于氧化还原反应。
四种基本反应类型与氧化还原反应之间关系
化合反应
复分解
反应
置换
反应
分解反应
非氧化还原反应
氧化还原反应
思考讨论:为什么氧化还原反应一定有元素化合价的升降?氧化还原反应的本质是什么?
e-
失e-
得e-
+1
0
-1
+1
化合价
+1
-1
偏离H+
偏向CI-
课堂探究3:氧化还原反应的实质
氧化还原反应的本质:
电子的转移(得失或偏移)
典例一
典例二
典例三
Fe2O3 + 3CO=== 2Fe + CO2
高温
+3
+2
0
+4
得到3e-×2,发生还原反应
失去2e-×3,发生氧化反应
化合价升高,
化合价降低,
H2 + Cl2 === 2HCl
+1
-1
0
0
0
共用电子对偏离,化合价升高,发生氧化反应
2Na + Cl2 ===2NaCl
点燃
+1
0
-1
失去2e-,发生氧化反应
得到2e-,发生还原反应
化合价降低,
化合价升高,
典例剖析:氧化还原反应的表示方法
共用电子对偏向,化合价降低,发生还原反应
氧化剂和还原剂
2
还原剂
在反应时,得到电子(或电子对偏向)的物质是氧化剂
氧化剂
得
e-
化合价降低
在反应时,失去电子(或电子对偏离)的物质是氧化剂
发生还
原反应
化合价升高
发生氧化反应
失e-
Fe2O3 + 3CO=== 2Fe + CO2
高温
6e-
2Na + Cl2 ===2NaCl
点燃
2e-
升、失、氧
降、得、还
课堂探究4:氧化剂和还原剂
课堂小结
有氧得失的反应是氧化还原反应
从得氧、失氧角度分析
1
有元素化合价升降的反应是氧化还原反应
从化合价升降角度分析(宏观视角)
2
本质:有电子转移(得失或偏移)的反应是氧化还原反应
从电子转移角度分析(微观视角)
3
[ 从不同角度认识氧化还原反应 ]
下列反应属于氧化还原反应的是( )
A. CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
B. CaCO3 === CaO + CO2↑
C. Na2O + H2O == 2NaOH
D. Mg + 2HCl == MgCl2 + H2↑
课堂练习
√
2. 用“双线桥”和“单线桥”法标出下列氧化还原反应中电子转移情况,指出反应的氧化剂和还原剂。
氧化还原反应
人教版高中化学必修第一册第一章第三节
1
2
学
习
目
标
通过氧化还原反应本质的分析和探究,培养由现象到本质的科学探究意识。
通过分析化学反应中元素化合价的变化,重新认识、理解氧化还原反应的相关概念 ,能正确表示氧化还原反应。培养用发展的眼光、科学的态度、勇于探索化学的品质;
生活中的氧化还原反应
氧化还原反应
1
温习旧知:初中阶段对氧化还原的认识
初中阶段,将反应分为氧化反应和还原反应的标准是什么?
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
CuO
Cu
H2
H2O
O
失氧
得氧
思考:氧化还原反应是不是一定有氧原子的得失?氧化还原反应与元素化合价的升降有什么关系?
+2 +2 0 +4
化合价升高,发生氧化反应
化合价降低,发生还原反应
CO+CuO Cu+CO2
化合价升高,发生氧化反应
化合价降低,发生还原反应
2Mg+O2 2MgO
点燃
0 0 +2 -2
请标出下列氧化还原反应中的各种元素的化合价,观察化合价有无变化,变化有无规律?
课堂探究1:从价态角度认识氧化还原反应
氧化反应
还原反应
物质所含元素化合价升高的反应
物质所含元素化合价降低的反应
CuO + H2 === Cu + H2O
△
+2
0
0
+1
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
化合价升高,
化合价降低,
氧化还原反应新定义:有元素化合价升降的反应
课堂探究2:四种基本反应类型与氧化还原反应之间关系
氧化还原
反应
非氧化还
原反应
化合反应
复分解反应
置换反应
复分解反应
置换反应
分解反应
化合反应
分解反应
化学反应
四种反应类型
说出以下反应的反应类型及判断是否属于氧化还原反应。
四种基本反应类型与氧化还原反应之间关系
化合反应
复分解
反应
置换
反应
分解反应
非氧化还原反应
氧化还原反应
思考讨论:为什么氧化还原反应一定有元素化合价的升降?氧化还原反应的本质是什么?
e-
失e-
得e-
+1
0
-1
+1
化合价
+1
-1
偏离H+
偏向CI-
课堂探究3:氧化还原反应的实质
氧化还原反应的本质:
电子的转移(得失或偏移)
典例一
典例二
典例三
Fe2O3 + 3CO=== 2Fe + CO2
高温
+3
+2
0
+4
得到3e-×2,发生还原反应
失去2e-×3,发生氧化反应
化合价升高,
化合价降低,
H2 + Cl2 === 2HCl
+1
-1
0
0
0
共用电子对偏离,化合价升高,发生氧化反应
2Na + Cl2 ===2NaCl
点燃
+1
0
-1
失去2e-,发生氧化反应
得到2e-,发生还原反应
化合价降低,
化合价升高,
典例剖析:氧化还原反应的表示方法
共用电子对偏向,化合价降低,发生还原反应
氧化剂和还原剂
2
还原剂
在反应时,得到电子(或电子对偏向)的物质是氧化剂
氧化剂
得
e-
化合价降低
在反应时,失去电子(或电子对偏离)的物质是氧化剂
发生还
原反应
化合价升高
发生氧化反应
失e-
Fe2O3 + 3CO=== 2Fe + CO2
高温
6e-
2Na + Cl2 ===2NaCl
点燃
2e-
升、失、氧
降、得、还
课堂探究4:氧化剂和还原剂
课堂小结
有氧得失的反应是氧化还原反应
从得氧、失氧角度分析
1
有元素化合价升降的反应是氧化还原反应
从化合价升降角度分析(宏观视角)
2
本质:有电子转移(得失或偏移)的反应是氧化还原反应
从电子转移角度分析(微观视角)
3
[ 从不同角度认识氧化还原反应 ]
下列反应属于氧化还原反应的是( )
A. CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
B. CaCO3 === CaO + CO2↑
C. Na2O + H2O == 2NaOH
D. Mg + 2HCl == MgCl2 + H2↑
课堂练习
√
2. 用“双线桥”和“单线桥”法标出下列氧化还原反应中电子转移情况,指出反应的氧化剂和还原剂。
