2022—2023学年化学人教九年级下册第11单元 盐 化肥 单元夯实练习(含答案)
文档属性
| 名称 | 2022—2023学年化学人教九年级下册第11单元 盐 化肥 单元夯实练习(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 394.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-26 17:10:24 | ||
图片预览


文档简介
2022—2023学年化学人教九年级下册第11单元 盐 化肥 单元夯实练习含答案
人教第11单元 盐 化肥
一、选择题。
1、十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
2、下列说法正确的是( )
A.纯碱不是碱 B.食盐不是盐 C.火碱不是碱 D.盐酸不是酸
3、甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
A. 如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠
B. 若甲、乙、丁都是氧化物,则丙一定是碳酸钙
C. 甲、乙、丙、丁之间的转化可以全部通过复分解反应实现
D. 若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳
4、下列物质能够反应,且没有明显现象的是( )
A. Na2CO3溶液加入澄清石灰水中
B. Fe2O3加入NaOH溶液中
C. 稀HCl滴入Ba(OH)2溶液中
D. CO2通入澄清石灰水中
5、过氧化氢被称为“绿色氧化剂”,为了便于贮存和运输,工业上常将其转化为过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.二氧化锰 B.石灰水 C.盐酸 D.氯化钠
6、德国化学家弗里茨·哈伯由于发明了合成氨的方法而获得1918年诺贝尔化学奖,他的发明大大提高了农作物的产量同时也提高了硝酸、炸药的产量。下列说法中正确的是( )
A.氮气和氢气在点燃或光照条件下可合成氨
B.氨水显酸性
C.氨气遇到浓盐酸会发生反应产生白烟
D.干燥氨气可用浓硫酸
7、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区分三种化肥,在农业生产中具有实用性。区分下列相关化肥的方法可行的是( )
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
8、海水是一种重要的资源,利用海水可制取镁等物质。有人设计如下实验流程:
下列说法错误的是( )
A.固体B是Mg(OH)2,试剂X为盐酸
B.操作Ⅰ和操作Ⅲ的操作方式完全相同
C.加入NaOH溶液应过量,其目的是使MgCl2完全反应
D.处理等量海水,若将NaOH溶液换成石灰乳,既能节约成本,又能提高镁的产量
9、化肥对提高农作物的产量有重要作用.下列有关化肥的说法不正确的是( )
A.提倡农家肥与化肥综合利用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
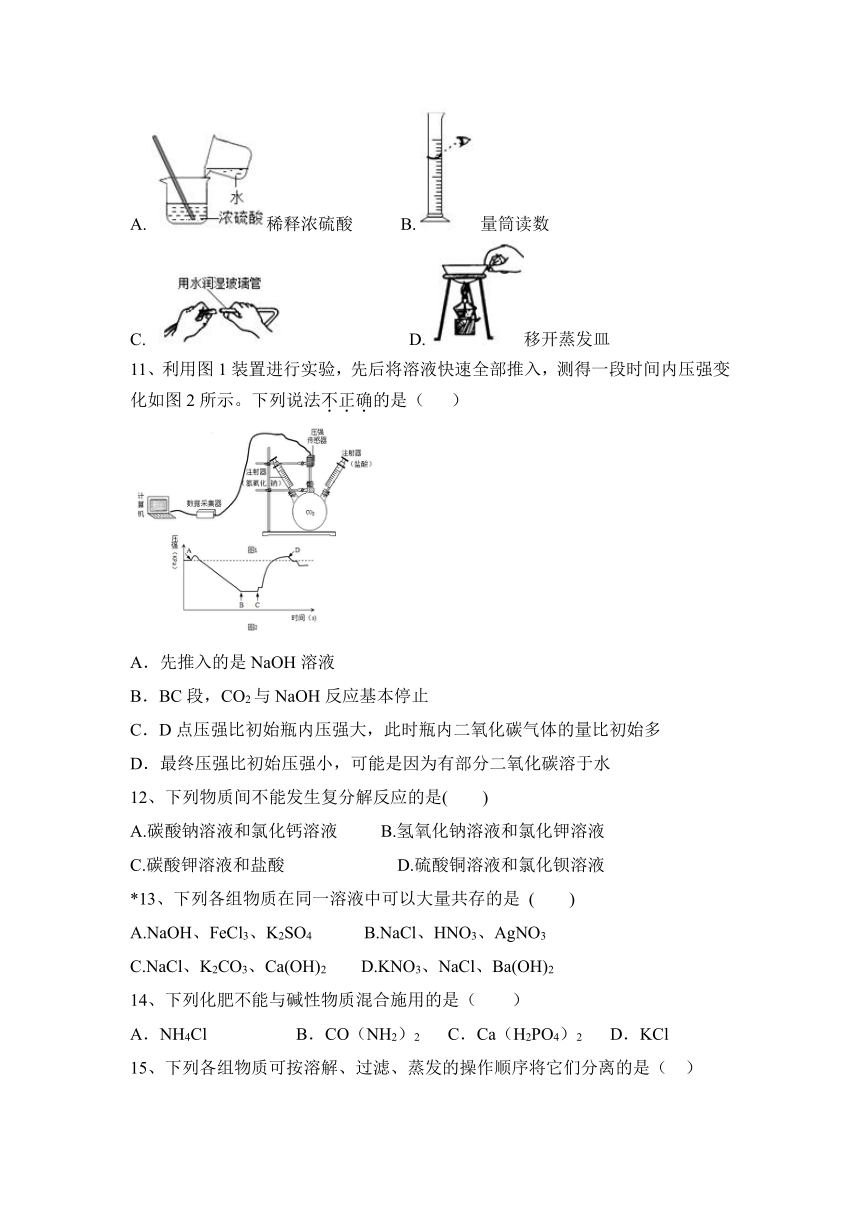
10、下列图示实验操作中,正确的是( )
A. 稀释浓硫酸 B. 量筒读数
C. D. 移开蒸发皿
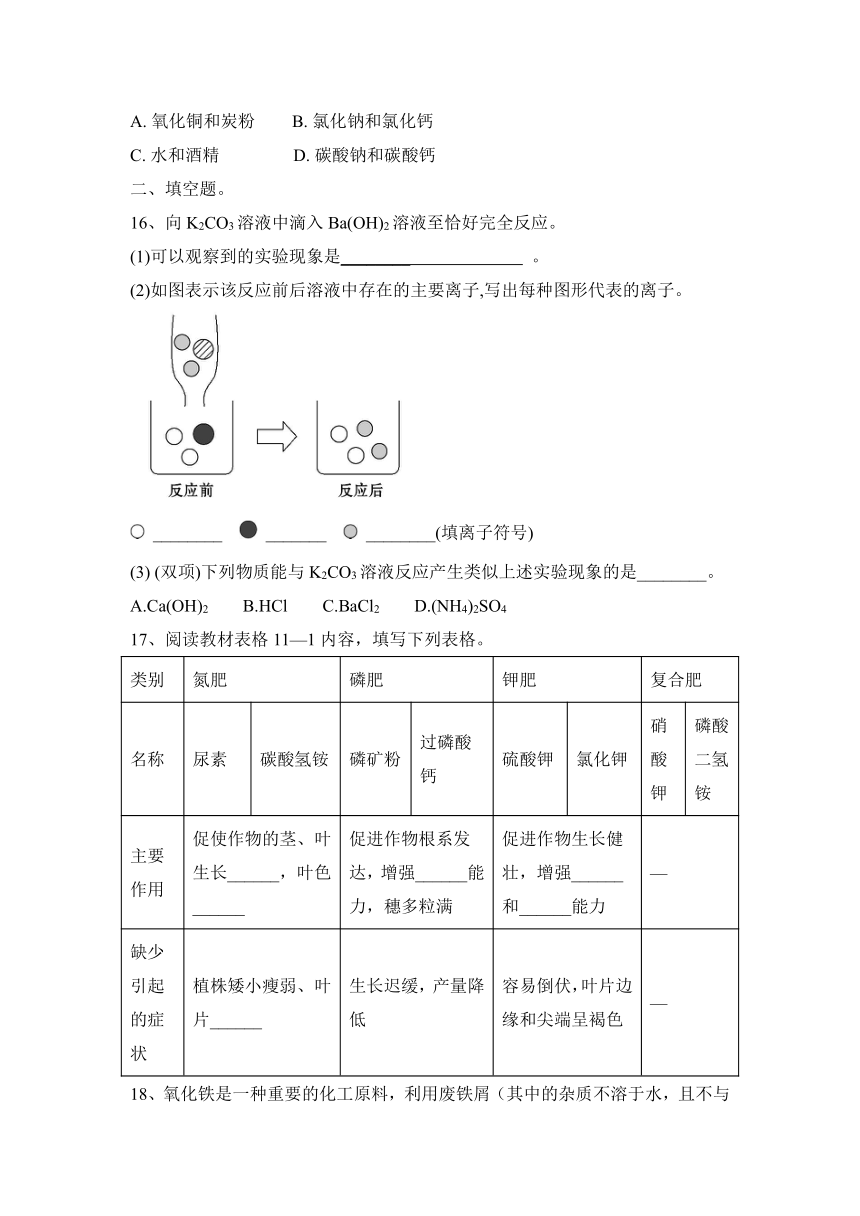
11、利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法不正确的是( )
A.先推入的是NaOH溶液
B.BC段,CO2与NaOH反应基本停止
C.D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多
D.最终压强比初始压强小,可能是因为有部分二氧化碳溶于水
12、下列物质间不能发生复分解反应的是( )
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
*13、下列各组物质在同一溶液中可以大量共存的是 ( )
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
14、下列化肥不能与碱性物质混合施用的是( )
A.NH4Cl B.CO(NH2)2 C.Ca(H2PO4)2 D.KCl
15、下列各组物质可按溶解、过滤、蒸发的操作顺序将它们分离的是( )
A. 氧化铜和炭粉 B. 氯化钠和氯化钙
C. 水和酒精 D. 碳酸钠和碳酸钙
二、填空题。
16、向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应。
(1)可以观察到的实验现象是________ 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。
________ _______ ________(填离子符号)
(3) (双项)下列物质能与K2CO3溶液反应产生类似上述实验现象的是________。
A.Ca(OH)2 B.HCl C.BaCl2 D.(NH4)2SO4
17、阅读教材表格11—1内容,填写下列表格。
类别 氮肥 磷肥 钾肥 复合肥
名称 尿素 碳酸氢铵 磷矿粉 过磷酸钙 硫酸钾 氯化钾 硝酸钾 磷酸二氢铵
主要作用 促使作物的茎、叶生长______,叶色______ 促进作物根系发达,增强______能力,穗多粒满 促进作物生长健壮,增强______和______能力 —
缺少引起的症状 植株矮小瘦弱、叶片______ 生长迟缓,产量降低 容易倒伏,叶片边缘和尖端呈褐色 —
18、氧化铁是一种重要的化工原料,利用废铁屑(其中的杂质不溶于水,且不与酸发生反应)制备氧化铁的流程如图所示:
(1)操作Ⅰ、Ⅱ的名称是________;
(2)向废铁屑中加入的稀硫酸需过量,其目的是________;
(3)高温条件下,FeCO3与通入的O2发生反应的化学方程式是________ 。
19、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
20、现有A、B、C、D四瓶失去标签的无色液体,它们分别是稀盐酸、碳酸钠溶液、氯化钡溶液、硝酸钾溶液中的一种。为了鉴别它们,各取少量溶液两两混合,实验结果如表所示(其中“↓”表示有沉淀生成,“↑”表示有气体生成,“-”表示不反应或无明显现象)。
A B C D
A ↓ - -
B ↓ - ↑
C - - -
D - ↑ -
回答下列问题:
(1)C中溶质的化学式是________,B和D反应所属的基本反应类型是________。
(2)写出A和B反应的化学方程式:____________________ 。
*21、化学知识与我们的生产生活息息相关,请从下列物质中选择相应序号填空。
①食盐 ②小苏打 ③干冰 ④一氧化碳 ⑤明矾
(1)可用作净水剂的是 ;
(2)可用作制冷剂的是 ;
(3)可用作调味品的是 ;
(4)炼铁时做还原剂的是 ;
(5)可用于治疗胃酸过多的是 。
22、化学肥料定义:农作物的生长需要_____等营养元素。含有这些元素的某些物质可以作为肥料。通过化学加工生产的肥料,称作化学肥料。
23、在过滤操作中,玻璃棒的作用是________。
三、阅读下面科普短文。
24、日常生活中,很多人会用冰箱来保存一些吃剩的菜肴,隔一天甚至几天再吃。储存后菜肴中亚硝酸盐含量的变化引发人们的关注。
亚硝酸盐是一类化合物的总称,主要指亚硝酸钠(NaNO2),它是白色或淡黄色粉末,有咸味,易溶于水。蔬菜中一般都含有硝酸盐,含量较高的是茎叶类蔬菜、其次是根茎类蔬菜、然后是瓜类蔬菜,它们在煮熟后如果久置,硝酸盐就会被分解为亚硝酸盐。
实验人员准备了烧熟的蔬菜、牛肉,分别在常温和4℃冷藏条件下保存,48 h内测得亚硝酸盐含量,如下表所示。
时间变化 12 h 24 h 48 h
常温白菜/(mg/kg) 0.057 0.089 0.18
4℃白菜/(mg/kg) 0.037 0.057 0.057
常温胡萝卜/(mg/kg) 0.057 0.073 0.10
4℃胡萝卜/(mg/kg) 0.057 0.057 0.073
常温牛肉(mg/kg) 0.089 0.087 0.18
4℃牛肉(mg/kg) 0.067 0.089 0.089
实验结果表明,48 h内三种菜肴中亚硝酸盐含量均小于国家标准(肉类为3mg/kg、蔬菜为4mg/kg)。
亚硝酸盐本身并无致癌效应,它在胃中酸性环境下,易与氨基酸的分解产物发生反应,产生致癌物。当摄入维生素C时可以阻止致癌物产生。
人体对亚硝酸盐的一次性安全摄入量为每千克体重0.2mg。有数据显示,人体摄入的亚硝酸盐主要来自蔬菜。如果你体重50kg,即使一次性吃2.5kg蔬菜也是安全的。因此,将亚硝酸盐摄入量控制在安全范围内不会对人体造成危害。
依据文章内容,回答下列问题。
(1)亚硝酸钠的物理性质有______________________(写出一条)。
(2)煮熟蔬菜中的亚硝酸盐是由______________转化生成的。
(3)体重50kg的人对亚硝酸盐的一次性安全摄入量为_________mg。
(4)亚硝酸盐产生致癌物的原因是________________________。
(5)下列有关说法正确的是_________。
A.烧熟的白菜在常温储存时的亚硝酸盐含量高于4℃冷藏条件
B.常温储存条件下,烧熟的胡萝卜中的亚硝酸盐含量随存放时间呈增加趋势
C.适量吃富含维生素C的新鲜蔬菜水果,有利于抑制致癌物的产生
D.隔夜菜中因为富含亚硝酸盐,所以不能食用
四、实验探究题。
25、为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
:
试回答下列问题:
(1)操作①的目的是________。操作②能否用硝酸钡溶液?________(填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是________。
(3)写出操作③有关的化学反应方程式________。操作④的名称是________。
(4)此设计方案是否严密,说明理由________。
(5)原固体样品中含NaCl m1g,最后得到的NaCl固体m2g,则m1________m2(填“>”、“<”或“=”)。
五、计算类综合题,
26、某石油化工厂化验室的实验员用15%的NaOH溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如下表。
实验序号 消耗NaOH溶液的质量 洗涤后溶液的pH
① 30 g pH<7
② 40 g pH=7
③ 50 g pH>7
(1)欲计算出一定量石油产品中所含H2SO4的质量,应该选择实验序号 的数据。
(2)若一定量石油产品中残余硫酸的质量为100 g,请计算该残余硫酸中溶质的质量分数。
2022—2023学年化学人教九年级下册第11单元 盐 化肥 单元夯实练习含答案
人教第11单元 盐 化肥
一、选择题。
1、十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
【答案】C
2、下列说法正确的是( )
A.纯碱不是碱 B.食盐不是盐 C.火碱不是碱 D.盐酸不是酸
【答案】A
3、甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
A. 如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠
B. 若甲、乙、丁都是氧化物,则丙一定是碳酸钙
C. 甲、乙、丙、丁之间的转化可以全部通过复分解反应实现
D. 若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳
【答案】C
4、下列物质能够反应,且没有明显现象的是( )
A. Na2CO3溶液加入澄清石灰水中
B. Fe2O3加入NaOH溶液中
C. 稀HCl滴入Ba(OH)2溶液中
D. CO2通入澄清石灰水中
【答案】C
5、过氧化氢被称为“绿色氧化剂”,为了便于贮存和运输,工业上常将其转化为过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.二氧化锰 B.石灰水 C.盐酸 D.氯化钠
【答案】D
6、德国化学家弗里茨·哈伯由于发明了合成氨的方法而获得1918年诺贝尔化学奖,他的发明大大提高了农作物的产量同时也提高了硝酸、炸药的产量。下列说法中正确的是( )
A.氮气和氢气在点燃或光照条件下可合成氨
B.氨水显酸性
C.氨气遇到浓盐酸会发生反应产生白烟
D.干燥氨气可用浓硫酸
【答案】C
7、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区分三种化肥,在农业生产中具有实用性。区分下列相关化肥的方法可行的是( )
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
【答案】D
8、海水是一种重要的资源,利用海水可制取镁等物质。有人设计如下实验流程:
下列说法错误的是( )
A.固体B是Mg(OH)2,试剂X为盐酸
B.操作Ⅰ和操作Ⅲ的操作方式完全相同
C.加入NaOH溶液应过量,其目的是使MgCl2完全反应
D.处理等量海水,若将NaOH溶液换成石灰乳,既能节约成本,又能提高镁的产量
【答案】B
9、化肥对提高农作物的产量有重要作用.下列有关化肥的说法不正确的是( )
A.提倡农家肥与化肥综合利用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
【答案】C。
10、下列图示实验操作中,正确的是( )
A. 稀释浓硫酸 B. 量筒读数
C. D. 移开蒸发皿
【答案】C
11、利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法不正确的是( )
A.先推入的是NaOH溶液
B.BC段,CO2与NaOH反应基本停止
C.D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多
D.最终压强比初始压强小,可能是因为有部分二氧化碳溶于水
【答案】C
12、下列物质间不能发生复分解反应的是( )
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
【答案】B
*13、下列各组物质在同一溶液中可以大量共存的是 ( )
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
【答案】D
14、下列化肥不能与碱性物质混合施用的是( )
A.NH4Cl B.CO(NH2)2 C.Ca(H2PO4)2 D.KCl
【答案】A。
15、下列各组物质可按溶解、过滤、蒸发的操作顺序将它们分离的是( )
A. 氧化铜和炭粉 B. 氯化钠和氯化钙
C. 水和酒精 D. 碳酸钠和碳酸钙
【答案】D
二、填空题。
16、向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应。
(1)可以观察到的实验现象是________ 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。
________ _______ ________(填离子符号)
(3) (双项)下列物质能与K2CO3溶液反应产生类似上述实验现象的是________。
A.Ca(OH)2 B.HCl C.BaCl2 D.(NH4)2SO4
【答案】(1)有白色沉淀生成 (2)K+ C OH- (3)A、C
17、阅读教材表格11—1内容,填写下列表格。
类别 氮肥 磷肥 钾肥 复合肥
名称 尿素 碳酸氢铵 磷矿粉 过磷酸钙 硫酸钾 氯化钾 硝酸钾 磷酸二氢铵
主要作用 促使作物的茎、叶生长______,叶色______ 促进作物根系发达,增强______能力,穗多粒满 促进作物生长健壮,增强______和______能力 —
缺少引起的症状 植株矮小瘦弱、叶片______ 生长迟缓,产量降低 容易倒伏,叶片边缘和尖端呈褐色 —
【答案】茂盛 浓绿 抗旱抗寒 抗病虫害 抗倒伏 发黄
18、氧化铁是一种重要的化工原料,利用废铁屑(其中的杂质不溶于水,且不与酸发生反应)制备氧化铁的流程如图所示:
(1)操作Ⅰ、Ⅱ的名称是________;
(2)向废铁屑中加入的稀硫酸需过量,其目的是________;
(3)高温条件下,FeCO3与通入的O2发生反应的化学方程式是________ 。
【答案】(1)过滤
(2)充分利用废铁屑,使其与稀硫酸充分反应
(3)4FeCO3+O22Fe2O3+4CO2
19、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
【答案】(1)OH- (2) (3)NaOH D
20、现有A、B、C、D四瓶失去标签的无色液体,它们分别是稀盐酸、碳酸钠溶液、氯化钡溶液、硝酸钾溶液中的一种。为了鉴别它们,各取少量溶液两两混合,实验结果如表所示(其中“↓”表示有沉淀生成,“↑”表示有气体生成,“-”表示不反应或无明显现象)。
A B C D
A ↓ - -
B ↓ - ↑
C - - -
D - ↑ -
回答下列问题:
(1)C中溶质的化学式是________,B和D反应所属的基本反应类型是________。
(2)写出A和B反应的化学方程式:____________________ 。
【答案】(1)KNO3 复分解反应 (2)BaCl2+Na2CO3BaCO3↓+2NaCl
*21、化学知识与我们的生产生活息息相关,请从下列物质中选择相应序号填空。
①食盐 ②小苏打 ③干冰 ④一氧化碳 ⑤明矾
(1)可用作净水剂的是 ;
(2)可用作制冷剂的是 ;
(3)可用作调味品的是 ;
(4)炼铁时做还原剂的是 ;
(5)可用于治疗胃酸过多的是 。
【答案】(1)⑤ (2)③ (3)① (4)④ (5)②
22、化学肥料定义:农作物的生长需要_____等营养元素。含有这些元素的某些物质可以作为肥料。通过化学加工生产的肥料,称作化学肥料。
【答案】N、P、K
23、在过滤操作中,玻璃棒的作用是________。
【答案】引流
三、阅读下面科普短文。
24、日常生活中,很多人会用冰箱来保存一些吃剩的菜肴,隔一天甚至几天再吃。储存后菜肴中亚硝酸盐含量的变化引发人们的关注。
亚硝酸盐是一类化合物的总称,主要指亚硝酸钠(NaNO2),它是白色或淡黄色粉末,有咸味,易溶于水。蔬菜中一般都含有硝酸盐,含量较高的是茎叶类蔬菜、其次是根茎类蔬菜、然后是瓜类蔬菜,它们在煮熟后如果久置,硝酸盐就会被分解为亚硝酸盐。
实验人员准备了烧熟的蔬菜、牛肉,分别在常温和4℃冷藏条件下保存,48 h内测得亚硝酸盐含量,如下表所示。
时间变化 12 h 24 h 48 h
常温白菜/(mg/kg) 0.057 0.089 0.18
4℃白菜/(mg/kg) 0.037 0.057 0.057
常温胡萝卜/(mg/kg) 0.057 0.073 0.10
4℃胡萝卜/(mg/kg) 0.057 0.057 0.073
常温牛肉(mg/kg) 0.089 0.087 0.18
4℃牛肉(mg/kg) 0.067 0.089 0.089
实验结果表明,48 h内三种菜肴中亚硝酸盐含量均小于国家标准(肉类为3mg/kg、蔬菜为4mg/kg)。
亚硝酸盐本身并无致癌效应,它在胃中酸性环境下,易与氨基酸的分解产物发生反应,产生致癌物。当摄入维生素C时可以阻止致癌物产生。
人体对亚硝酸盐的一次性安全摄入量为每千克体重0.2mg。有数据显示,人体摄入的亚硝酸盐主要来自蔬菜。如果你体重50kg,即使一次性吃2.5kg蔬菜也是安全的。因此,将亚硝酸盐摄入量控制在安全范围内不会对人体造成危害。
依据文章内容,回答下列问题。
(1)亚硝酸钠的物理性质有______________________(写出一条)。
(2)煮熟蔬菜中的亚硝酸盐是由______________转化生成的。
(3)体重50kg的人对亚硝酸盐的一次性安全摄入量为_________mg。
(4)亚硝酸盐产生致癌物的原因是________________________。
(5)下列有关说法正确的是_________。
A.烧熟的白菜在常温储存时的亚硝酸盐含量高于4℃冷藏条件
B.常温储存条件下,烧熟的胡萝卜中的亚硝酸盐含量随存放时间呈增加趋势
C.适量吃富含维生素C的新鲜蔬菜水果,有利于抑制致癌物的产生
D.隔夜菜中因为富含亚硝酸盐,所以不能食用
【答案】(1)白色或淡黄色粉末,或者有咸味,或者易溶于水
(2)硝酸盐 (3)10
(4)亚硝酸盐在胃中酸性环境下,与氨基酸的分解产物发生反应,产生致癌物 (5)ABC
四、实验探究题。
25、为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
:
试回答下列问题:
(1)操作①的目的是________。操作②能否用硝酸钡溶液?________(填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是________。
(3)写出操作③有关的化学反应方程式________。操作④的名称是________。
(4)此设计方案是否严密,说明理由________。
(5)原固体样品中含NaCl m1g,最后得到的NaCl固体m2g,则m1________m2(填“>”、“<”或“=”)。
【答案】除去碳酸氢铵 ;否;往上层澄清液中滴加BaCl2溶液,如果没有白色沉淀产生,则SO42-已除尽(或取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42﹣已除尽);BaCl2+Na2CO3=BaCO3↓+2NaCl;过滤;
不严密,操作③引入的过量Na2CO3没有除去;<
五、计算类综合题,
26、某石油化工厂化验室的实验员用15%的NaOH溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如下表。
实验序号 消耗NaOH溶液的质量 洗涤后溶液的pH
① 30 g pH<7
② 40 g pH=7
③ 50 g pH>7
(1)欲计算出一定量石油产品中所含H2SO4的质量,应该选择实验序号 的数据。
(2)若一定量石油产品中残余硫酸的质量为100 g,请计算该残余硫酸中溶质的质量分数。
【答案】(1)②
(2)解:设该残余硫酸中溶质的质量为x。
2NaOH + H2SO4Na2SO4+2H2O
80 98
40 g×15% x
=
x=7.35 g
该残余硫酸中溶质的质量分数为
×100%=7.35%。
答:该残余硫酸中溶质的质量分数为7.35%。
人教第11单元 盐 化肥
一、选择题。
1、十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
2、下列说法正确的是( )
A.纯碱不是碱 B.食盐不是盐 C.火碱不是碱 D.盐酸不是酸
3、甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
A. 如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠
B. 若甲、乙、丁都是氧化物,则丙一定是碳酸钙
C. 甲、乙、丙、丁之间的转化可以全部通过复分解反应实现
D. 若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳
4、下列物质能够反应,且没有明显现象的是( )
A. Na2CO3溶液加入澄清石灰水中
B. Fe2O3加入NaOH溶液中
C. 稀HCl滴入Ba(OH)2溶液中
D. CO2通入澄清石灰水中
5、过氧化氢被称为“绿色氧化剂”,为了便于贮存和运输,工业上常将其转化为过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.二氧化锰 B.石灰水 C.盐酸 D.氯化钠
6、德国化学家弗里茨·哈伯由于发明了合成氨的方法而获得1918年诺贝尔化学奖,他的发明大大提高了农作物的产量同时也提高了硝酸、炸药的产量。下列说法中正确的是( )
A.氮气和氢气在点燃或光照条件下可合成氨
B.氨水显酸性
C.氨气遇到浓盐酸会发生反应产生白烟
D.干燥氨气可用浓硫酸
7、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区分三种化肥,在农业生产中具有实用性。区分下列相关化肥的方法可行的是( )
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
8、海水是一种重要的资源,利用海水可制取镁等物质。有人设计如下实验流程:
下列说法错误的是( )
A.固体B是Mg(OH)2,试剂X为盐酸
B.操作Ⅰ和操作Ⅲ的操作方式完全相同
C.加入NaOH溶液应过量,其目的是使MgCl2完全反应
D.处理等量海水,若将NaOH溶液换成石灰乳,既能节约成本,又能提高镁的产量
9、化肥对提高农作物的产量有重要作用.下列有关化肥的说法不正确的是( )
A.提倡农家肥与化肥综合利用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
10、下列图示实验操作中,正确的是( )
A. 稀释浓硫酸 B. 量筒读数
C. D. 移开蒸发皿
11、利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法不正确的是( )
A.先推入的是NaOH溶液
B.BC段,CO2与NaOH反应基本停止
C.D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多
D.最终压强比初始压强小,可能是因为有部分二氧化碳溶于水
12、下列物质间不能发生复分解反应的是( )
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
*13、下列各组物质在同一溶液中可以大量共存的是 ( )
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
14、下列化肥不能与碱性物质混合施用的是( )
A.NH4Cl B.CO(NH2)2 C.Ca(H2PO4)2 D.KCl
15、下列各组物质可按溶解、过滤、蒸发的操作顺序将它们分离的是( )
A. 氧化铜和炭粉 B. 氯化钠和氯化钙
C. 水和酒精 D. 碳酸钠和碳酸钙
二、填空题。
16、向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应。
(1)可以观察到的实验现象是________ 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。
________ _______ ________(填离子符号)
(3) (双项)下列物质能与K2CO3溶液反应产生类似上述实验现象的是________。
A.Ca(OH)2 B.HCl C.BaCl2 D.(NH4)2SO4
17、阅读教材表格11—1内容,填写下列表格。
类别 氮肥 磷肥 钾肥 复合肥
名称 尿素 碳酸氢铵 磷矿粉 过磷酸钙 硫酸钾 氯化钾 硝酸钾 磷酸二氢铵
主要作用 促使作物的茎、叶生长______,叶色______ 促进作物根系发达,增强______能力,穗多粒满 促进作物生长健壮,增强______和______能力 —
缺少引起的症状 植株矮小瘦弱、叶片______ 生长迟缓,产量降低 容易倒伏,叶片边缘和尖端呈褐色 —
18、氧化铁是一种重要的化工原料,利用废铁屑(其中的杂质不溶于水,且不与酸发生反应)制备氧化铁的流程如图所示:
(1)操作Ⅰ、Ⅱ的名称是________;
(2)向废铁屑中加入的稀硫酸需过量,其目的是________;
(3)高温条件下,FeCO3与通入的O2发生反应的化学方程式是________ 。
19、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
20、现有A、B、C、D四瓶失去标签的无色液体,它们分别是稀盐酸、碳酸钠溶液、氯化钡溶液、硝酸钾溶液中的一种。为了鉴别它们,各取少量溶液两两混合,实验结果如表所示(其中“↓”表示有沉淀生成,“↑”表示有气体生成,“-”表示不反应或无明显现象)。
A B C D
A ↓ - -
B ↓ - ↑
C - - -
D - ↑ -
回答下列问题:
(1)C中溶质的化学式是________,B和D反应所属的基本反应类型是________。
(2)写出A和B反应的化学方程式:____________________ 。
*21、化学知识与我们的生产生活息息相关,请从下列物质中选择相应序号填空。
①食盐 ②小苏打 ③干冰 ④一氧化碳 ⑤明矾
(1)可用作净水剂的是 ;
(2)可用作制冷剂的是 ;
(3)可用作调味品的是 ;
(4)炼铁时做还原剂的是 ;
(5)可用于治疗胃酸过多的是 。
22、化学肥料定义:农作物的生长需要_____等营养元素。含有这些元素的某些物质可以作为肥料。通过化学加工生产的肥料,称作化学肥料。
23、在过滤操作中,玻璃棒的作用是________。
三、阅读下面科普短文。
24、日常生活中,很多人会用冰箱来保存一些吃剩的菜肴,隔一天甚至几天再吃。储存后菜肴中亚硝酸盐含量的变化引发人们的关注。
亚硝酸盐是一类化合物的总称,主要指亚硝酸钠(NaNO2),它是白色或淡黄色粉末,有咸味,易溶于水。蔬菜中一般都含有硝酸盐,含量较高的是茎叶类蔬菜、其次是根茎类蔬菜、然后是瓜类蔬菜,它们在煮熟后如果久置,硝酸盐就会被分解为亚硝酸盐。
实验人员准备了烧熟的蔬菜、牛肉,分别在常温和4℃冷藏条件下保存,48 h内测得亚硝酸盐含量,如下表所示。
时间变化 12 h 24 h 48 h
常温白菜/(mg/kg) 0.057 0.089 0.18
4℃白菜/(mg/kg) 0.037 0.057 0.057
常温胡萝卜/(mg/kg) 0.057 0.073 0.10
4℃胡萝卜/(mg/kg) 0.057 0.057 0.073
常温牛肉(mg/kg) 0.089 0.087 0.18
4℃牛肉(mg/kg) 0.067 0.089 0.089
实验结果表明,48 h内三种菜肴中亚硝酸盐含量均小于国家标准(肉类为3mg/kg、蔬菜为4mg/kg)。
亚硝酸盐本身并无致癌效应,它在胃中酸性环境下,易与氨基酸的分解产物发生反应,产生致癌物。当摄入维生素C时可以阻止致癌物产生。
人体对亚硝酸盐的一次性安全摄入量为每千克体重0.2mg。有数据显示,人体摄入的亚硝酸盐主要来自蔬菜。如果你体重50kg,即使一次性吃2.5kg蔬菜也是安全的。因此,将亚硝酸盐摄入量控制在安全范围内不会对人体造成危害。
依据文章内容,回答下列问题。
(1)亚硝酸钠的物理性质有______________________(写出一条)。
(2)煮熟蔬菜中的亚硝酸盐是由______________转化生成的。
(3)体重50kg的人对亚硝酸盐的一次性安全摄入量为_________mg。
(4)亚硝酸盐产生致癌物的原因是________________________。
(5)下列有关说法正确的是_________。
A.烧熟的白菜在常温储存时的亚硝酸盐含量高于4℃冷藏条件
B.常温储存条件下,烧熟的胡萝卜中的亚硝酸盐含量随存放时间呈增加趋势
C.适量吃富含维生素C的新鲜蔬菜水果,有利于抑制致癌物的产生
D.隔夜菜中因为富含亚硝酸盐,所以不能食用
四、实验探究题。
25、为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
:
试回答下列问题:
(1)操作①的目的是________。操作②能否用硝酸钡溶液?________(填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是________。
(3)写出操作③有关的化学反应方程式________。操作④的名称是________。
(4)此设计方案是否严密,说明理由________。
(5)原固体样品中含NaCl m1g,最后得到的NaCl固体m2g,则m1________m2(填“>”、“<”或“=”)。
五、计算类综合题,
26、某石油化工厂化验室的实验员用15%的NaOH溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如下表。
实验序号 消耗NaOH溶液的质量 洗涤后溶液的pH
① 30 g pH<7
② 40 g pH=7
③ 50 g pH>7
(1)欲计算出一定量石油产品中所含H2SO4的质量,应该选择实验序号 的数据。
(2)若一定量石油产品中残余硫酸的质量为100 g,请计算该残余硫酸中溶质的质量分数。
2022—2023学年化学人教九年级下册第11单元 盐 化肥 单元夯实练习含答案
人教第11单元 盐 化肥
一、选择题。
1、十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
【答案】C
2、下列说法正确的是( )
A.纯碱不是碱 B.食盐不是盐 C.火碱不是碱 D.盐酸不是酸
【答案】A
3、甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
A. 如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠
B. 若甲、乙、丁都是氧化物,则丙一定是碳酸钙
C. 甲、乙、丙、丁之间的转化可以全部通过复分解反应实现
D. 若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳
【答案】C
4、下列物质能够反应,且没有明显现象的是( )
A. Na2CO3溶液加入澄清石灰水中
B. Fe2O3加入NaOH溶液中
C. 稀HCl滴入Ba(OH)2溶液中
D. CO2通入澄清石灰水中
【答案】C
5、过氧化氢被称为“绿色氧化剂”,为了便于贮存和运输,工业上常将其转化为过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.二氧化锰 B.石灰水 C.盐酸 D.氯化钠
【答案】D
6、德国化学家弗里茨·哈伯由于发明了合成氨的方法而获得1918年诺贝尔化学奖,他的发明大大提高了农作物的产量同时也提高了硝酸、炸药的产量。下列说法中正确的是( )
A.氮气和氢气在点燃或光照条件下可合成氨
B.氨水显酸性
C.氨气遇到浓盐酸会发生反应产生白烟
D.干燥氨气可用浓硫酸
【答案】C
7、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区分三种化肥,在农业生产中具有实用性。区分下列相关化肥的方法可行的是( )
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
【答案】D
8、海水是一种重要的资源,利用海水可制取镁等物质。有人设计如下实验流程:
下列说法错误的是( )
A.固体B是Mg(OH)2,试剂X为盐酸
B.操作Ⅰ和操作Ⅲ的操作方式完全相同
C.加入NaOH溶液应过量,其目的是使MgCl2完全反应
D.处理等量海水,若将NaOH溶液换成石灰乳,既能节约成本,又能提高镁的产量
【答案】B
9、化肥对提高农作物的产量有重要作用.下列有关化肥的说法不正确的是( )
A.提倡农家肥与化肥综合利用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
【答案】C。
10、下列图示实验操作中,正确的是( )
A. 稀释浓硫酸 B. 量筒读数
C. D. 移开蒸发皿
【答案】C
11、利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法不正确的是( )
A.先推入的是NaOH溶液
B.BC段,CO2与NaOH反应基本停止
C.D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多
D.最终压强比初始压强小,可能是因为有部分二氧化碳溶于水
【答案】C
12、下列物质间不能发生复分解反应的是( )
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
【答案】B
*13、下列各组物质在同一溶液中可以大量共存的是 ( )
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
【答案】D
14、下列化肥不能与碱性物质混合施用的是( )
A.NH4Cl B.CO(NH2)2 C.Ca(H2PO4)2 D.KCl
【答案】A。
15、下列各组物质可按溶解、过滤、蒸发的操作顺序将它们分离的是( )
A. 氧化铜和炭粉 B. 氯化钠和氯化钙
C. 水和酒精 D. 碳酸钠和碳酸钙
【答案】D
二、填空题。
16、向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应。
(1)可以观察到的实验现象是________ 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。
________ _______ ________(填离子符号)
(3) (双项)下列物质能与K2CO3溶液反应产生类似上述实验现象的是________。
A.Ca(OH)2 B.HCl C.BaCl2 D.(NH4)2SO4
【答案】(1)有白色沉淀生成 (2)K+ C OH- (3)A、C
17、阅读教材表格11—1内容,填写下列表格。
类别 氮肥 磷肥 钾肥 复合肥
名称 尿素 碳酸氢铵 磷矿粉 过磷酸钙 硫酸钾 氯化钾 硝酸钾 磷酸二氢铵
主要作用 促使作物的茎、叶生长______,叶色______ 促进作物根系发达,增强______能力,穗多粒满 促进作物生长健壮,增强______和______能力 —
缺少引起的症状 植株矮小瘦弱、叶片______ 生长迟缓,产量降低 容易倒伏,叶片边缘和尖端呈褐色 —
【答案】茂盛 浓绿 抗旱抗寒 抗病虫害 抗倒伏 发黄
18、氧化铁是一种重要的化工原料,利用废铁屑(其中的杂质不溶于水,且不与酸发生反应)制备氧化铁的流程如图所示:
(1)操作Ⅰ、Ⅱ的名称是________;
(2)向废铁屑中加入的稀硫酸需过量,其目的是________;
(3)高温条件下,FeCO3与通入的O2发生反应的化学方程式是________ 。
【答案】(1)过滤
(2)充分利用废铁屑,使其与稀硫酸充分反应
(3)4FeCO3+O22Fe2O3+4CO2
19、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
【答案】(1)OH- (2) (3)NaOH D
20、现有A、B、C、D四瓶失去标签的无色液体,它们分别是稀盐酸、碳酸钠溶液、氯化钡溶液、硝酸钾溶液中的一种。为了鉴别它们,各取少量溶液两两混合,实验结果如表所示(其中“↓”表示有沉淀生成,“↑”表示有气体生成,“-”表示不反应或无明显现象)。
A B C D
A ↓ - -
B ↓ - ↑
C - - -
D - ↑ -
回答下列问题:
(1)C中溶质的化学式是________,B和D反应所属的基本反应类型是________。
(2)写出A和B反应的化学方程式:____________________ 。
【答案】(1)KNO3 复分解反应 (2)BaCl2+Na2CO3BaCO3↓+2NaCl
*21、化学知识与我们的生产生活息息相关,请从下列物质中选择相应序号填空。
①食盐 ②小苏打 ③干冰 ④一氧化碳 ⑤明矾
(1)可用作净水剂的是 ;
(2)可用作制冷剂的是 ;
(3)可用作调味品的是 ;
(4)炼铁时做还原剂的是 ;
(5)可用于治疗胃酸过多的是 。
【答案】(1)⑤ (2)③ (3)① (4)④ (5)②
22、化学肥料定义:农作物的生长需要_____等营养元素。含有这些元素的某些物质可以作为肥料。通过化学加工生产的肥料,称作化学肥料。
【答案】N、P、K
23、在过滤操作中,玻璃棒的作用是________。
【答案】引流
三、阅读下面科普短文。
24、日常生活中,很多人会用冰箱来保存一些吃剩的菜肴,隔一天甚至几天再吃。储存后菜肴中亚硝酸盐含量的变化引发人们的关注。
亚硝酸盐是一类化合物的总称,主要指亚硝酸钠(NaNO2),它是白色或淡黄色粉末,有咸味,易溶于水。蔬菜中一般都含有硝酸盐,含量较高的是茎叶类蔬菜、其次是根茎类蔬菜、然后是瓜类蔬菜,它们在煮熟后如果久置,硝酸盐就会被分解为亚硝酸盐。
实验人员准备了烧熟的蔬菜、牛肉,分别在常温和4℃冷藏条件下保存,48 h内测得亚硝酸盐含量,如下表所示。
时间变化 12 h 24 h 48 h
常温白菜/(mg/kg) 0.057 0.089 0.18
4℃白菜/(mg/kg) 0.037 0.057 0.057
常温胡萝卜/(mg/kg) 0.057 0.073 0.10
4℃胡萝卜/(mg/kg) 0.057 0.057 0.073
常温牛肉(mg/kg) 0.089 0.087 0.18
4℃牛肉(mg/kg) 0.067 0.089 0.089
实验结果表明,48 h内三种菜肴中亚硝酸盐含量均小于国家标准(肉类为3mg/kg、蔬菜为4mg/kg)。
亚硝酸盐本身并无致癌效应,它在胃中酸性环境下,易与氨基酸的分解产物发生反应,产生致癌物。当摄入维生素C时可以阻止致癌物产生。
人体对亚硝酸盐的一次性安全摄入量为每千克体重0.2mg。有数据显示,人体摄入的亚硝酸盐主要来自蔬菜。如果你体重50kg,即使一次性吃2.5kg蔬菜也是安全的。因此,将亚硝酸盐摄入量控制在安全范围内不会对人体造成危害。
依据文章内容,回答下列问题。
(1)亚硝酸钠的物理性质有______________________(写出一条)。
(2)煮熟蔬菜中的亚硝酸盐是由______________转化生成的。
(3)体重50kg的人对亚硝酸盐的一次性安全摄入量为_________mg。
(4)亚硝酸盐产生致癌物的原因是________________________。
(5)下列有关说法正确的是_________。
A.烧熟的白菜在常温储存时的亚硝酸盐含量高于4℃冷藏条件
B.常温储存条件下,烧熟的胡萝卜中的亚硝酸盐含量随存放时间呈增加趋势
C.适量吃富含维生素C的新鲜蔬菜水果,有利于抑制致癌物的产生
D.隔夜菜中因为富含亚硝酸盐,所以不能食用
【答案】(1)白色或淡黄色粉末,或者有咸味,或者易溶于水
(2)硝酸盐 (3)10
(4)亚硝酸盐在胃中酸性环境下,与氨基酸的分解产物发生反应,产生致癌物 (5)ABC
四、实验探究题。
25、为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
:
试回答下列问题:
(1)操作①的目的是________。操作②能否用硝酸钡溶液?________(填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是________。
(3)写出操作③有关的化学反应方程式________。操作④的名称是________。
(4)此设计方案是否严密,说明理由________。
(5)原固体样品中含NaCl m1g,最后得到的NaCl固体m2g,则m1________m2(填“>”、“<”或“=”)。
【答案】除去碳酸氢铵 ;否;往上层澄清液中滴加BaCl2溶液,如果没有白色沉淀产生,则SO42-已除尽(或取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42﹣已除尽);BaCl2+Na2CO3=BaCO3↓+2NaCl;过滤;
不严密,操作③引入的过量Na2CO3没有除去;<
五、计算类综合题,
26、某石油化工厂化验室的实验员用15%的NaOH溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如下表。
实验序号 消耗NaOH溶液的质量 洗涤后溶液的pH
① 30 g pH<7
② 40 g pH=7
③ 50 g pH>7
(1)欲计算出一定量石油产品中所含H2SO4的质量,应该选择实验序号 的数据。
(2)若一定量石油产品中残余硫酸的质量为100 g,请计算该残余硫酸中溶质的质量分数。
【答案】(1)②
(2)解:设该残余硫酸中溶质的质量为x。
2NaOH + H2SO4Na2SO4+2H2O
80 98
40 g×15% x
=
x=7.35 g
该残余硫酸中溶质的质量分数为
×100%=7.35%。
答:该残余硫酸中溶质的质量分数为7.35%。
同课章节目录
