化学人教版(2019)必修第一册1.2离子反应(共67张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2离子反应(共67张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 10:31:58 | ||
图片预览







文档简介
(共67张PPT)
第二节 离子反应
导入
水会导电吗
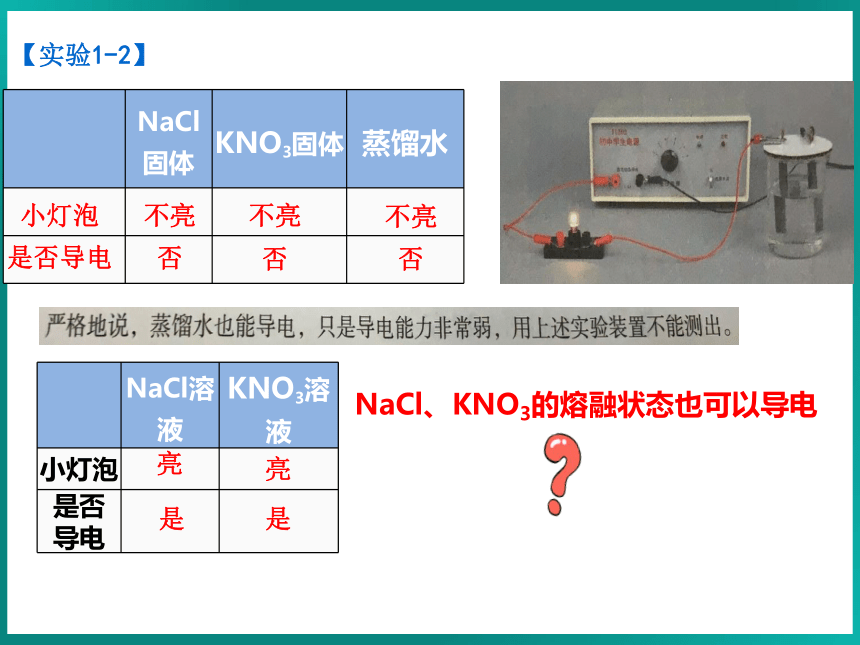
NaCl固体 KNO3固体 蒸馏水
不亮
不亮
不亮
否
否
否
【实验1-2】
NaCl溶液 KNO3溶液
小灯泡
是否 导电
亮
亮
是
是
NaCl、KNO3的熔融状态也可以导电
小灯泡
是否导电
一、电离
1、概念:
产生可以自由移动的离子的过程
2、条件:
①溶于水:
如酸、碱、盐在水中电离
②受热熔化:
如某些金属化合物(Na2O、NaCl、NaOH等)
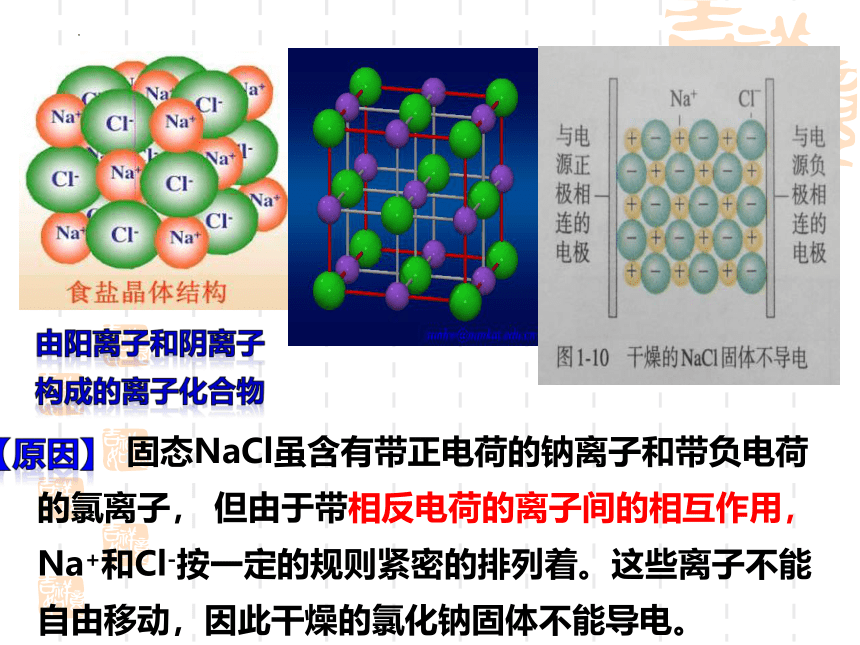
由阳离子和阴离子构成的离子化合物
固态NaCl虽含有带正电荷的钠离子和带负电荷的氯离子, 但由于带相反电荷的离子间的相互作用, Na+和Cl-按一定的规则紧密的排列着。这些离子不能自由移动,因此干燥的氯化钠固体不能导电。
【原因】
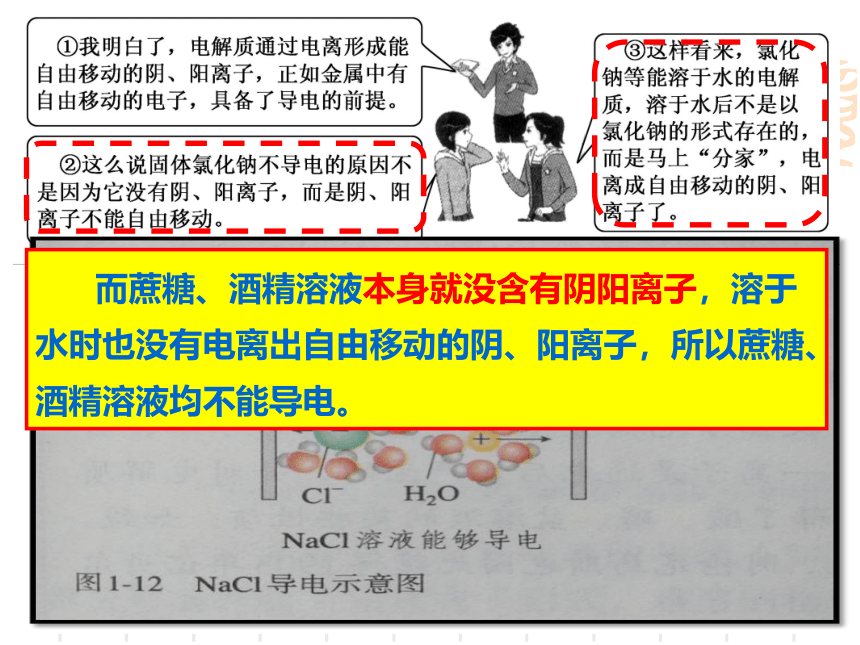
当NaCl加入水时,在水分子的作用下, Na+ 和Cl-脱离NaCl固体表面,进入水中,成为自由移动的水合钠离子和水合氯离子。
而蔗糖、酒精溶液本身就没含有阴阳离子,溶于水时也没有电离出自由移动的阴、阳离子,所以蔗糖、酒精溶液均不能导电。
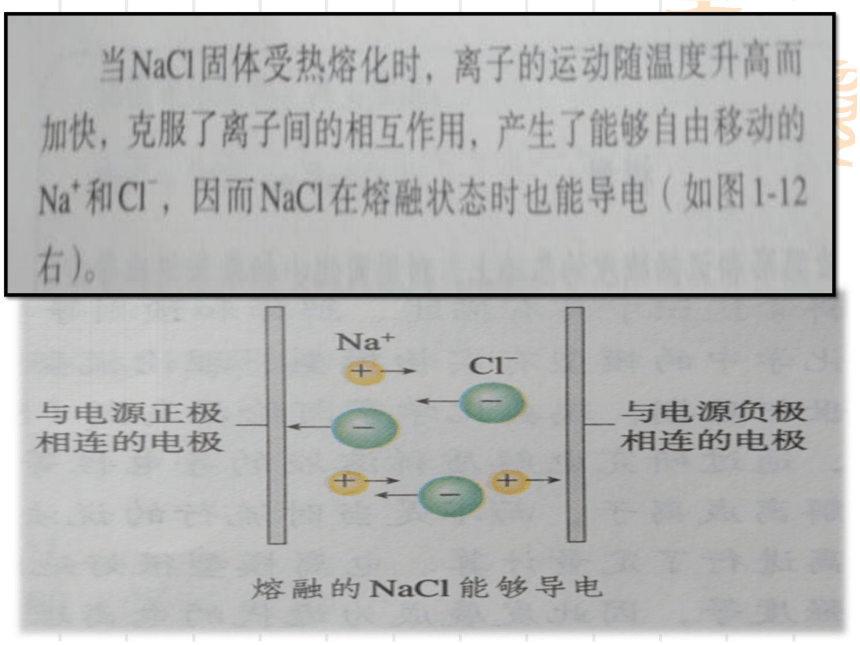
【实验表明】熔融NaCl能导电。
NaCl固体不导电,当NaCl固体放入水中时,水分子破坏了离子间的相互作用, 使Na+ 和Cl—发生解离,那么能否给NaCl以很高的能量,破坏Na+ 和Cl—之间的静电作用,使其解离出来呢?让我们设计实验验证这种猜想吧。
思考
例如:NaCl、KNO3、NaOH、H3PO4等
1、电解质:在水溶液中或熔融状态下能够导电的化合物
范围:酸、碱、盐、活泼金属氧化物和水
自身解离出自由移动的离子而导电.
二、电解质与非电解质
2、非电解质:在水溶液中和熔融状态下不能够导电的
化合物
范围:非金属氧化物、大部分有机物、非酸性气态氢化物
(如) NH3
例如:蔗糖、酒精(乙醇)等
水溶液中:酸、碱、盐
熔融状态:多数碱、盐、金属氧化物
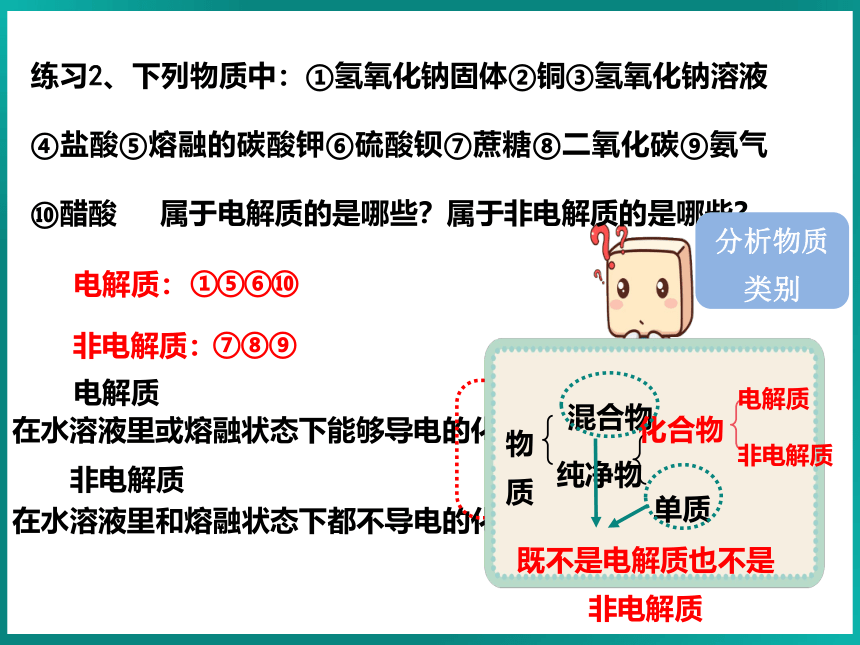
练习2、下列物质中:①氢氧化钠固体②铜③氢氧化钠溶液④盐酸⑤熔融的碳酸钾⑥硫酸钡⑦蔗糖⑧二氧化碳⑨氨气⑩醋酸 属于电解质的是哪些?属于非电解质的是哪些?
在水溶液里或熔融状态下能够导电的化合物。
电解质
在水溶液里和熔融状态下都不导电的化合物。
非电解质
物质
混合物
纯净物
化合物
单质
电解质
非电解质
既不是电解质也不是非电解质
电解质:
非电解质:
分析物质类别
①
⑤
⑥
⑦
⑧
⑨
⑩
1.单质
混合物
既不是电解质也不是非电解质
2.CO2、NH3等溶于水得到的水溶液能导电,但它们是非电解质,因为导电的离子不是其本身电离出来的。
3.难溶的盐(BaSO4等)虽然水溶液不能导电, 但是在融化时能导电,也是电解质。
【注意】
4.氯化氢是电解质,盐酸是氯化氢的水溶液,盐酸是混合物,既不是电解质也不是非电解质
1.石墨、铜能导电,所以是电解质。
2.由于BaSO4不溶于水,所以不是电解质。
3.盐酸能导电,所以盐酸是电解质。
4.Cl2、SO2、NH3、Na2O溶于水可导电,所以均为电解质。
【练习】判断以下几种说法是否正确,并说明原因
×
×
×
×
对比观看熔融硝酸钾的导电情况
【实验表明】熔融KNO3能导电。
KNO3等离子构成的化合物的导电情况与氯化钠的相同
练习3、下列物质中:属于电解质的是哪些?属于非电解质的是哪些?哪些能导电?
铁、苯、汽油、浓硫酸、硝酸、氨水、NH3●H2O、
明矾、氢氧化铁、石墨、天然气 、氧化钠、二氧化硫。
概念的生成(电解质在水溶液电离有强弱之分)
二、强电解质和弱电解质
强电解质:在水溶液里全部分子电离成离子的电解质。
弱电解质:在水溶液里只有部分分子电离成离子的电解质。
特点:完全电离,无分子
特点:微弱电离,分子多,离子少
1.定义:
常见的强电解质:
①强酸:HCl、H2SO4、HNO3、 HI、HBr、 HClO4等。
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
③绝大多数盐:NaCl、(NH4)2SO4、BaSO4等。
④活泼金属氧化物:K2O、Na2O等
2.常见的强电解质和弱电解质
常见的弱电解质:
①弱酸:HF、HClO、H2S、CH3COOH等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等。
③水:水是极弱的电解质。
④两种盐:硫氰化铁Fe(SCN)3、醋酸铅Pb(CH3COO)2
2.常见的强电解质和弱电解质
强弱电解质与其溶解性无关。如:某些难溶或微溶于水的盐,虽然其溶解度很小,但是其溶于水的部分,却是完全电离的,所以它们仍然属于强电解质,例如:CaCO3、BaSO4等。
HNO3
CaCO3
MgCl2
Al2 (SO4)3
= H+ + NO3-
= Ca2+ + CO32-
= Mg2++ 2Cl-
= 2Al 3++ 3SO42-
1、强电解质在水中或熔融下完全电离,
书写用 “=” 等号:
三、电离方程式的书写
●电离方程式∶ 表示电解质在水溶液中
或熔化状态下电离成离子的过程的式子。
2、弱电解质在水中只有部分电离
书写用可逆符号:
NH4+ + OH-
HClO
NH3·H2O
CH3COOH
H+ + ClO-
H+ + CH3COO-
H2O
H+ + OH-
3、弱酸的电离方程式书写
第一步:
第二步:
H+ + HCO3-
H2CO3
难
HCO3-
H+ + CO32-
更难
A、一元弱酸难电离,使用可逆符号
C、多元弱酸的酸式根难电离,分步写:
HSO3- 、 HCO3- 、 HS- 、 HPO42- 、 H2PO4-
H+ + CH3COO-
CH3COOH
B、多元弱酸分步电离,使用可逆符号(H2CO3):
4、弱碱电离方程式的书写:
Cu(OH)2
Cu2+ + 2OH-
Fe(OH)3
Fe3+ + 3OH-
A、一元难电离使用可逆符号:
B、多元弱碱的电离相当复杂,高中阶段
只须一步写出;
NH3·H2O
NH4+ + OH-
练习2、写出CH3COOH、 H2SO4、H2CO3、Ca(OH)2、 NH3·H2O 、Mg(OH)2、CaCl2、NaHCO3的电离方程式。
练习3、写出HClO、H2S、 KOH、Ba(OH)2、 NH3·H2O 、 Fe(OH )3、BaCl2、NaHSO3 、 AlCl3的电离方程式。
思考1、NaHSO4在水溶液及熔融状态的电离方程式?
水中: NaHSO4=Na++H++SO42-
熔融状态: NaHSO4=Na++HSO4-
注意:对于强酸的酸式盐,在水溶液中能一步电离出H+;
对于弱酸的酸式盐,在水溶液中不能一步电离出H+;
对于任何酸式盐,在熔融状态都不能电离出H+ 。
灯泡变化:
利用左图的装置来做下面的实验:在烧杯里盛半杯Ba(OH)2溶液,然后向容器里滴入稀硫酸。随着H2SO4的滴入,你能观察到电灯有什么变化?为什么?请从电离的角度来分析。
探究:
亮 熄灭 亮
第二节 离子反应
离子反应及其发生的条件
生成沉淀、放出气体或生成水。
【回顾】复分解反应发生的条件?
【实验1-3】实验探究离子反应发生的实质
思考:Na2SO4溶液能与BaCl2溶液反应,却不能与稀HCl溶液反应,请从离子数目变化角度分析原因。
实验 现象 化学方程式 混合前后各种离子的数量变化
1.向盛有2mLNa2SO4 溶液的试管中加入2mL稀HCl溶液
2.向盛有2mLNa2SO4 溶液的试管中加入 2mLBaCl2溶液
无明显变化
生成白色沉淀
——
都不变
Na2SO4+BaCl2=BaSO4↓+2NaCl
SO42-、Ba2+数量减少
电解质溶于水后电离成为离子,不同的电解质溶液混合时发生的反应实质上是离子之间的反应。
Na2SO4 == 2Na+ + SO42-
BaCl2 == Ba2+ + 2Cl-
Na2SO4+BaCl2=BaSO4↓+2NaCl
SO42- + Ba2+ ==BaSO4 ↓
1、离子反应:
概念:在溶液中有离子参加或生成的反应。
本质:总是向着某些离子浓度减少的方向进行。
二、离子反应及其发生的条件
用实际参加反应的离子符号表示离子反应的式子
2、离子反应的表示方法——离子方程式
(1)定义:
Ba2+ + SO42- = BaSO4↓
(2)离子方程式的书写步骤:
①写:依据反应事实写出化学反应方程式(基础)
②拆: A、把易溶于水的强电解质改写成离子的形式,
强酸: HCl 、 H2SO4、HNO3等
强碱:KOH 、 NaOH 、Ba(OH)2 、Ca(OH)2等
可溶性盐:NaCl、Na2SO4、Na2CO3 等盐
3、离子反应的表示方法——离子方程式
B、不拆:单质、气体、氧化物、难溶物(记溶解性表)、难电离物质(记住:弱酸,弱碱、水、少数盐)仍用化学式表示
气体或单质:H2、CO2、Fe、Mg等
氧化物: CuO、Na2O
难溶物:BaSO4、BaCO3、CaCO3、AgCl等
弱酸:H2CO3、CH3COOH等
弱碱:NH3·H2O、Cu(OH)2等难溶性碱
水: H2O
③删:删去方程式两边不参加反应的离子,并使方程式中系数为最简整数比。
④查: A、原子是否守恒
B、电荷是否守恒
例:2AgNO3+CuCl2==2AgCl↓+Cu(NO3)2
2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
2Ag+ +2 Cl- == 2AgCl↓
Ag+ + Cl- == AgCl↓
记忆知识:常见物质在水中的溶解性表
所有K+、Na+、 NH4+、 NO3ˉ、HCO3-、H2PO4—盐:都溶于水
SO42-盐:不溶Ba2+和Pb2+,微溶Ca2+、Ag+
Clˉ盐:不溶Ag+和亚汞( Hg2 2+ )
CO32-、 SiO32- 、 SO32- 、PO43-、HPO42—盐:只溶K+、Na+、NH4+
OH-:溶水有NaOH、KOH、Ba(OH)2、NH3·H2O 、微溶 Ca(OH)2
3、意义
[思考与讨论]
结论:强酸与强碱发生中和反应的实质是,强酸电离出的H+与强碱电离出的OH-结合生成H2O。
练一练:
用离子方程式表示下列的反应
1、Na2SO4+BaCl2
2、Na2SO4+Ba(OH)2
3、BaCl2+H2SO4
4、BaCl2+Na2CO3
5、Na2CO3+Ba(OH)2
6、Na2CO3+HCl
7、Na2CO3+H2SO4
8、NaOH+HCl
9、NaOH+H2SO4
10、Ba(OH)2+HCl
11、Ba(OH)2+H2SO4
12、Zn+HCl
13、Zn+H2SO4
SO42— + Ba2+ == BaSO4↓
OH— + H+ == H2O
CO32— + Ba2+ == BaCO3↓
CO32— + 2H+ =H2O+CO2↑
Ba2++2OH— +2H+ +SO42—=BaSO4↓+2H2O
Zn + 2H+ == Zn2++ H2↑
你能得到什么启示?
化学方程式表示的是一个具体的化学反应,而离子方程式不仅可表示某个具体的化学反应,而且可表示同一类型的离子反应。
思考:离子反应OH-+H+=H2O表示酸碱中和反应的实质,它是否能表示所有的强酸和强碱的反应?举例说明。
不能,如:Ba(OH)2+H2SO4=BaSO4↓+2H2O的离子方程式为:Ba2++2OH— +2H+ +SO42—==BaSO4↓+2H2O
【练习】分别写出一个符合下列离子方程式的化学方程式
(1)Ba2++SO42-=BaSO4↓
(2)Zn+2Ag+=2Ag+Zn2+
(3)CO32-+2H+=CO2↑+H2O
。
如:Ba(OH)2+Na2SO4;BaCl2+K2SO4;Ba(NO3)2+H2SO4等
Zn+2AgNO3=2Ag+Zn(NO3)2
如:Na2CO3+HCl;K2CO3+H2SO4等
(1)Fe2O3+ H2SO4
(2)Zn+CuSO4
(3) FeCl3+KOH
(4)NaOH+CH3COOH
(5)CaCO3+HNO3
(6)NaHCO3+NaHSO4
练习1.写出下列反应的离子方程式
Fe2O3+6H+=2Fe3++3H2O
Zn+Cu2+=Cu+Zn2+
Fe3++3OH-=Fe(OH)3↓
OH-+CH3COOH=CH3COO-+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
HCO3-+H+=CO2↑+H2O
4、离子反应发生的条件
(1)生成沉淀(难溶物质)
(2)生成气体(挥发性物质)
(3)生成难电离物质(水、弱酸、弱碱)
本质:某些离子浓度减少
复分解反应类型:
(4)溶液中的置换反应
(5)……
氧化还原反应类型:
练习2. 判断下列离子方程式是否正确:
A.稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ +H2↑
B.氧化铜溶于稀硫酸: Cu2+ + SO42-=CuSO4
C.H2SO4与Ba(OH)2溶液反应:
Ba2++OH-+H++SO42- = BaSO4↓+H2O
D.CH3COOH溶液与NaOH溶液反应:
H++ OH— = H2O
E.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
F.铁与稀硫酸反应:Fe+2H+=Fe3++H2↑
G. 硫酸与Cu(OH)2反应:H++ OH— = H2O
全错!
练习3. 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于
醋酸铵溶液中,形成无色的溶液,其化学方程式是:
PbSO4+2CH3COONH4 =(CH3COO)2Pb+(NH4)2SO4。
当(CH3COO)2Pb (醋酸铅)溶液中通入H2S时,有黑色
沉淀PbS和CH3COOH生成。表示这个反应的
有关离子方程式正确的是( )
A.(CH3COO)2Pb +H2S = PbS↓+2 CH3COOH
B.Pb2++H2S = PbS↓+2H+
C.Pb2++2CH3COO-+H2S = PbS↓+2CH3COOH
D.Pb2++2CH3COO-+2H++S2- = PbS↓+2CH3COOH
A
练习4、某同学在实验室中进行如下实验:
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中的化学方程式为2HCl+Zn=ZnCl2+H2↑
D.Ⅲ中发生的反应是氧化还原反应
A
练习5、下列同组中的两个不同反应(在溶液中进行),可用同一离子方程式表示的是( )
A.Na2CO3+HNO3与NaHCO3+HNO3
B.CaCl2+Na2CO3与Ca(NO3)2+K2CO3
C.Ba(OH)2+NaHSO4与BaCl2+NaHSO4
D.NaOH+H2SO4与Fe(OH)3+H2SO4
B
练习6、铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
A.OH-+HCl=H2O+Cl-
B.Ca(OH)2+Cu2+=Ca2++Cu(OH)2↓
C.Fe+Cu2+=Cu+Fe2+
D.2Fe+6H+=2Fe3++3H2↑
C
小结一:离子方程式的正误判断的几条原则
1、必须符合物质反应的客观事实
如铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑(错误)
正确的是: 。
如稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑(错误)
正确的是: 。
Fe+2H+=Fe2++H2↑
不反应
2、必须符合拆分原则
如氢氧化铜和稀硫酸反应:OH-+H+=H2O (错误)
正确的是: 。
如氨气通入醋酸溶液中:
CH3COOH+NH3=CH3COONH4 (错误)
正确的是: 。
Cu(OH)2+2H+=Cu2++2H2O
CH3COOH+NH3=CH3COO—+ NH4+
3、必须遵守原子守恒和电荷守恒
如铜和硝酸银溶液反应:Cu +Ag+ = Cu2++Ag(错误)
正确的是: 。
Cu +2Ag+ = Cu2++2Ag
4、检查是否漏掉参加反应的离子
如氢氧化钡和硫酸铜溶液反应:
Ba2++SO42-=BaSO4↓(错误)
正确的是:
Ba2++2OH—+Cu2++SO42-=BaSO4↓+Cu(OH)2 ↓
5、必须遵守反应物或生成物的配比关系
如氢氧化钡和稀硫酸溶液的反应:
Ba2++OH-+H++SO42-=BaSO4↓+H2O(错误)
正确的是:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
1、非溶液中进行的反应,一般不能写离子方程式。
小结二:离子方程式书写的几个注意事项:
例:氯化铵固体与熟石灰固体之间经加热生成氨气的反应;金属与浓硫酸的反应等
练习1、下列反应不是离子反应的是( )
A.NaOH溶液与CuCl2溶液反应
B.2H2+O2 2H2O
C.Na2CO3溶液与稀HCl反应
D.CaCl2溶液与K2CO3溶液反应
A
2、单质、氧化物、气体在离子方程式中一律写化学式;弱酸(CH3COOH、H2SO3等)、弱碱(如NH3·H2O)、水等难电离的物质必须写化学式;难溶于水的物质(如CaCO3、BaSO3、BaSO4、Fe(OH)3等)必须写化学式。
如:CO2+2OH-=CO32-+H2O
CaCO 3+2H+=Ca2++CO2↑+H2O
3、酸式酸根离子除HSO4-可以拆写外,
其余均不能拆写
例:小苏打(NaHCO3)溶液和稀HCl反应:
HCO3- + H+ == CO2↑+H2O
例:NaHCO3溶液和NaHSO4溶液混合:
HCO3- + H+ == CO2↑+H2O
例:NaHSO3溶液和稀硫酸反应:
HSO3- + H+ == SO2↑+H2O
4、对于微溶物的处理
①在生成物里的微溶物用化学式表示
例:Na2SO4溶液中加入AgNO3溶液
2Ag++SO42- = Ag2SO4↓
②当反应物里微溶物处于溶液状态,应写
成离子形式;当反应物里有微溶物处于
浊液或固态,应写化学式
例:澄清石灰水与稀HCl OH- +H+ = H2O
例:石灰乳中滴加稀HCl
Ca(OH)2 +2H+ = Ca2++ 2H2O
5、对于不稳定性酸和弱碱(NH3·H2O)的处理:
①如生成H2CO3,则写成“CO2↑+H2O”,生成H2SO3,则写成“SO2↑+H2O”。
如稀盐酸滴在石灰石上:
CaCO3+2H+=Ca2++H2CO3 (错误)
②生成NH3·H2O:若在浓溶液或加热条件下生成,则写成“NH3↑+H2O”,否则写成“NH3·H2O”的形式。
第二节 离子反应
离子共存问题
离子共存问题
1、看离子间是否反应
复分解反应类型
氧化还原反应类型
某些离子
浓度减少
沉淀
气体
弱电解质
不能共存就是意味着相互间能发生离子反应,反之能共存。
(1)有沉淀生成
①如Ba2+、Ca2+、Mg2+、Ag+等不能与SO32-、SO42- 、
CO32-等大量共存;
②Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
③Pb2+与SO42-、Ca2+与PO43-、Ag+与Cl-不能大量共存
由于发生复分解反应,离子不能大量共存
(2)有气体产生
如①NH4+与OH—不能大量共存
②CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
由于发生复分解反应,离子不能大量共存
(3)有弱电解质生成
如①H+与CH3COO-、CO32—、S2-、SO32—等生成弱酸
②OH—与NH4+、Cu2+、Fe3+等生成弱碱或沉淀
③H+与OH—生成水,这些离子不能大量共存。
由于发生复分解反应,离子不能大量共存
2、由于发生氧化还原反应,离子不能大量共存
3、由于形成络合离子,离子不能大量共存
2、看清题目附加条件
(1)溶液无色透明时,则不能有有色离子(如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫红色))。
(2)强酸性溶液(或pH<7或石蕊变红)中不存在能与H+反应的离子(OH-、和弱酸根如CO32-、HCO3-、F-、CH3COO-、S2-、PO43-等)。
(3)强碱性溶液(pH>7或酚酞变红)中不存在能与OH-反应的离子(H+、和弱碱根如NH4+、Mg2+~Ag+及HCO3-、HS-等)。
(4)所有的多元弱酸的酸式酸根(如HCO3-、HSO3-、HS-、H2PO4-、HPO42-等)既不能跟H+又不能跟OH-大量共存。
1、下列各组离子能大量共存的是( )
A.Na+、Mg2+、OH-、Cl-
B.Ba2+、K+、CO32-、NO3-
C.Na+、K+、Cl-、HCO3-
D.H+、Na+、Cl-、OH-
C
2、在下列溶液中,各组离子一定能够大量共存的是 ( )
A.pH<7的溶液:
Na+、OH-、CO32-、Ca2+
B.使酚酞试液变红的溶液:
K+、Ba2+、Cl-、NO3-
C.无色透明溶液:Cu2+、K+、NO3-、Cl-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
B
(1)在酸性条件下,一定不能大量共存的有 (填序号,下同)。
(2)在碱性条件下,一定不能大量共存的有 。
(3)在无色溶液中,一定不能大量共存的有 。
(4)在含有Ba2+的溶液中,一定不能大量共存的有 。
第二节 离子反应
导入
水会导电吗
NaCl固体 KNO3固体 蒸馏水
不亮
不亮
不亮
否
否
否
【实验1-2】
NaCl溶液 KNO3溶液
小灯泡
是否 导电
亮
亮
是
是
NaCl、KNO3的熔融状态也可以导电
小灯泡
是否导电
一、电离
1、概念:
产生可以自由移动的离子的过程
2、条件:
①溶于水:
如酸、碱、盐在水中电离
②受热熔化:
如某些金属化合物(Na2O、NaCl、NaOH等)
由阳离子和阴离子构成的离子化合物
固态NaCl虽含有带正电荷的钠离子和带负电荷的氯离子, 但由于带相反电荷的离子间的相互作用, Na+和Cl-按一定的规则紧密的排列着。这些离子不能自由移动,因此干燥的氯化钠固体不能导电。
【原因】
当NaCl加入水时,在水分子的作用下, Na+ 和Cl-脱离NaCl固体表面,进入水中,成为自由移动的水合钠离子和水合氯离子。
而蔗糖、酒精溶液本身就没含有阴阳离子,溶于水时也没有电离出自由移动的阴、阳离子,所以蔗糖、酒精溶液均不能导电。
【实验表明】熔融NaCl能导电。
NaCl固体不导电,当NaCl固体放入水中时,水分子破坏了离子间的相互作用, 使Na+ 和Cl—发生解离,那么能否给NaCl以很高的能量,破坏Na+ 和Cl—之间的静电作用,使其解离出来呢?让我们设计实验验证这种猜想吧。
思考
例如:NaCl、KNO3、NaOH、H3PO4等
1、电解质:在水溶液中或熔融状态下能够导电的化合物
范围:酸、碱、盐、活泼金属氧化物和水
自身解离出自由移动的离子而导电.
二、电解质与非电解质
2、非电解质:在水溶液中和熔融状态下不能够导电的
化合物
范围:非金属氧化物、大部分有机物、非酸性气态氢化物
(如) NH3
例如:蔗糖、酒精(乙醇)等
水溶液中:酸、碱、盐
熔融状态:多数碱、盐、金属氧化物
练习2、下列物质中:①氢氧化钠固体②铜③氢氧化钠溶液④盐酸⑤熔融的碳酸钾⑥硫酸钡⑦蔗糖⑧二氧化碳⑨氨气⑩醋酸 属于电解质的是哪些?属于非电解质的是哪些?
在水溶液里或熔融状态下能够导电的化合物。
电解质
在水溶液里和熔融状态下都不导电的化合物。
非电解质
物质
混合物
纯净物
化合物
单质
电解质
非电解质
既不是电解质也不是非电解质
电解质:
非电解质:
分析物质类别
①
⑤
⑥
⑦
⑧
⑨
⑩
1.单质
混合物
既不是电解质也不是非电解质
2.CO2、NH3等溶于水得到的水溶液能导电,但它们是非电解质,因为导电的离子不是其本身电离出来的。
3.难溶的盐(BaSO4等)虽然水溶液不能导电, 但是在融化时能导电,也是电解质。
【注意】
4.氯化氢是电解质,盐酸是氯化氢的水溶液,盐酸是混合物,既不是电解质也不是非电解质
1.石墨、铜能导电,所以是电解质。
2.由于BaSO4不溶于水,所以不是电解质。
3.盐酸能导电,所以盐酸是电解质。
4.Cl2、SO2、NH3、Na2O溶于水可导电,所以均为电解质。
【练习】判断以下几种说法是否正确,并说明原因
×
×
×
×
对比观看熔融硝酸钾的导电情况
【实验表明】熔融KNO3能导电。
KNO3等离子构成的化合物的导电情况与氯化钠的相同
练习3、下列物质中:属于电解质的是哪些?属于非电解质的是哪些?哪些能导电?
铁、苯、汽油、浓硫酸、硝酸、氨水、NH3●H2O、
明矾、氢氧化铁、石墨、天然气 、氧化钠、二氧化硫。
概念的生成(电解质在水溶液电离有强弱之分)
二、强电解质和弱电解质
强电解质:在水溶液里全部分子电离成离子的电解质。
弱电解质:在水溶液里只有部分分子电离成离子的电解质。
特点:完全电离,无分子
特点:微弱电离,分子多,离子少
1.定义:
常见的强电解质:
①强酸:HCl、H2SO4、HNO3、 HI、HBr、 HClO4等。
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
③绝大多数盐:NaCl、(NH4)2SO4、BaSO4等。
④活泼金属氧化物:K2O、Na2O等
2.常见的强电解质和弱电解质
常见的弱电解质:
①弱酸:HF、HClO、H2S、CH3COOH等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等。
③水:水是极弱的电解质。
④两种盐:硫氰化铁Fe(SCN)3、醋酸铅Pb(CH3COO)2
2.常见的强电解质和弱电解质
强弱电解质与其溶解性无关。如:某些难溶或微溶于水的盐,虽然其溶解度很小,但是其溶于水的部分,却是完全电离的,所以它们仍然属于强电解质,例如:CaCO3、BaSO4等。
HNO3
CaCO3
MgCl2
Al2 (SO4)3
= H+ + NO3-
= Ca2+ + CO32-
= Mg2++ 2Cl-
= 2Al 3++ 3SO42-
1、强电解质在水中或熔融下完全电离,
书写用 “=” 等号:
三、电离方程式的书写
●电离方程式∶ 表示电解质在水溶液中
或熔化状态下电离成离子的过程的式子。
2、弱电解质在水中只有部分电离
书写用可逆符号:
NH4+ + OH-
HClO
NH3·H2O
CH3COOH
H+ + ClO-
H+ + CH3COO-
H2O
H+ + OH-
3、弱酸的电离方程式书写
第一步:
第二步:
H+ + HCO3-
H2CO3
难
HCO3-
H+ + CO32-
更难
A、一元弱酸难电离,使用可逆符号
C、多元弱酸的酸式根难电离,分步写:
HSO3- 、 HCO3- 、 HS- 、 HPO42- 、 H2PO4-
H+ + CH3COO-
CH3COOH
B、多元弱酸分步电离,使用可逆符号(H2CO3):
4、弱碱电离方程式的书写:
Cu(OH)2
Cu2+ + 2OH-
Fe(OH)3
Fe3+ + 3OH-
A、一元难电离使用可逆符号:
B、多元弱碱的电离相当复杂,高中阶段
只须一步写出;
NH3·H2O
NH4+ + OH-
练习2、写出CH3COOH、 H2SO4、H2CO3、Ca(OH)2、 NH3·H2O 、Mg(OH)2、CaCl2、NaHCO3的电离方程式。
练习3、写出HClO、H2S、 KOH、Ba(OH)2、 NH3·H2O 、 Fe(OH )3、BaCl2、NaHSO3 、 AlCl3的电离方程式。
思考1、NaHSO4在水溶液及熔融状态的电离方程式?
水中: NaHSO4=Na++H++SO42-
熔融状态: NaHSO4=Na++HSO4-
注意:对于强酸的酸式盐,在水溶液中能一步电离出H+;
对于弱酸的酸式盐,在水溶液中不能一步电离出H+;
对于任何酸式盐,在熔融状态都不能电离出H+ 。
灯泡变化:
利用左图的装置来做下面的实验:在烧杯里盛半杯Ba(OH)2溶液,然后向容器里滴入稀硫酸。随着H2SO4的滴入,你能观察到电灯有什么变化?为什么?请从电离的角度来分析。
探究:
亮 熄灭 亮
第二节 离子反应
离子反应及其发生的条件
生成沉淀、放出气体或生成水。
【回顾】复分解反应发生的条件?
【实验1-3】实验探究离子反应发生的实质
思考:Na2SO4溶液能与BaCl2溶液反应,却不能与稀HCl溶液反应,请从离子数目变化角度分析原因。
实验 现象 化学方程式 混合前后各种离子的数量变化
1.向盛有2mLNa2SO4 溶液的试管中加入2mL稀HCl溶液
2.向盛有2mLNa2SO4 溶液的试管中加入 2mLBaCl2溶液
无明显变化
生成白色沉淀
——
都不变
Na2SO4+BaCl2=BaSO4↓+2NaCl
SO42-、Ba2+数量减少
电解质溶于水后电离成为离子,不同的电解质溶液混合时发生的反应实质上是离子之间的反应。
Na2SO4 == 2Na+ + SO42-
BaCl2 == Ba2+ + 2Cl-
Na2SO4+BaCl2=BaSO4↓+2NaCl
SO42- + Ba2+ ==BaSO4 ↓
1、离子反应:
概念:在溶液中有离子参加或生成的反应。
本质:总是向着某些离子浓度减少的方向进行。
二、离子反应及其发生的条件
用实际参加反应的离子符号表示离子反应的式子
2、离子反应的表示方法——离子方程式
(1)定义:
Ba2+ + SO42- = BaSO4↓
(2)离子方程式的书写步骤:
①写:依据反应事实写出化学反应方程式(基础)
②拆: A、把易溶于水的强电解质改写成离子的形式,
强酸: HCl 、 H2SO4、HNO3等
强碱:KOH 、 NaOH 、Ba(OH)2 、Ca(OH)2等
可溶性盐:NaCl、Na2SO4、Na2CO3 等盐
3、离子反应的表示方法——离子方程式
B、不拆:单质、气体、氧化物、难溶物(记溶解性表)、难电离物质(记住:弱酸,弱碱、水、少数盐)仍用化学式表示
气体或单质:H2、CO2、Fe、Mg等
氧化物: CuO、Na2O
难溶物:BaSO4、BaCO3、CaCO3、AgCl等
弱酸:H2CO3、CH3COOH等
弱碱:NH3·H2O、Cu(OH)2等难溶性碱
水: H2O
③删:删去方程式两边不参加反应的离子,并使方程式中系数为最简整数比。
④查: A、原子是否守恒
B、电荷是否守恒
例:2AgNO3+CuCl2==2AgCl↓+Cu(NO3)2
2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
2Ag+ +2 Cl- == 2AgCl↓
Ag+ + Cl- == AgCl↓
记忆知识:常见物质在水中的溶解性表
所有K+、Na+、 NH4+、 NO3ˉ、HCO3-、H2PO4—盐:都溶于水
SO42-盐:不溶Ba2+和Pb2+,微溶Ca2+、Ag+
Clˉ盐:不溶Ag+和亚汞( Hg2 2+ )
CO32-、 SiO32- 、 SO32- 、PO43-、HPO42—盐:只溶K+、Na+、NH4+
OH-:溶水有NaOH、KOH、Ba(OH)2、NH3·H2O 、微溶 Ca(OH)2
3、意义
[思考与讨论]
结论:强酸与强碱发生中和反应的实质是,强酸电离出的H+与强碱电离出的OH-结合生成H2O。
练一练:
用离子方程式表示下列的反应
1、Na2SO4+BaCl2
2、Na2SO4+Ba(OH)2
3、BaCl2+H2SO4
4、BaCl2+Na2CO3
5、Na2CO3+Ba(OH)2
6、Na2CO3+HCl
7、Na2CO3+H2SO4
8、NaOH+HCl
9、NaOH+H2SO4
10、Ba(OH)2+HCl
11、Ba(OH)2+H2SO4
12、Zn+HCl
13、Zn+H2SO4
SO42— + Ba2+ == BaSO4↓
OH— + H+ == H2O
CO32— + Ba2+ == BaCO3↓
CO32— + 2H+ =H2O+CO2↑
Ba2++2OH— +2H+ +SO42—=BaSO4↓+2H2O
Zn + 2H+ == Zn2++ H2↑
你能得到什么启示?
化学方程式表示的是一个具体的化学反应,而离子方程式不仅可表示某个具体的化学反应,而且可表示同一类型的离子反应。
思考:离子反应OH-+H+=H2O表示酸碱中和反应的实质,它是否能表示所有的强酸和强碱的反应?举例说明。
不能,如:Ba(OH)2+H2SO4=BaSO4↓+2H2O的离子方程式为:Ba2++2OH— +2H+ +SO42—==BaSO4↓+2H2O
【练习】分别写出一个符合下列离子方程式的化学方程式
(1)Ba2++SO42-=BaSO4↓
(2)Zn+2Ag+=2Ag+Zn2+
(3)CO32-+2H+=CO2↑+H2O
。
如:Ba(OH)2+Na2SO4;BaCl2+K2SO4;Ba(NO3)2+H2SO4等
Zn+2AgNO3=2Ag+Zn(NO3)2
如:Na2CO3+HCl;K2CO3+H2SO4等
(1)Fe2O3+ H2SO4
(2)Zn+CuSO4
(3) FeCl3+KOH
(4)NaOH+CH3COOH
(5)CaCO3+HNO3
(6)NaHCO3+NaHSO4
练习1.写出下列反应的离子方程式
Fe2O3+6H+=2Fe3++3H2O
Zn+Cu2+=Cu+Zn2+
Fe3++3OH-=Fe(OH)3↓
OH-+CH3COOH=CH3COO-+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
HCO3-+H+=CO2↑+H2O
4、离子反应发生的条件
(1)生成沉淀(难溶物质)
(2)生成气体(挥发性物质)
(3)生成难电离物质(水、弱酸、弱碱)
本质:某些离子浓度减少
复分解反应类型:
(4)溶液中的置换反应
(5)……
氧化还原反应类型:
练习2. 判断下列离子方程式是否正确:
A.稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ +H2↑
B.氧化铜溶于稀硫酸: Cu2+ + SO42-=CuSO4
C.H2SO4与Ba(OH)2溶液反应:
Ba2++OH-+H++SO42- = BaSO4↓+H2O
D.CH3COOH溶液与NaOH溶液反应:
H++ OH— = H2O
E.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
F.铁与稀硫酸反应:Fe+2H+=Fe3++H2↑
G. 硫酸与Cu(OH)2反应:H++ OH— = H2O
全错!
练习3. 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于
醋酸铵溶液中,形成无色的溶液,其化学方程式是:
PbSO4+2CH3COONH4 =(CH3COO)2Pb+(NH4)2SO4。
当(CH3COO)2Pb (醋酸铅)溶液中通入H2S时,有黑色
沉淀PbS和CH3COOH生成。表示这个反应的
有关离子方程式正确的是( )
A.(CH3COO)2Pb +H2S = PbS↓+2 CH3COOH
B.Pb2++H2S = PbS↓+2H+
C.Pb2++2CH3COO-+H2S = PbS↓+2CH3COOH
D.Pb2++2CH3COO-+2H++S2- = PbS↓+2CH3COOH
A
练习4、某同学在实验室中进行如下实验:
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中的化学方程式为2HCl+Zn=ZnCl2+H2↑
D.Ⅲ中发生的反应是氧化还原反应
A
练习5、下列同组中的两个不同反应(在溶液中进行),可用同一离子方程式表示的是( )
A.Na2CO3+HNO3与NaHCO3+HNO3
B.CaCl2+Na2CO3与Ca(NO3)2+K2CO3
C.Ba(OH)2+NaHSO4与BaCl2+NaHSO4
D.NaOH+H2SO4与Fe(OH)3+H2SO4
B
练习6、铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
A.OH-+HCl=H2O+Cl-
B.Ca(OH)2+Cu2+=Ca2++Cu(OH)2↓
C.Fe+Cu2+=Cu+Fe2+
D.2Fe+6H+=2Fe3++3H2↑
C
小结一:离子方程式的正误判断的几条原则
1、必须符合物质反应的客观事实
如铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑(错误)
正确的是: 。
如稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑(错误)
正确的是: 。
Fe+2H+=Fe2++H2↑
不反应
2、必须符合拆分原则
如氢氧化铜和稀硫酸反应:OH-+H+=H2O (错误)
正确的是: 。
如氨气通入醋酸溶液中:
CH3COOH+NH3=CH3COONH4 (错误)
正确的是: 。
Cu(OH)2+2H+=Cu2++2H2O
CH3COOH+NH3=CH3COO—+ NH4+
3、必须遵守原子守恒和电荷守恒
如铜和硝酸银溶液反应:Cu +Ag+ = Cu2++Ag(错误)
正确的是: 。
Cu +2Ag+ = Cu2++2Ag
4、检查是否漏掉参加反应的离子
如氢氧化钡和硫酸铜溶液反应:
Ba2++SO42-=BaSO4↓(错误)
正确的是:
Ba2++2OH—+Cu2++SO42-=BaSO4↓+Cu(OH)2 ↓
5、必须遵守反应物或生成物的配比关系
如氢氧化钡和稀硫酸溶液的反应:
Ba2++OH-+H++SO42-=BaSO4↓+H2O(错误)
正确的是:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
1、非溶液中进行的反应,一般不能写离子方程式。
小结二:离子方程式书写的几个注意事项:
例:氯化铵固体与熟石灰固体之间经加热生成氨气的反应;金属与浓硫酸的反应等
练习1、下列反应不是离子反应的是( )
A.NaOH溶液与CuCl2溶液反应
B.2H2+O2 2H2O
C.Na2CO3溶液与稀HCl反应
D.CaCl2溶液与K2CO3溶液反应
A
2、单质、氧化物、气体在离子方程式中一律写化学式;弱酸(CH3COOH、H2SO3等)、弱碱(如NH3·H2O)、水等难电离的物质必须写化学式;难溶于水的物质(如CaCO3、BaSO3、BaSO4、Fe(OH)3等)必须写化学式。
如:CO2+2OH-=CO32-+H2O
CaCO 3+2H+=Ca2++CO2↑+H2O
3、酸式酸根离子除HSO4-可以拆写外,
其余均不能拆写
例:小苏打(NaHCO3)溶液和稀HCl反应:
HCO3- + H+ == CO2↑+H2O
例:NaHCO3溶液和NaHSO4溶液混合:
HCO3- + H+ == CO2↑+H2O
例:NaHSO3溶液和稀硫酸反应:
HSO3- + H+ == SO2↑+H2O
4、对于微溶物的处理
①在生成物里的微溶物用化学式表示
例:Na2SO4溶液中加入AgNO3溶液
2Ag++SO42- = Ag2SO4↓
②当反应物里微溶物处于溶液状态,应写
成离子形式;当反应物里有微溶物处于
浊液或固态,应写化学式
例:澄清石灰水与稀HCl OH- +H+ = H2O
例:石灰乳中滴加稀HCl
Ca(OH)2 +2H+ = Ca2++ 2H2O
5、对于不稳定性酸和弱碱(NH3·H2O)的处理:
①如生成H2CO3,则写成“CO2↑+H2O”,生成H2SO3,则写成“SO2↑+H2O”。
如稀盐酸滴在石灰石上:
CaCO3+2H+=Ca2++H2CO3 (错误)
②生成NH3·H2O:若在浓溶液或加热条件下生成,则写成“NH3↑+H2O”,否则写成“NH3·H2O”的形式。
第二节 离子反应
离子共存问题
离子共存问题
1、看离子间是否反应
复分解反应类型
氧化还原反应类型
某些离子
浓度减少
沉淀
气体
弱电解质
不能共存就是意味着相互间能发生离子反应,反之能共存。
(1)有沉淀生成
①如Ba2+、Ca2+、Mg2+、Ag+等不能与SO32-、SO42- 、
CO32-等大量共存;
②Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
③Pb2+与SO42-、Ca2+与PO43-、Ag+与Cl-不能大量共存
由于发生复分解反应,离子不能大量共存
(2)有气体产生
如①NH4+与OH—不能大量共存
②CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
由于发生复分解反应,离子不能大量共存
(3)有弱电解质生成
如①H+与CH3COO-、CO32—、S2-、SO32—等生成弱酸
②OH—与NH4+、Cu2+、Fe3+等生成弱碱或沉淀
③H+与OH—生成水,这些离子不能大量共存。
由于发生复分解反应,离子不能大量共存
2、由于发生氧化还原反应,离子不能大量共存
3、由于形成络合离子,离子不能大量共存
2、看清题目附加条件
(1)溶液无色透明时,则不能有有色离子(如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫红色))。
(2)强酸性溶液(或pH<7或石蕊变红)中不存在能与H+反应的离子(OH-、和弱酸根如CO32-、HCO3-、F-、CH3COO-、S2-、PO43-等)。
(3)强碱性溶液(pH>7或酚酞变红)中不存在能与OH-反应的离子(H+、和弱碱根如NH4+、Mg2+~Ag+及HCO3-、HS-等)。
(4)所有的多元弱酸的酸式酸根(如HCO3-、HSO3-、HS-、H2PO4-、HPO42-等)既不能跟H+又不能跟OH-大量共存。
1、下列各组离子能大量共存的是( )
A.Na+、Mg2+、OH-、Cl-
B.Ba2+、K+、CO32-、NO3-
C.Na+、K+、Cl-、HCO3-
D.H+、Na+、Cl-、OH-
C
2、在下列溶液中,各组离子一定能够大量共存的是 ( )
A.pH<7的溶液:
Na+、OH-、CO32-、Ca2+
B.使酚酞试液变红的溶液:
K+、Ba2+、Cl-、NO3-
C.无色透明溶液:Cu2+、K+、NO3-、Cl-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
B
(1)在酸性条件下,一定不能大量共存的有 (填序号,下同)。
(2)在碱性条件下,一定不能大量共存的有 。
(3)在无色溶液中,一定不能大量共存的有 。
(4)在含有Ba2+的溶液中,一定不能大量共存的有 。
