化学人教版(2019)必修第一册4.3.1. 离子键(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.1. 离子键(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 456.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 10:33:19 | ||
图片预览




文档简介
(共17张PPT)
第四章 物质结构 元素周期律
第三节 化学键(第1课时)
第1课时 离子键
118种元素
上亿种物质
元素组成
原子分子构成
元素的原子之间通过什么作用形成如此丰富的物质呢?
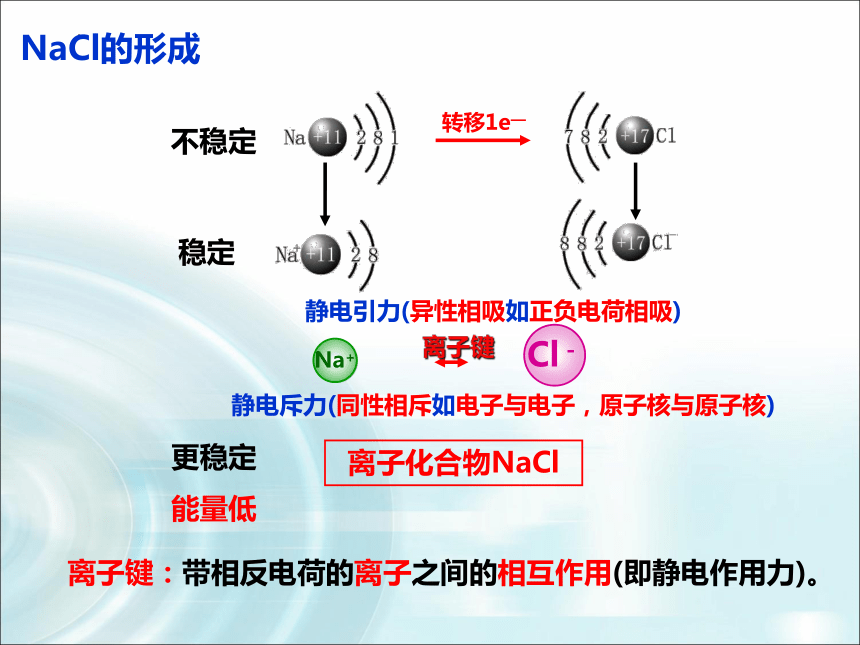
NaCl的形成
转移1e—
不稳定
稳定
更稳定
能量低
静电引力(异性相吸如正负电荷相吸)
Na+
Cl-
静电斥力(同性相斥如电子与电子,原子核与原子核)
离子键
离子化合物NaCl
离子键:带相反电荷的离子之间的相互作用(即静电作用力)。
在氯化钠晶体中,Na+和Cl- 之间存在哪些作用力?
1.Na+离子和Cl-离子间的静电相互吸引作用。
3.因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的离子键。
2.阴阳离子间电子与电子、原子核与原子核间的相互排斥作用。
注意:离子键——即静电作用力(包括吸引和排斥)
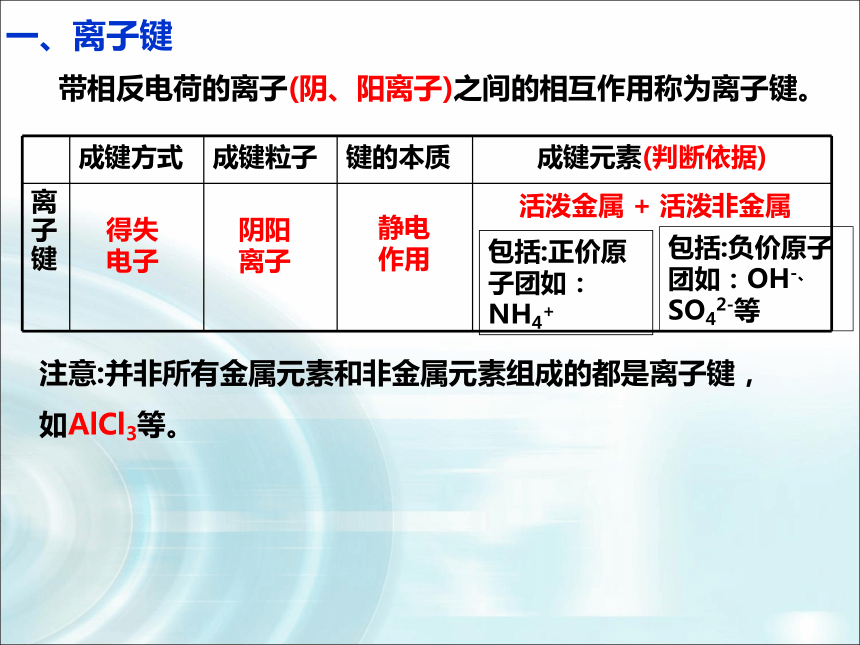
一、离子键
带相反电荷的离子(阴、阳离子)之间的相互作用称为离子键。
成键方式 成键粒子 键的本质 成键元素(判断依据)
离子键
得失电子
阴阳离子
静电作用
活泼金属 + 活泼非金属
包括:正价原子团如:NH4+
包括:负价原子团如:OH-、SO42-等
注意:并非所有金属元素和非金属元素组成的都是离子键,
如AlCl3等。
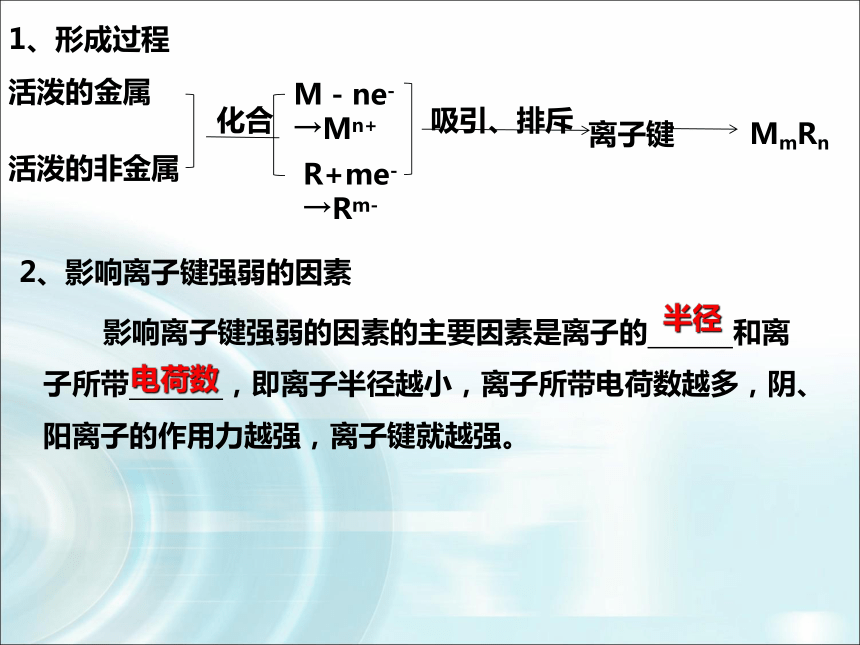
1、形成过程
活泼的金属
活泼的非金属
M-ne-→Mn+
R+me-→Rm-
离子键
MmRn
化合
吸引、排斥
2、影响离子键强弱的因素
影响离子键强弱的因素的主要因素是离子的 和离子所带 ,即离子半径越小,离子所带电荷数越多,阴、阳离子的作用力越强,离子键就越强。
半径
电荷数
二.离子化合物
1、定义:由离子键构成的化合物叫做离子化合物。
2、常见类型:活泼的金属氧化物、强碱和绝大多数盐都属于离子化合物。
思考:下列哪些物质中存在离子键属于离子化合物?
Na2O MgCl2 SO2 HCl H2SO4
Na2O2 NaOH KNO3 NH4Cl
注意:MgCl2中两个氯离子之间不存在离子键,离子键只存在带相反电荷的阴阳离子之间。
3、离子化合物的性质
①离子键一般比较牢固, 破坏它需要较高的能量,所以离子化合物的熔点一般比较 ,常温下为固体。
②离子化合物在溶于水或熔化时,离子键被破坏,形成自由移动的阴、阳离子,能够导电,故离子化合物都是 。
高
电解质
1.概念:
在元素符号周围用·或×表示原子的_ ___________的式子。
2.原子的电子式
3.阳离子的电子式
最外层电子
(1)简单阳离子电子式就是离子符号
(2)复杂阳离子
Na+ Mg2+
(尽可能对称,电子尽可能分布在元素符号的上、下、左、右4个位置,每个位置不超过2个电子)
H Na Mg Al Si P S Cl
H Na Mg Al Si P S Cl
×
×
×
×
三、电子式
同主族元素原子的电子式写法相同
5.离子化合物的电子式
由阴、阳离子的电子式组成,相同的离子不能合并,要遵偱阴、阳离子交替的原则排布。
举例:NaCl MgCl2 NH4Cl
练习:CaS Na2O
4.阴离子的电子式
在元素符号周围标出最外层电子,用“[ ]”括起来,并在右上角注明所带电荷数。
Cl
×
O
2
举例:Cl- O2-
少的在中间,多的围着少的打转转
6.用电子式表示离子化合物形成过程
Na1 Cl1
确定原子的个数
Na + Cl
写出电子式
写出电子式
Na
×
Cl
+
Cl
×
Na+
Na2 S1
确定原子的个数
2Na + S
写出电子式
写出电子式
2Na
×
S
+
S
×
×
Na+
2
Na
×
S
+
Na
×
+
S
×
×
Na+
2
Na+
S
×
×
Na+
2
Na+
二、用电子式表示下列物质形成过程
1.MgCl2
2. K2O
一、写出下列物质的电子式
1.NaBr 2.CaF2 3. CaO
1.下列说法正确的是( )
A.离子键就是阴阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系能量降低
D.离子化合物CaCl2中,两个氯离子间也存在离子键
C
3.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.溶于水 B.熔点较高
C.水溶液能导电 D.熔融状态能导电
2.下列不是离子化合物的是( )
A.H2O B.Na2S
C.KOH D.NH4NO3
A
D
4.下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A.10与19 B.6与16
C.11与17 D.14与8
5.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.Na2O的电 子式:
B.质量数为37的氯原子:
C.Br-的电子式:
D.Ar的结构示意图:
C
C
第四章 物质结构 元素周期律
第三节 化学键(第1课时)
第1课时 离子键
118种元素
上亿种物质
元素组成
原子分子构成
元素的原子之间通过什么作用形成如此丰富的物质呢?
NaCl的形成
转移1e—
不稳定
稳定
更稳定
能量低
静电引力(异性相吸如正负电荷相吸)
Na+
Cl-
静电斥力(同性相斥如电子与电子,原子核与原子核)
离子键
离子化合物NaCl
离子键:带相反电荷的离子之间的相互作用(即静电作用力)。
在氯化钠晶体中,Na+和Cl- 之间存在哪些作用力?
1.Na+离子和Cl-离子间的静电相互吸引作用。
3.因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的离子键。
2.阴阳离子间电子与电子、原子核与原子核间的相互排斥作用。
注意:离子键——即静电作用力(包括吸引和排斥)
一、离子键
带相反电荷的离子(阴、阳离子)之间的相互作用称为离子键。
成键方式 成键粒子 键的本质 成键元素(判断依据)
离子键
得失电子
阴阳离子
静电作用
活泼金属 + 活泼非金属
包括:正价原子团如:NH4+
包括:负价原子团如:OH-、SO42-等
注意:并非所有金属元素和非金属元素组成的都是离子键,
如AlCl3等。
1、形成过程
活泼的金属
活泼的非金属
M-ne-→Mn+
R+me-→Rm-
离子键
MmRn
化合
吸引、排斥
2、影响离子键强弱的因素
影响离子键强弱的因素的主要因素是离子的 和离子所带 ,即离子半径越小,离子所带电荷数越多,阴、阳离子的作用力越强,离子键就越强。
半径
电荷数
二.离子化合物
1、定义:由离子键构成的化合物叫做离子化合物。
2、常见类型:活泼的金属氧化物、强碱和绝大多数盐都属于离子化合物。
思考:下列哪些物质中存在离子键属于离子化合物?
Na2O MgCl2 SO2 HCl H2SO4
Na2O2 NaOH KNO3 NH4Cl
注意:MgCl2中两个氯离子之间不存在离子键,离子键只存在带相反电荷的阴阳离子之间。
3、离子化合物的性质
①离子键一般比较牢固, 破坏它需要较高的能量,所以离子化合物的熔点一般比较 ,常温下为固体。
②离子化合物在溶于水或熔化时,离子键被破坏,形成自由移动的阴、阳离子,能够导电,故离子化合物都是 。
高
电解质
1.概念:
在元素符号周围用·或×表示原子的_ ___________的式子。
2.原子的电子式
3.阳离子的电子式
最外层电子
(1)简单阳离子电子式就是离子符号
(2)复杂阳离子
Na+ Mg2+
(尽可能对称,电子尽可能分布在元素符号的上、下、左、右4个位置,每个位置不超过2个电子)
H Na Mg Al Si P S Cl
H Na Mg Al Si P S Cl
×
×
×
×
三、电子式
同主族元素原子的电子式写法相同
5.离子化合物的电子式
由阴、阳离子的电子式组成,相同的离子不能合并,要遵偱阴、阳离子交替的原则排布。
举例:NaCl MgCl2 NH4Cl
练习:CaS Na2O
4.阴离子的电子式
在元素符号周围标出最外层电子,用“[ ]”括起来,并在右上角注明所带电荷数。
Cl
×
O
2
举例:Cl- O2-
少的在中间,多的围着少的打转转
6.用电子式表示离子化合物形成过程
Na1 Cl1
确定原子的个数
Na + Cl
写出电子式
写出电子式
Na
×
Cl
+
Cl
×
Na+
Na2 S1
确定原子的个数
2Na + S
写出电子式
写出电子式
2Na
×
S
+
S
×
×
Na+
2
Na
×
S
+
Na
×
+
S
×
×
Na+
2
Na+
S
×
×
Na+
2
Na+
二、用电子式表示下列物质形成过程
1.MgCl2
2. K2O
一、写出下列物质的电子式
1.NaBr 2.CaF2 3. CaO
1.下列说法正确的是( )
A.离子键就是阴阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系能量降低
D.离子化合物CaCl2中,两个氯离子间也存在离子键
C
3.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.溶于水 B.熔点较高
C.水溶液能导电 D.熔融状态能导电
2.下列不是离子化合物的是( )
A.H2O B.Na2S
C.KOH D.NH4NO3
A
D
4.下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A.10与19 B.6与16
C.11与17 D.14与8
5.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.Na2O的电 子式:
B.质量数为37的氯原子:
C.Br-的电子式:
D.Ar的结构示意图:
C
C
