第三章 晶体结构与性质 检测题 (含答案) 2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章 晶体结构与性质 检测题 (含答案) 2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 10:41:42 | ||
图片预览


文档简介
第三章《晶体结构与性质》检测题
一、单选题
1.磷化硼(BP)有良好的透光性,用于光学吸收的研究及用作超硬的无机材料等。其晶胞结构如下图所示,下列有关说法正确的是
A.磷化硼晶体的熔点高、硬度大
B.B配位数是4,P的配位数是2
C.BP属于离子晶体
D.B的杂化方式为sp2,P的杂化方式为sp3
2.下列说法不正确的是( )
A.NH5的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既具有离子键又具有共价键的离子化合物
B.Na2O是离子晶体,溶于水生成NaOH的过程中既有离子键的断裂又有共价键的形成
C.某物质固态时不导电但溶于水能导电,则该物质中一定含有离子键
D.石英是由硅原子和氧原子构成的原子晶体,每个原子的最外层都具有8电子稳定结构
3.下列排序正确的是
A.熔点:碳化硅>硅>锗
B.分解温度:
C.酸性:
D.键角:
4.碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构如图所示。下列说法正确的是
A.碳铂中所有碳原子可能在同一平面上
B.碳铂的化学式为[]
C.碳铂分子中杂化的碳原子与杂化的碳原子数目之比为2∶1
D.碳铂含有σ键的数目为
5.下列关于晶体的说法正确的是
A.组成金属的粒子是原子
B.晶体中分子间作用力越大,分子越稳定
C.离子晶体中一定有离子键,分子晶体中肯定没有离子键
D.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
6.下列有关微粒性质的排列顺序,正确的是
A.键角: B.热稳定性:HBr>HCI>HF
C.第一电离能:C<N<O D.熔点:单晶硅>碳化硅>金刚石
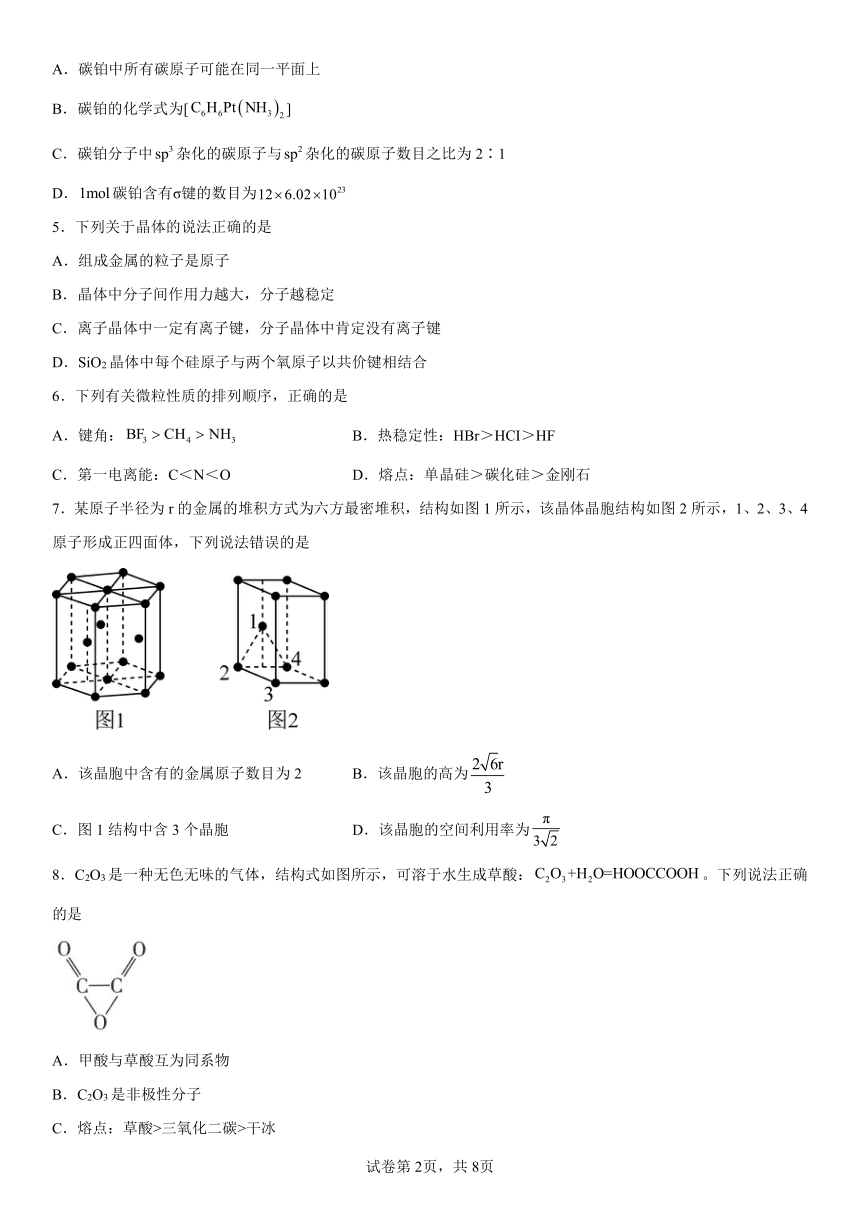
7.某原子半径为r的金属的堆积方式为六方最密堆积,结构如图1所示,该晶体晶胞结构如图2所示,1、2、3、4原子形成正四面体,下列说法错误的是
A.该晶胞中含有的金属原子数目为2 B.该晶胞的高为
C.图1结构中含3个晶胞 D.该晶胞的空间利用率为
8.C2O3是一种无色无味的气体,结构式如图所示,可溶于水生成草酸:。下列说法正确的是
A.甲酸与草酸互为同系物
B.C2O3是非极性分子
C.熔点:草酸>三氧化二碳>干冰
D.CO2、C2O3和分子中碳原子的杂化方式均相同
9.下列说法正确的是
A.2p和3p轨道形状均为哑铃形,能量也相等
B.金属离子的电荷越多、半径越小,金属晶体的熔点越低
C.石墨转化为金刚石既有共价键的断裂和生成,没有破坏分子间作用力
D.DNA分子两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以精准复制
10.下列有关晶体及配合物结构和性质的判断错误的是
选项 结构和性质 相应判断
A 贵金属磷化物Rh2P可用作电解水的高效催化剂,其立方晶胞如图所示 该晶体中磷原子的配位数为8
B 配离子[Co(NO2)6]3-可用于检验K+的存在 该离子的配体是NO2
C GaN、GaP、GaAs都是良好的半导体材料,晶体类型与碳化硅晶体类似 GaN、GaP、GaAs的熔点依次降低
D 氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一 分子中存在配位键,提供空轨道的原子是硼原子
A.A B.B C.C D.D
11.下列有关晶体的说法中一定正确的是( )
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于原子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤分子晶体的堆积均为分子密堆积
⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键
⑦金属晶体和离子晶体都能导电
⑧依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
A.①③⑦ B.只有⑥ C.②④⑤⑦ D.⑤⑥⑧
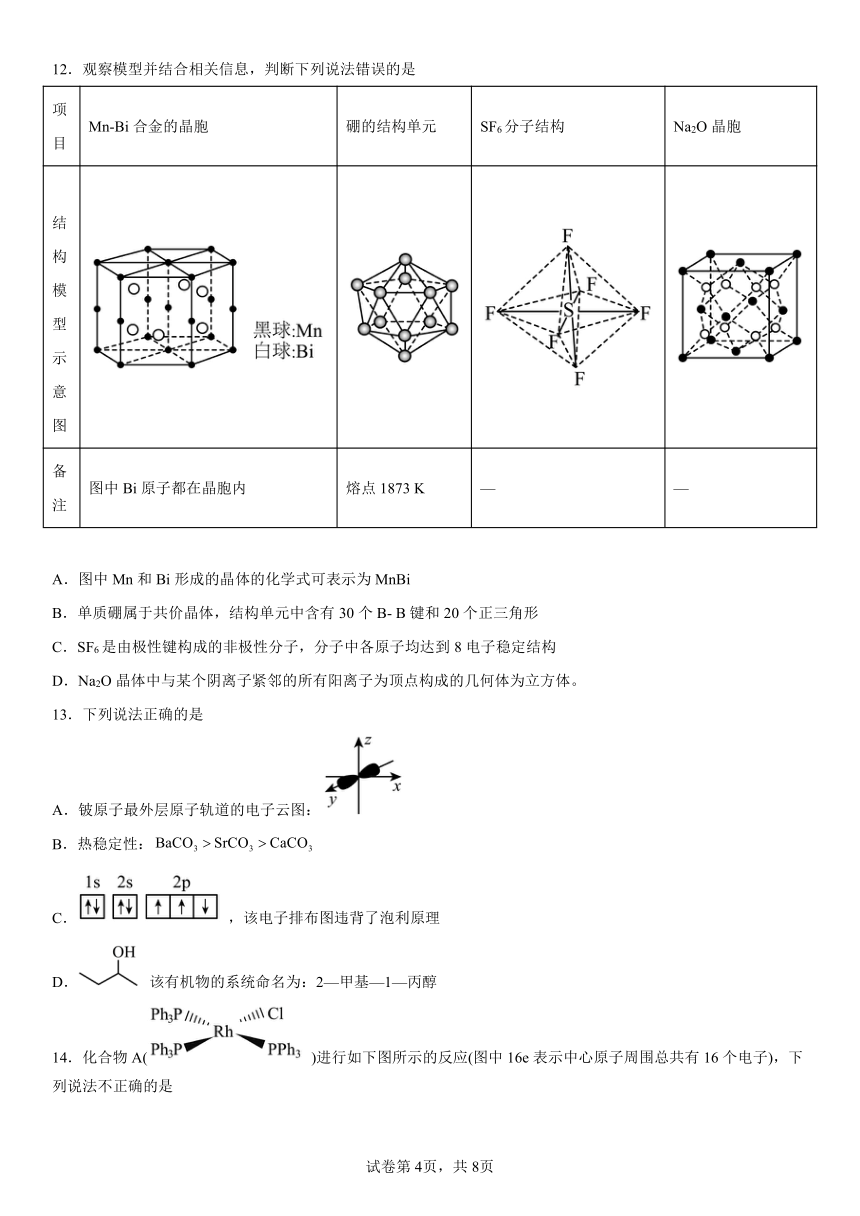
12.观察模型并结合相关信息,判断下列说法错误的是
项目 Mn-Bi合金的晶胞 硼的结构单元 SF6分子结构 Na2O晶胞
结构模型示意图
备注 图中Bi原子都在晶胞内 熔点1873 K — —
A.图中Mn和Bi形成的晶体的化学式可表示为MnBi
B.单质硼属于共价晶体,结构单元中含有30个B- B键和20个正三角形
C.SF6是由极性键构成的非极性分子,分子中各原子均达到8电子稳定结构
D.Na2O晶体中与某个阴离子紧邻的所有阳离子为顶点构成的几何体为立方体。
13.下列说法正确的是
A.铍原子最外层原子轨道的电子云图:
B.热稳定性:
C. ,该电子排布图违背了泡利原理
D. 该有机物的系统命名为:2—甲基—1—丙醇
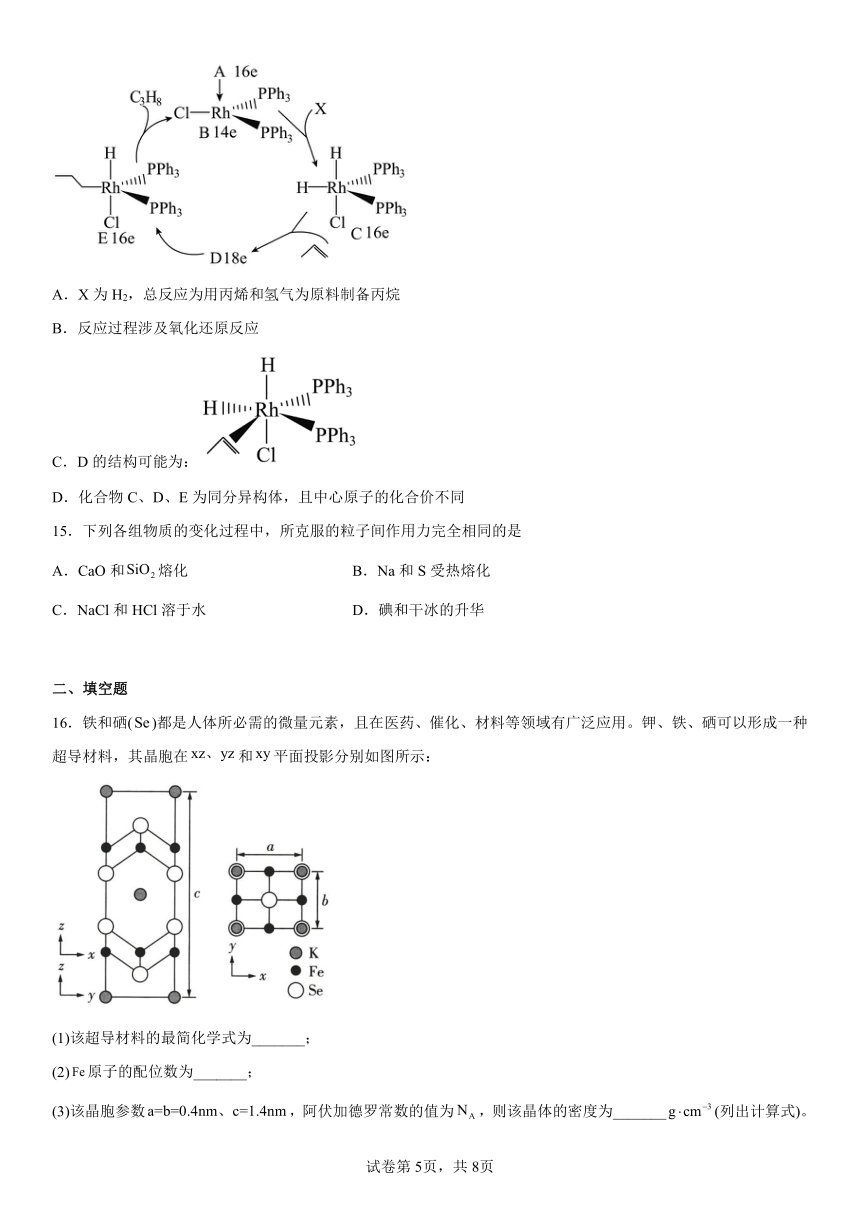
14.化合物A( )进行如下图所示的反应(图中16e表示中心原子周围总共有16个电子),下列说法不正确的是
A.X为H2,总反应为用丙烯和氢气为原料制备丙烷
B.反应过程涉及氧化还原反应
C.D的结构可能为:
D.化合物C、D、E为同分异构体,且中心原子的化合价不同
15.下列各组物质的变化过程中,所克服的粒子间作用力完全相同的是
A.CaO和熔化 B.Na和S受热熔化
C.NaCl和HCl溶于水 D.碘和干冰的升华
二、填空题
16.铁和硒()都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。钾、铁、硒可以形成一种超导材料,其晶胞在和平面投影分别如图所示:
(1)该超导材料的最简化学式为_______;
(2)原子的配位数为_______;
(3)该晶胞参数,阿伏加德罗常数的值为,则该晶体的密度为_______(列出计算式)。
17.2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。反型钙钛矿电池无需使用具有光催化活性的(通过氮掺杂生成,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
则晶体中_______。已知原子1、2的分数坐标分别为(0,0,)和(1,0,0),则原子3的分数坐标为_______,设阿伏加德罗常数的值为,则的密度为_______(列出含、m、n的计算式即可)。
18.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
19.一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH,其晶胞如图(b)所示。其中Pb2+与图(a)中_______的空间位置相同;若晶胞参数为a nm,则晶体密度为_______ g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
20.氮及其化合物与人类生产、生活息息相关,其中尿素()是人类最早合成的有机物。
(1)尿素分子中,C、N、O的第一电离能由大到小的顺序是_______(用元素符号表示),基态N原子的核外电子的空间运动状态有_______种。
(2)三氟化氨、四氟化碳是常见的芯片蚀刻剂。分子的空间构型为_______。
(3)的沸点由高到低的顺序为_______,键角由大到小的顺序为_______。
(4)叠氨化钠可以用于汽车安全气囊。与相比,的熔点_______的熔点(填“大于”或“小于”)。
21.我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
A. B.
C. D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有_______种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为_______,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为_______(填“发射”或“吸收”)光谱。
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥模型解释NH3的键角比PH3的键角大的原因:_______。
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供_______,在BH3·NH3中B原子的杂化方式为_______。
22.一种立方钙钛矿结构的金属卤化物光电材料的组成为、和有机碱离子,其晶胞如图(b)所示。其中与图(a)中_______的空间位置相同,有机碱中,N原子的杂化轨道类型是_______;若晶胞参数为anm,则晶体密度为_______(列出计算式,设为阿伏加德罗常数的值)。
23.Sn为ⅣA族元素,单质Sn与干燥反应生成。常温常压下为无色液体,其固体的晶体类型为_______。
24.乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是___________、___________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___________,其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“Mg2+”或“Cu2+”)。
25.Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 ﹣24.12 38.3 155
试卷第1页,共3页
试卷第1页,共3页
(北京)股份有限公司
(北京)股份有限公司
参考答案:
1.A
【解析】A.磷化硼晶体是由原子通过共价键形成立体网状结构,属于共价晶体。由于共价键是一种强烈的相互作用,断裂消耗很高能量,因此该物质的熔点高、硬度大,A正确;
B.根据晶体结构可知:B原子配位数是4,P原子配位数也是4个,B错误;
C.磷化硼晶体是由B、P原子通过共价键形成立体网状结构,属于共价晶体,而不是原子晶体,C错误;
D.在BP晶体中,每个原子都是形成4个共价键,因此B、P原子的杂化类型都是sp3杂化,D错误;
故合理选项是A。
2.C
【解析】A.NH5为离子化合物,分子中存在NH4+和H-,所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,含有离子键,N-H键属于共价键,选项A正确;
B.Na2O是离子晶体,溶于水生成NaOH的过程中,Na2O中离子键断裂,生成NaOH时有共价键的形成,选项B正确;
C.某物质固态时不导电但溶于水能导电,则该物质中不一定含有离子键,如氯化铝为共价化合物不含离子键,选项C不正确;
D.石英是由硅原子和氧原子构成的原子晶体,每个硅原子形成4个共价键,每个氧原子形成两个共价键,每个原子的最外层都具有8电子稳定结构,选项D正确;
答案选C。
3.A
【解析】A.因为原子半径C硅>锗,A正确;
B.碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解,热分解温度: MgCO3C.Cl元素的化合价越高,对应的氧化物的水化物的酸性越强,故酸性,C错误;
D.为直线形结构,键角为1800,水为V型分子,键角为1050,氨气为三角锥型,键角为1070,所以键角大小,D错误;
故选A。
4.C
【解析】A.碳铂中有一个碳原子同时连有4个碳原子,属于四面体结构,所以碳铂中不可能所有碳原子共面,A错误;
B.碳铂的化学式为[],B错误;
C.碳铂分子中有4个C原子为碳碳单键,为杂化;有2个,为杂化,所以碳铂分子中杂化的碳原子与杂化的碳原子数目之比为2∶1,C正确;
D.以及配位键均为σ键,中含有1个σ键,则可得1mol此有机化合物含有σ键的数目26,D错误;
答案选C。
5.C
【解析】A.组成金属的粒子是金属阳离子和自由电子,A错误;
B.分子间作用力与分子稳定性无关,B错误;
C.离子晶体由离子构成,因此一定含离子键,分子晶体由分子构成,一定不含离子键,C正确;
D.SiO2晶体中每个硅原子与4个氧原子以共价键相结合,D错误;
选C。
6.A
【解析】A.BF3为平面三角形,键角为120°, 无孤电子对,CH4为正四面体结构,键角为109°28′,NH3中由于分子中N原子含有1对孤电子对,并且孤电子对—成键电子对间的斥力>成键电子对—成键电子对间的斥力,使NH3分子中的键角减小,即小于109°28′,所以键角:BF3 >CH4>NH3,故A正确;
B.同主族元素从上到下非金属性减弱,则非金属性F>Cl>Br,对应氢化物的稳定性为HBr<HCl<HF,故B错误;
C.同周期随原子序数增大第一电离能呈增大趋势,但ⅤA族具有半充满稳定结构,第一电离能大于同周期相邻元素,故第一电离能C<O<N,故C错误;
D.单晶硅、碳化硅、金刚石形成的晶体都是共价晶体,由于键长C-C<C-Si<Si-Si,则熔点为金刚石>碳化硅>晶体硅,故D错误;
故选A。
7.B
【解析】A.根据均摊原则,该晶胞中含有的金属原子数目为,故A正确;
B.原子半径为r,则底面边长为2r,则1、2、3、4原子形成正四面体的高为 ,晶胞的高为正四面体的高的2倍,则晶胞的高为,故B错误;
C.图1结构可分割为3个图2所示的3个晶胞,故C正确;
D.该晶胞中含有2个原子,2个原子的体积为,晶胞的体积为,空间利用率为=,故D正确;
选B。
8.C
【解析】A.结构相似、分子组成上相差1个或若干个原子团的化合物互为同系物,甲酸()与草酸()不符合要求,不互为同系物,A错误;
B.由题图可知正电中心和负电中心不重合,是极性分子,B错误;
C.草酸分子间能形成氢键,而不能,故草酸熔点比高,相对分子质量比小,因此熔点低于,熔点:草酸>三氧化二碳>干冰,C正确;
D.中碳原子的杂化方式为,中碳原子的杂化方式为,分子中碳原子的杂化方式为,杂化方式不完全相同,D错误。
故选C。
9.D
【解析】A.2p和3p轨道形状均为哑铃形,但二者位于不同的能层,3p轨道的能量高于2p,A错误;
B.金属离子的电荷越多、半径越小,金属键越强,熔点越高,B错误;
C.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,C错误;
D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,DNA复制时,在有关酶的作用下,两条链的配对碱基之间的氢键断裂,碱基暴露出来,形成了两条模板链,以半保留的方式进行复制,使遗传信息得以精准复制,D正确;
综上所述答案为D。
10.B
【解析】A.根据晶胞结构可知,以顶面面心P原子为例,该晶胞中有4个Rh原子距离其最近,该晶胞上方晶胞中还有4个,所以晶体中与P距离最近的Rh的数目为8,则该晶体中磷原子的配位数为8,故A正确;
B.配离子[Co(NO2)6]3-的配体为,故B错误;
C.GaN、GaP、GaAs都是良好的半导体材料,晶体类型与碳化硅晶体类似,属于共价晶体,N、P、As原子半径依次增大,因此GaN、GaP、GaAs的键长依次增大,键能依次减小,熔沸点依次降低,故C正确;
D.氨硼烷(NH3BH3)分子中,B原子有空轨道,NH3中N原子有1对孤电子对,N原子提供孤电子对与B原子形成配位键,因此提供空轨道的原子是硼原子,故D正确;
答案选B。
11.B
【解析】①原子晶体是原子之间通过共价键形成的晶体,同种元素原子之间形成非极性键,不同原子之间形成极性键,如二氧化硅是原子晶体,晶体中Si-O键是极性键,故错误;
②稀有气体是单原子分子,分子之间通过分子间作用力形成分子晶体,故错误;
③干冰晶体属于分子晶体,分子之间通过分子间作用力形成晶体,升华时分子间距增大,属于物理变化,破坏分子间作用力,没有破坏化学键,故错误;
④金属元素和非金属元素形成的化合物可能是共价化合物,如氯化铝,故错误;
⑤分子晶体的堆积不一定是分子密堆积,如冰晶体中存在氢键,不是分子密堆积,故错误;
⑥离子晶体由阴、阳离子通过离子键形成,金属晶体是金属离子与自由电子通过金属键形成,不存在离子键,故正确;
⑦金属晶体中由自由电子,可以导电,离子晶体中阴、阳离子不能自由移动不能导电,熔融的离子晶体可以导电,故错误;
⑧依据构成微粒与微粒间的作用可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体,故错误;
答案选B。
12.C
【解析】A.Mn=,Bi=6,Mn和Bi形成的晶体的化学式可表示为MnBi,A正确;
B.由图可知,硼的熔点较高,单质硼属于共价晶体,结构单元中含有12个碳原子,30个B- B键和20个正三角形,B正确;
C.SF6是由极性键构成的非极性分子,分子中S原子不是8电子稳定结构,C错误;
D.由晶胞可知黑球为O,白球为Na,Na2O晶体中与某个阴离子紧邻的所有阳离子为顶点构成的几何体为立方体,D正确;
答案选C。
13.B
【解析】A.铍原子最外层为2s能级,s能级的电子云图为球形为 ,故A错误;
B.三种物质的阴离子是相同的,均为碳酸根,Ca2+、Sr2+、Ba2+为同主族元素的金属阳离子,从上到下,离子半径逐渐增大,阳离子的半径越大,结合碳酸根中的氧离子越容易,分解温度越高,则热稳定性为,故B正确;
C.由洪特规则可知,在2p轨道上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则电子排布图违背了洪特规则,故C错误;
D.属于饱和一元醇,名称为2—丁醇,故D错误;
故选B。
14.D
【解析】A.由反应循环图可以看出B和X生成了C,根据原子守恒可知X为H2,故A正确;
B.从A生成B有电子得失,H2参与生成化合物,都涉及氧化还原,故B正确;
C.C与丙烯生成D,根据C和E的结构简式可知丙烯与中心原子配位,故D的结构简式为 ,故C正确;
D.根据、 、,根据CDE的结构简式可知三者分子式不同,不是同分异构,故D错误;
故答案为D
15.D
【解析】A.氧化钙是离子晶体,熔化时所克服的粒子间作用力为离子键,二氧化硅是原子晶体,熔化时所克服的粒子间作用力为共价键,两者所克服的粒子间作用力不同,故A错误;
B.钠是金属晶体,受热熔化时所克服的粒子间作用力为金属键,硫是分子晶体,受热熔化时所克服的粒子间作用力为分子间作用力,两者所克服的粒子间作用力不同,故B错误;
C.氯化钠是离子晶体,溶于水时所克服的粒子间作用力为离子键,氯化氢是分子晶体,溶于水时所克服的粒子间作用力为共价键,两者所克服的粒子间作用力不同,故C错误;
D.碘和干冰都是分子晶体,升华时所克服的粒子间作用力都为分子间作用力,两者所克服的粒子间作用力完全相同,故D正确;
故选D。
16.(1)
(2)4
(3)
【解析】(1)由平面投影图推知晶胞的立体结构如图所示,,则晶胞中K原子位于顶点和体心,个数为;每个竖直棱上有2个原子,体内有2个原子,原子的个数为;每个竖直面上2个原子,原子的个数为,则该超导材料的最简化学为。
(2)由晶胞的平面投影图可知,位于面上的原子与原子距离最近,则与原子距离最近且相等的原子有4个(棱上2个,晶胞体内2个),故的配位数为4。
(3)设晶体的密度为由晶胞的质量公式可得,解得。
17. (1,1,)
【解析】由的晶胞结构可知,氨掺杂反应后,有3个氧空穴,O原子有6个在棱上、6个在面上、1个在体内,则O原子个数为,N原子有1个在面上、1个在棱上,则N原子个数为,原子有8个在顶,点4个在面上、1个在体肉,则原子个数为,所以晶胞中的数目之比为,该物质的化学式为,则。由的晶胞结构可知,若原子1、2的分数坐标分别为,则原子3的分数坐标为。由的晶胞结构可知,原子有8个在顶点、4个在面上、1个在)原子的个数为,O原子有8个在棱上、8个在面在体内,则O原子个数为,故1个晶胞中有4个,1个晶胞的质量为,体积为,则的密度为。
18. 分子晶体 苯胺分子之间存在氢键
【解析】苯胺中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
19. Ti4+
【解析】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;
根据均摊法,1个晶胞中含有的个数为,;的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
20.(1) N>O>C 7
(2)正四面体形
(3) NH3>AsH3>PH3 NH3>PH3>AsH3
(4)大于
【解析】(1)
C、N、O元素处于第二周期,同周期主族元素从左到右第一电离能呈增大趋势,但N原子2p轨道处于半充满稳定状态,不易失去电子,其第一电离能大于同周期相邻主族元素,故第一电离能:N>O>C,基态N原子核外有7个电子,原子核外电子的运动状态各不相同,故基态N原子核外电子的运动状态有7种;
(2)
分子的中心原子的价电子对数为,不含有孤对电子,因此分子的空间构型为正四面体形;
(3)
NH3、PH3、AsH3的结构相似,结构相似的物质,相对分子质量越大,范德华力越强,物质的沸点越高,相对分子质量大小比较:AsH3>PH3>NH3,但是NH3分子间能形成氢键,所以沸点比AsH3更高,故这三种物质的沸点由高到低的顺序为:NH3>AsH3>PH3;
NH3、PH3、AsH3的中心原子都是sp3杂化,均形成3对共用电子对和一对孤电子对,中心原子的电负性越小,成键电子对之间的斥力越小,键角越小,电负性大小比较:N>As>P,且原子半径:As>P>N,键长:As-H>P-H>N-H,因此σ键电子对之间的排斥力由强到弱的顺序为N>P>As,所以这三种物质的键角由大到小的顺序为NH3>PH3>AsH3;
(4)
NaN3与KN3结构相似,均为离子晶体,Na+比K+半径小,相同电荷时,离子半径越小,晶格能越大,离子半径:Na+<K+,故NaN3晶格能大,熔点更高。
21.(1)D
(2)3
(3) 直线形 发射
(4)N的原子半径比P小、电负性比P大,使得NH3分子中共用电子对之间的距离比PH3分子中近、斥力大
(5) 孤电子对 sp3
【解析】(1)基态氮原子的能量最低,能量越高的轨道中电子个数越多,原子能量越高,依据图示可知,A为基态原子,能量最低,B、C、D为激发态原子,而D中能量较高的轨道中电子数最多,所以能量最高。
(2)同一周期主族元素从左向右第一电离能呈增大趋势,第IIA、VA族元素为全充满或半充满的稳定状态,第一电离能比同周期相邻元素第一电离能大,因此第二周期主族元素中,第一电离能在B和N之间的元素有Be、C、O三种元素。
(3)NaN3的阴离子为,其中心原子价层电子对数为2+=2,无孤对电子,采取sp杂化,空间构型为直线形;电子从激发态跃迁到低能级,以光的形式释放能量,Na在空气中燃烧发出黄色火焰用光谱仪摄取的光谱为发射光谱。
(4)NH3、PH3的中心原子均采取sp3杂化,N的电负性比P大、原子半径比P小,N原子对键合电子的吸引能力更强,因而NH3分子中成键电子对间的距离较近、斥力较大,NH3的键角比PH3的键角大。
(5)B原子形成3个B-H键,B原子有空轨道,氨分子中N原子有1个孤电子对,B与N之间形成配位键,氮原子提供孤电子对,硼原子提供空轨道;在BH3·NH3中B原子形成3个B-H键,还形成1个配位键,杂化轨道数目为4,采取sp3杂化。
22. Ti4+ sp3
【解析】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;中,氮原子形成4个单键,其中有1个是配位键,N原子采取杂化;根据均摊法,1个晶胞中含有的个数为,的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
23.分子晶体
【解析】常温常压下为无色液体,说明其熔点很低,可推知其为分子晶体。
24. sp3 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+
【解析】乙二胺(H2NCH2CH2NH2)中N的价层电子对数为4,C的价层电子对数为4,分子中氮、碳的杂化类型分别是sp3、sp3;乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是Mg2+、Cu2+有空轨道,乙二胺的两个N提供孤对电子给金属离子形成配位键;配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定,因此与乙二胺形成的化合物稳定性相对较高的是Cu2+。
25.TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
【解析】F的电负性强,故TiF4属于离子化合物,形成离子晶体,熔点较高,而自TiCl4至TiI4均为共价化合物,形成分子晶体,熔沸点很低,且随相对分子质量的增大分子间作用力增大,熔点逐渐升高
(北京)股份有限公司
(北京)股份有限公司
一、单选题
1.磷化硼(BP)有良好的透光性,用于光学吸收的研究及用作超硬的无机材料等。其晶胞结构如下图所示,下列有关说法正确的是
A.磷化硼晶体的熔点高、硬度大
B.B配位数是4,P的配位数是2
C.BP属于离子晶体
D.B的杂化方式为sp2,P的杂化方式为sp3
2.下列说法不正确的是( )
A.NH5的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既具有离子键又具有共价键的离子化合物
B.Na2O是离子晶体,溶于水生成NaOH的过程中既有离子键的断裂又有共价键的形成
C.某物质固态时不导电但溶于水能导电,则该物质中一定含有离子键
D.石英是由硅原子和氧原子构成的原子晶体,每个原子的最外层都具有8电子稳定结构
3.下列排序正确的是
A.熔点:碳化硅>硅>锗
B.分解温度:
C.酸性:
D.键角:
4.碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构如图所示。下列说法正确的是
A.碳铂中所有碳原子可能在同一平面上
B.碳铂的化学式为[]
C.碳铂分子中杂化的碳原子与杂化的碳原子数目之比为2∶1
D.碳铂含有σ键的数目为
5.下列关于晶体的说法正确的是
A.组成金属的粒子是原子
B.晶体中分子间作用力越大,分子越稳定
C.离子晶体中一定有离子键,分子晶体中肯定没有离子键
D.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
6.下列有关微粒性质的排列顺序,正确的是
A.键角: B.热稳定性:HBr>HCI>HF
C.第一电离能:C<N<O D.熔点:单晶硅>碳化硅>金刚石
7.某原子半径为r的金属的堆积方式为六方最密堆积,结构如图1所示,该晶体晶胞结构如图2所示,1、2、3、4原子形成正四面体,下列说法错误的是
A.该晶胞中含有的金属原子数目为2 B.该晶胞的高为
C.图1结构中含3个晶胞 D.该晶胞的空间利用率为
8.C2O3是一种无色无味的气体,结构式如图所示,可溶于水生成草酸:。下列说法正确的是
A.甲酸与草酸互为同系物
B.C2O3是非极性分子
C.熔点:草酸>三氧化二碳>干冰
D.CO2、C2O3和分子中碳原子的杂化方式均相同
9.下列说法正确的是
A.2p和3p轨道形状均为哑铃形,能量也相等
B.金属离子的电荷越多、半径越小,金属晶体的熔点越低
C.石墨转化为金刚石既有共价键的断裂和生成,没有破坏分子间作用力
D.DNA分子两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以精准复制
10.下列有关晶体及配合物结构和性质的判断错误的是
选项 结构和性质 相应判断
A 贵金属磷化物Rh2P可用作电解水的高效催化剂,其立方晶胞如图所示 该晶体中磷原子的配位数为8
B 配离子[Co(NO2)6]3-可用于检验K+的存在 该离子的配体是NO2
C GaN、GaP、GaAs都是良好的半导体材料,晶体类型与碳化硅晶体类似 GaN、GaP、GaAs的熔点依次降低
D 氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一 分子中存在配位键,提供空轨道的原子是硼原子
A.A B.B C.C D.D
11.下列有关晶体的说法中一定正确的是( )
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于原子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤分子晶体的堆积均为分子密堆积
⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键
⑦金属晶体和离子晶体都能导电
⑧依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
A.①③⑦ B.只有⑥ C.②④⑤⑦ D.⑤⑥⑧
12.观察模型并结合相关信息,判断下列说法错误的是
项目 Mn-Bi合金的晶胞 硼的结构单元 SF6分子结构 Na2O晶胞
结构模型示意图
备注 图中Bi原子都在晶胞内 熔点1873 K — —
A.图中Mn和Bi形成的晶体的化学式可表示为MnBi
B.单质硼属于共价晶体,结构单元中含有30个B- B键和20个正三角形
C.SF6是由极性键构成的非极性分子,分子中各原子均达到8电子稳定结构
D.Na2O晶体中与某个阴离子紧邻的所有阳离子为顶点构成的几何体为立方体。
13.下列说法正确的是
A.铍原子最外层原子轨道的电子云图:
B.热稳定性:
C. ,该电子排布图违背了泡利原理
D. 该有机物的系统命名为:2—甲基—1—丙醇
14.化合物A( )进行如下图所示的反应(图中16e表示中心原子周围总共有16个电子),下列说法不正确的是
A.X为H2,总反应为用丙烯和氢气为原料制备丙烷
B.反应过程涉及氧化还原反应
C.D的结构可能为:
D.化合物C、D、E为同分异构体,且中心原子的化合价不同
15.下列各组物质的变化过程中,所克服的粒子间作用力完全相同的是
A.CaO和熔化 B.Na和S受热熔化
C.NaCl和HCl溶于水 D.碘和干冰的升华
二、填空题
16.铁和硒()都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。钾、铁、硒可以形成一种超导材料,其晶胞在和平面投影分别如图所示:
(1)该超导材料的最简化学式为_______;
(2)原子的配位数为_______;
(3)该晶胞参数,阿伏加德罗常数的值为,则该晶体的密度为_______(列出计算式)。
17.2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。反型钙钛矿电池无需使用具有光催化活性的(通过氮掺杂生成,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
则晶体中_______。已知原子1、2的分数坐标分别为(0,0,)和(1,0,0),则原子3的分数坐标为_______,设阿伏加德罗常数的值为,则的密度为_______(列出含、m、n的计算式即可)。
18.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
19.一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH,其晶胞如图(b)所示。其中Pb2+与图(a)中_______的空间位置相同;若晶胞参数为a nm,则晶体密度为_______ g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
20.氮及其化合物与人类生产、生活息息相关,其中尿素()是人类最早合成的有机物。
(1)尿素分子中,C、N、O的第一电离能由大到小的顺序是_______(用元素符号表示),基态N原子的核外电子的空间运动状态有_______种。
(2)三氟化氨、四氟化碳是常见的芯片蚀刻剂。分子的空间构型为_______。
(3)的沸点由高到低的顺序为_______,键角由大到小的顺序为_______。
(4)叠氨化钠可以用于汽车安全气囊。与相比,的熔点_______的熔点(填“大于”或“小于”)。
21.我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
A. B.
C. D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有_______种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为_______,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为_______(填“发射”或“吸收”)光谱。
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥模型解释NH3的键角比PH3的键角大的原因:_______。
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供_______,在BH3·NH3中B原子的杂化方式为_______。
22.一种立方钙钛矿结构的金属卤化物光电材料的组成为、和有机碱离子,其晶胞如图(b)所示。其中与图(a)中_______的空间位置相同,有机碱中,N原子的杂化轨道类型是_______;若晶胞参数为anm,则晶体密度为_______(列出计算式,设为阿伏加德罗常数的值)。
23.Sn为ⅣA族元素,单质Sn与干燥反应生成。常温常压下为无色液体,其固体的晶体类型为_______。
24.乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是___________、___________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___________,其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“Mg2+”或“Cu2+”)。
25.Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 ﹣24.12 38.3 155
试卷第1页,共3页
试卷第1页,共3页
(北京)股份有限公司
(北京)股份有限公司
参考答案:
1.A
【解析】A.磷化硼晶体是由原子通过共价键形成立体网状结构,属于共价晶体。由于共价键是一种强烈的相互作用,断裂消耗很高能量,因此该物质的熔点高、硬度大,A正确;
B.根据晶体结构可知:B原子配位数是4,P原子配位数也是4个,B错误;
C.磷化硼晶体是由B、P原子通过共价键形成立体网状结构,属于共价晶体,而不是原子晶体,C错误;
D.在BP晶体中,每个原子都是形成4个共价键,因此B、P原子的杂化类型都是sp3杂化,D错误;
故合理选项是A。
2.C
【解析】A.NH5为离子化合物,分子中存在NH4+和H-,所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,含有离子键,N-H键属于共价键,选项A正确;
B.Na2O是离子晶体,溶于水生成NaOH的过程中,Na2O中离子键断裂,生成NaOH时有共价键的形成,选项B正确;
C.某物质固态时不导电但溶于水能导电,则该物质中不一定含有离子键,如氯化铝为共价化合物不含离子键,选项C不正确;
D.石英是由硅原子和氧原子构成的原子晶体,每个硅原子形成4个共价键,每个氧原子形成两个共价键,每个原子的最外层都具有8电子稳定结构,选项D正确;
答案选C。
3.A
【解析】A.因为原子半径C
B.碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解,热分解温度: MgCO3
D.为直线形结构,键角为1800,水为V型分子,键角为1050,氨气为三角锥型,键角为1070,所以键角大小,D错误;
故选A。
4.C
【解析】A.碳铂中有一个碳原子同时连有4个碳原子,属于四面体结构,所以碳铂中不可能所有碳原子共面,A错误;
B.碳铂的化学式为[],B错误;
C.碳铂分子中有4个C原子为碳碳单键,为杂化;有2个,为杂化,所以碳铂分子中杂化的碳原子与杂化的碳原子数目之比为2∶1,C正确;
D.以及配位键均为σ键,中含有1个σ键,则可得1mol此有机化合物含有σ键的数目26,D错误;
答案选C。
5.C
【解析】A.组成金属的粒子是金属阳离子和自由电子,A错误;
B.分子间作用力与分子稳定性无关,B错误;
C.离子晶体由离子构成,因此一定含离子键,分子晶体由分子构成,一定不含离子键,C正确;
D.SiO2晶体中每个硅原子与4个氧原子以共价键相结合,D错误;
选C。
6.A
【解析】A.BF3为平面三角形,键角为120°, 无孤电子对,CH4为正四面体结构,键角为109°28′,NH3中由于分子中N原子含有1对孤电子对,并且孤电子对—成键电子对间的斥力>成键电子对—成键电子对间的斥力,使NH3分子中的键角减小,即小于109°28′,所以键角:BF3 >CH4>NH3,故A正确;
B.同主族元素从上到下非金属性减弱,则非金属性F>Cl>Br,对应氢化物的稳定性为HBr<HCl<HF,故B错误;
C.同周期随原子序数增大第一电离能呈增大趋势,但ⅤA族具有半充满稳定结构,第一电离能大于同周期相邻元素,故第一电离能C<O<N,故C错误;
D.单晶硅、碳化硅、金刚石形成的晶体都是共价晶体,由于键长C-C<C-Si<Si-Si,则熔点为金刚石>碳化硅>晶体硅,故D错误;
故选A。
7.B
【解析】A.根据均摊原则,该晶胞中含有的金属原子数目为,故A正确;
B.原子半径为r,则底面边长为2r,则1、2、3、4原子形成正四面体的高为 ,晶胞的高为正四面体的高的2倍,则晶胞的高为,故B错误;
C.图1结构可分割为3个图2所示的3个晶胞,故C正确;
D.该晶胞中含有2个原子,2个原子的体积为,晶胞的体积为,空间利用率为=,故D正确;
选B。
8.C
【解析】A.结构相似、分子组成上相差1个或若干个原子团的化合物互为同系物,甲酸()与草酸()不符合要求,不互为同系物,A错误;
B.由题图可知正电中心和负电中心不重合,是极性分子,B错误;
C.草酸分子间能形成氢键,而不能,故草酸熔点比高,相对分子质量比小,因此熔点低于,熔点:草酸>三氧化二碳>干冰,C正确;
D.中碳原子的杂化方式为,中碳原子的杂化方式为,分子中碳原子的杂化方式为,杂化方式不完全相同,D错误。
故选C。
9.D
【解析】A.2p和3p轨道形状均为哑铃形,但二者位于不同的能层,3p轨道的能量高于2p,A错误;
B.金属离子的电荷越多、半径越小,金属键越强,熔点越高,B错误;
C.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,C错误;
D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,DNA复制时,在有关酶的作用下,两条链的配对碱基之间的氢键断裂,碱基暴露出来,形成了两条模板链,以半保留的方式进行复制,使遗传信息得以精准复制,D正确;
综上所述答案为D。
10.B
【解析】A.根据晶胞结构可知,以顶面面心P原子为例,该晶胞中有4个Rh原子距离其最近,该晶胞上方晶胞中还有4个,所以晶体中与P距离最近的Rh的数目为8,则该晶体中磷原子的配位数为8,故A正确;
B.配离子[Co(NO2)6]3-的配体为,故B错误;
C.GaN、GaP、GaAs都是良好的半导体材料,晶体类型与碳化硅晶体类似,属于共价晶体,N、P、As原子半径依次增大,因此GaN、GaP、GaAs的键长依次增大,键能依次减小,熔沸点依次降低,故C正确;
D.氨硼烷(NH3BH3)分子中,B原子有空轨道,NH3中N原子有1对孤电子对,N原子提供孤电子对与B原子形成配位键,因此提供空轨道的原子是硼原子,故D正确;
答案选B。
11.B
【解析】①原子晶体是原子之间通过共价键形成的晶体,同种元素原子之间形成非极性键,不同原子之间形成极性键,如二氧化硅是原子晶体,晶体中Si-O键是极性键,故错误;
②稀有气体是单原子分子,分子之间通过分子间作用力形成分子晶体,故错误;
③干冰晶体属于分子晶体,分子之间通过分子间作用力形成晶体,升华时分子间距增大,属于物理变化,破坏分子间作用力,没有破坏化学键,故错误;
④金属元素和非金属元素形成的化合物可能是共价化合物,如氯化铝,故错误;
⑤分子晶体的堆积不一定是分子密堆积,如冰晶体中存在氢键,不是分子密堆积,故错误;
⑥离子晶体由阴、阳离子通过离子键形成,金属晶体是金属离子与自由电子通过金属键形成,不存在离子键,故正确;
⑦金属晶体中由自由电子,可以导电,离子晶体中阴、阳离子不能自由移动不能导电,熔融的离子晶体可以导电,故错误;
⑧依据构成微粒与微粒间的作用可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体,故错误;
答案选B。
12.C
【解析】A.Mn=,Bi=6,Mn和Bi形成的晶体的化学式可表示为MnBi,A正确;
B.由图可知,硼的熔点较高,单质硼属于共价晶体,结构单元中含有12个碳原子,30个B- B键和20个正三角形,B正确;
C.SF6是由极性键构成的非极性分子,分子中S原子不是8电子稳定结构,C错误;
D.由晶胞可知黑球为O,白球为Na,Na2O晶体中与某个阴离子紧邻的所有阳离子为顶点构成的几何体为立方体,D正确;
答案选C。
13.B
【解析】A.铍原子最外层为2s能级,s能级的电子云图为球形为 ,故A错误;
B.三种物质的阴离子是相同的,均为碳酸根,Ca2+、Sr2+、Ba2+为同主族元素的金属阳离子,从上到下,离子半径逐渐增大,阳离子的半径越大,结合碳酸根中的氧离子越容易,分解温度越高,则热稳定性为,故B正确;
C.由洪特规则可知,在2p轨道上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则电子排布图违背了洪特规则,故C错误;
D.属于饱和一元醇,名称为2—丁醇,故D错误;
故选B。
14.D
【解析】A.由反应循环图可以看出B和X生成了C,根据原子守恒可知X为H2,故A正确;
B.从A生成B有电子得失,H2参与生成化合物,都涉及氧化还原,故B正确;
C.C与丙烯生成D,根据C和E的结构简式可知丙烯与中心原子配位,故D的结构简式为 ,故C正确;
D.根据、 、,根据CDE的结构简式可知三者分子式不同,不是同分异构,故D错误;
故答案为D
15.D
【解析】A.氧化钙是离子晶体,熔化时所克服的粒子间作用力为离子键,二氧化硅是原子晶体,熔化时所克服的粒子间作用力为共价键,两者所克服的粒子间作用力不同,故A错误;
B.钠是金属晶体,受热熔化时所克服的粒子间作用力为金属键,硫是分子晶体,受热熔化时所克服的粒子间作用力为分子间作用力,两者所克服的粒子间作用力不同,故B错误;
C.氯化钠是离子晶体,溶于水时所克服的粒子间作用力为离子键,氯化氢是分子晶体,溶于水时所克服的粒子间作用力为共价键,两者所克服的粒子间作用力不同,故C错误;
D.碘和干冰都是分子晶体,升华时所克服的粒子间作用力都为分子间作用力,两者所克服的粒子间作用力完全相同,故D正确;
故选D。
16.(1)
(2)4
(3)
【解析】(1)由平面投影图推知晶胞的立体结构如图所示,,则晶胞中K原子位于顶点和体心,个数为;每个竖直棱上有2个原子,体内有2个原子,原子的个数为;每个竖直面上2个原子,原子的个数为,则该超导材料的最简化学为。
(2)由晶胞的平面投影图可知,位于面上的原子与原子距离最近,则与原子距离最近且相等的原子有4个(棱上2个,晶胞体内2个),故的配位数为4。
(3)设晶体的密度为由晶胞的质量公式可得,解得。
17. (1,1,)
【解析】由的晶胞结构可知,氨掺杂反应后,有3个氧空穴,O原子有6个在棱上、6个在面上、1个在体内,则O原子个数为,N原子有1个在面上、1个在棱上,则N原子个数为,原子有8个在顶,点4个在面上、1个在体肉,则原子个数为,所以晶胞中的数目之比为,该物质的化学式为,则。由的晶胞结构可知,若原子1、2的分数坐标分别为,则原子3的分数坐标为。由的晶胞结构可知,原子有8个在顶点、4个在面上、1个在)原子的个数为,O原子有8个在棱上、8个在面在体内,则O原子个数为,故1个晶胞中有4个,1个晶胞的质量为,体积为,则的密度为。
18. 分子晶体 苯胺分子之间存在氢键
【解析】苯胺中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
19. Ti4+
【解析】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;
根据均摊法,1个晶胞中含有的个数为,;的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
20.(1) N>O>C 7
(2)正四面体形
(3) NH3>AsH3>PH3 NH3>PH3>AsH3
(4)大于
【解析】(1)
C、N、O元素处于第二周期,同周期主族元素从左到右第一电离能呈增大趋势,但N原子2p轨道处于半充满稳定状态,不易失去电子,其第一电离能大于同周期相邻主族元素,故第一电离能:N>O>C,基态N原子核外有7个电子,原子核外电子的运动状态各不相同,故基态N原子核外电子的运动状态有7种;
(2)
分子的中心原子的价电子对数为,不含有孤对电子,因此分子的空间构型为正四面体形;
(3)
NH3、PH3、AsH3的结构相似,结构相似的物质,相对分子质量越大,范德华力越强,物质的沸点越高,相对分子质量大小比较:AsH3>PH3>NH3,但是NH3分子间能形成氢键,所以沸点比AsH3更高,故这三种物质的沸点由高到低的顺序为:NH3>AsH3>PH3;
NH3、PH3、AsH3的中心原子都是sp3杂化,均形成3对共用电子对和一对孤电子对,中心原子的电负性越小,成键电子对之间的斥力越小,键角越小,电负性大小比较:N>As>P,且原子半径:As>P>N,键长:As-H>P-H>N-H,因此σ键电子对之间的排斥力由强到弱的顺序为N>P>As,所以这三种物质的键角由大到小的顺序为NH3>PH3>AsH3;
(4)
NaN3与KN3结构相似,均为离子晶体,Na+比K+半径小,相同电荷时,离子半径越小,晶格能越大,离子半径:Na+<K+,故NaN3晶格能大,熔点更高。
21.(1)D
(2)3
(3) 直线形 发射
(4)N的原子半径比P小、电负性比P大,使得NH3分子中共用电子对之间的距离比PH3分子中近、斥力大
(5) 孤电子对 sp3
【解析】(1)基态氮原子的能量最低,能量越高的轨道中电子个数越多,原子能量越高,依据图示可知,A为基态原子,能量最低,B、C、D为激发态原子,而D中能量较高的轨道中电子数最多,所以能量最高。
(2)同一周期主族元素从左向右第一电离能呈增大趋势,第IIA、VA族元素为全充满或半充满的稳定状态,第一电离能比同周期相邻元素第一电离能大,因此第二周期主族元素中,第一电离能在B和N之间的元素有Be、C、O三种元素。
(3)NaN3的阴离子为,其中心原子价层电子对数为2+=2,无孤对电子,采取sp杂化,空间构型为直线形;电子从激发态跃迁到低能级,以光的形式释放能量,Na在空气中燃烧发出黄色火焰用光谱仪摄取的光谱为发射光谱。
(4)NH3、PH3的中心原子均采取sp3杂化,N的电负性比P大、原子半径比P小,N原子对键合电子的吸引能力更强,因而NH3分子中成键电子对间的距离较近、斥力较大,NH3的键角比PH3的键角大。
(5)B原子形成3个B-H键,B原子有空轨道,氨分子中N原子有1个孤电子对,B与N之间形成配位键,氮原子提供孤电子对,硼原子提供空轨道;在BH3·NH3中B原子形成3个B-H键,还形成1个配位键,杂化轨道数目为4,采取sp3杂化。
22. Ti4+ sp3
【解析】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;中,氮原子形成4个单键,其中有1个是配位键,N原子采取杂化;根据均摊法,1个晶胞中含有的个数为,的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
23.分子晶体
【解析】常温常压下为无色液体,说明其熔点很低,可推知其为分子晶体。
24. sp3 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+
【解析】乙二胺(H2NCH2CH2NH2)中N的价层电子对数为4,C的价层电子对数为4,分子中氮、碳的杂化类型分别是sp3、sp3;乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是Mg2+、Cu2+有空轨道,乙二胺的两个N提供孤对电子给金属离子形成配位键;配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定,因此与乙二胺形成的化合物稳定性相对较高的是Cu2+。
25.TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
【解析】F的电负性强,故TiF4属于离子化合物,形成离子晶体,熔点较高,而自TiCl4至TiI4均为共价化合物,形成分子晶体,熔沸点很低,且随相对分子质量的增大分子间作用力增大,熔点逐渐升高
(北京)股份有限公司
(北京)股份有限公司
