广东省广州市番禺区2022-2023学年高一下学期开学统考综合练习化学试题(含答案)
文档属性
| 名称 | 广东省广州市番禺区2022-2023学年高一下学期开学统考综合练习化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 692.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 11:21:07 | ||
图片预览



文档简介
广州市番禺区2022-2023学年高一下学期开学统考综合练习
化学
班别:______ 姓名:______ 学号:______ 成绩:______
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mn 55 Fe 56
第一部分 选择题
一、选择题(本题包括16小题,1-10题每小题2分,11-16题每小题4分,共44分)
注意:每道选择题有四个选项,其中只有一个选项符合题意。请用铅笔在答题卡上作答。错选、不选、多选或涂改不清的,均不给分。
1.近年我国科技成果显著,下列说法不正确的是( )
A.三星堆遗址出土的黄金面具最薄处仅为0.2毫米,体现了金具有良好的延展性
B.蛟龙号载人潜水器外壳用特殊的钛合金材料制成,钛合合的熔点低于单质钛
C.中国天眼FAST用到的碳化硅(SiC)是一种新型的金属材料
D.Ti-Fe是新型储氢合金材料,为氢气作为能源的实际应用起到重要的推动作用。
2.中国科学技术大学的钱逸泰教授等以和金属钠为原料,在700℃时反应制得纳米级金刚石粉末和另一种化合物,该成果发表在世界权威的《科学》杂志上,以下说法不正确的是( )
A.反应过程中被还原 B.该反应不能在空气中进行
C.金刚石和石墨互为同素异形体 D.纳米级金刚石粉末为胶体
3.“奥利奥,黑白配”讲的是金属镁与二氧化碳燃烧的产物氧化镁和碳单质的颜色,其中下列化学用语不正确的是( )
A.的结构示意图: B. 的电子式:
C.C、H元素所形成的的结构式: D.中子数为8的碳原子:
4.吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手",服用含
硒元素(Se)的化合物亚硒酸钠(),能消除人体内的活性氧,由此判断的作用是( )
A.作还原剂 B.作氧化剂
C.既作氧化剂又作还原剂 D.作催化剂
5.分类是研究化学的基础,下列分类合理的是(括号内为类型)( )
A.空气(混合物)、(离子化合物)、(酸性氧化物)、(非电解质)
B.(铁盐)、豆浆(胶体)、生铁(混合物)、(钠盐)
C.(三元酸)、纯碱(碱)、(碱性氧化物)、(酸性氧化物)
D.(混合物)、(共价化合物)、CO(酸性氧化物)、(酸)
6.室温下,下列各组离子在指定溶液中可能大量共存的是( )
A.含有大量的溶液:、、、
B.pH试纸变深红色的溶液中:、、、
C.含有大量的溶液中:、、、
D.含有大量溶液中:、、、
7.实验室欲用晶体配制90mL1mol/L的溶液,下列说法正确的是( )
A.要完成实验需称取10.6g晶体
B.所需玻璃仪器有:100ml容量瓶、烧杯、玻璃棒、托盘天平
C.配制时若容量瓶不干燥,含有少量蒸馏水会导致所配的溶液浓度偏低
D.定容时俯视刻度线会导致所配的溶液浓度偏高
8.“氢气对水一心一意,水偏弄成三分四离。”其中“三分四离”指的是新制氯水中的七种微粒,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A.氯水使紫色石花溶液先变红后褪色,说明有和存在
B.向氯水中加入饱和溶液,有无色气体产生,说明有HClO存在
C.氯水使和KSCN的混合溶液变红,主要因为有分子存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
9.下列实验装置正确且能达到实验目的的是( )
A.验证Na和水反应是否为放热反应 B.实验室模拟蒸馏法制淡水 C.稀释浓硫酸 D.比较、的稳定性
A.A B.B C.C D.D
10.下列离子方程式书写正确的是( )
A.通入石灰乳中制取漂白粉:
B.向氯化铝溶液中滴加足量氨水:
C.向氢氧化钠溶液中逐滴加入几滴饱和溶液:
D.向溶液中滴入少量盐酸:
11.已知有下列三个反应:①、②、③。下列有关说法正确的是( )
A.反应①②③中的氧化产物分别是、、
B.根据以上化学方程式可以得到氧化性的强弱是
C.由上推理可得:
D.在反应③中有1mol生成,则被还原的HCl为2mol
12.设为阿伏加德罗常数值,下列有关叙述正确的是( )
A.标准状况下,22.4L盐酸中含有个HCl分子
B.常温常压下,44g含有的质子数数为24
C.1L 0.1溶液中含有0.1个
D.46g和混合气体所含氧原子数目约为2
13.印刷电路板时常用氯化铁溶液作为“腐蚀液”,发生的反应为。向盛有溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中有铁、无铜 B.烧杯中有铜、无铁
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
14.某小组通过如图所示实验,探究与水的反应。
下列说法中不正确的是( )
A.②和③中产生的气泡,均可使带余烬的木条复燃
B.充分振荡后,④中粉末溶解
C.⑤中溶液变红,说明有碱性物质生成
D.③~⑤的现象证明与水的反应过程中存在:和两个反应
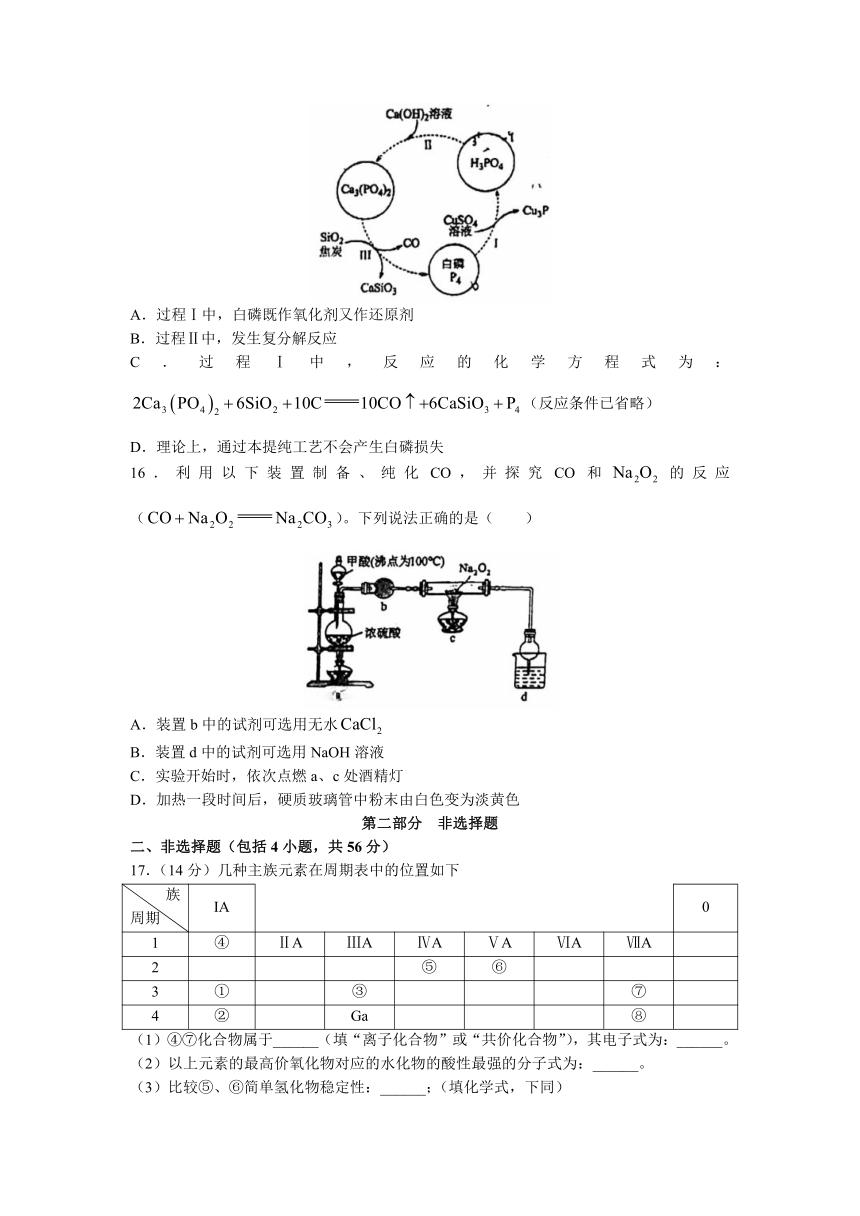
15.一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法不正确的是( )
A.过程Ⅰ中,白磷既作氧化剂又作还原剂
B.过程Ⅱ中,发生复分解反应
C.过程Ⅰ中,反应的化学方程式为:(反应条件已省略)
D.理论上,通过本提纯工艺不会产生白磷损失
16.利用以下装置制备、纯化CO,并探究CO和的反应()。下列说法正确的是( )
A.装置b中的试剂可选用无水
B.装置d中的试剂可选用NaOH溶液
C.实验开始时,依次点燃a、c处酒精灯
D.加热一段时间后,硬质玻璃管中粉末由白色变为淡黄色
第二部分 非选择题
二、非选择题(包括4小题,共56分)
17.(14分)几种主族元素在周期表中的位置如下
族 周期 ⅠA 0
1 ④ ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ⑤ ⑥
3 ① ③ ⑦
4 ② Ga ⑧
(1)④⑦化合物属于______(填“离子化合物”或“共价化合物”),其电子式为:______。
(2)以上元素的最高价氧化物对应的水化物的酸性最强的分子式为:______。
(3)比较⑤、⑥简单氢化物稳定性:______;(填化学式,下同)
比较①、⑥、⑦三种简单离子的半径大小:______。
(4)下列可以判断①和③金属性强弱的是______(填字母)。
A.单质的熔点:①<③
B.化合价:①<③
C.单质与水反应的剧烈程度:①>③
D.最高价氧化物对应水化物的碱性:①>③
(5)金属镓(Ga)常用作光学玻璃、真空管、半导体的原料。
①预测Ga的化学性质并填写表格:
预测性质(所填物质类别不同) 反应后可能的生成物(填化学式)
Ga能与______溶液反应 、______
Ga能与______溶液反应 、
以上预测都是依据______________________________________________________________________________。
18.(15分)舍勒在研究软锰矿(主要成分是)的过程中,将它与浓盐酸混合加热,产生了一种黄绿气体“氯气”。
(1)实验室沿用含勒的方法制取的化学方程式为______。
(2)a、实验室制取干燥时,净化与收集所需装置的接口连接顺序为______;
b、饱和食盐水的作用:______。
(3)用NaOH吸收尾气时生成NaClO,NaCIO是漂白液的主要成分,用离子方程式写出其漂白的原理(查资料可知生成了):______。
(4)某兴趣小组在实验中发现浓盐酸与混合加热生成氯气,稀盐酸与混合加热不生成氯气。对用稀盐酸实验没有氯气生成的原因,兴趣小组经讨论后有如下猜想:
猜想一:小明认为是低导致。
猜想二:小红认为是______导致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入中,然后通入HCl气体加热
b.稀盐酸滴入中,然后加入NaCl固体加热
c.稀盐酸滴入中,然后加入浓硫酸加热
d.与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想______成立。
(5)若用8.7g与足量浓盐酸混合加热,则被氧化的HCl的质量为______g,反应中转移的电子为______mol。
19.(14分)元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。
请回答以下问题:
(1)中Fe的化合价为______。
(2)是否为碱性氧化物______(填是或否),理由:______。
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:______。
(4)已知在强碱溶液中稳定存在,PH越小稳定性越差;则制备时需要在______(填“酸性”“碱性”或“中性”)环境中进行:也可以作为净水剂,能与水反应生成具有吸附性的胶体,写出其中离子方程式:______。其中检验溶液中的试剂是______。
(5)FeO、是合成氨工业生产中所用的催化剂的主要成分。
某FeO、混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、的物质的量之比为______。
20.(13分)侯德榜先生是我国近代著名的化学家,他提出的联合制碱法得到世界各因的认可,主要反应为:。工业流程如下图:
资料:①同温下,NaCl固体溶解度大于固体的溶解度;
②常温时,1体积水大约溶解700体积氨气;1体积水大约溶解1体积二氧化碳。
(1)循环使用的物质X是______。
(2)向饱和食盐水中先通足量的氨气,再通入过量的二氧化碳。先通氨气再通二氧化碳的原因是:______
(3)沉淀池分离出沉淀的操作是______,在实验室中该操作使用的玻璃仪器有______。
(4)“煅烧”时发生反应的化学方程式为______。
(5)母液中主要成分是,为使沉淀充分析出并分离,根据NaCl和溶解度曲线(图一)可采用的操作为______、______。
(6)根据侯式制碱法的原理和上图二各物质的溶解度,判断和能否制备:______(填能或不能);若能,请解释其中原因:______。
参考答案
选择题:1-10每小题2分,11-16每小题4分,共44分。
题号 1 2 3 4 5 6 7 8
答案 C D B A B D D C
题号 9 10 11 12 13 14 15 16
答案 A B B D A B D C
17.(14分,除标注外,每空1分)
(1)共价化合物
(2)(2分)
(3) (2分)
(4)CD(2分)
(5) NaOH Al与Ga同族,化学性质相似(2分)
18.(15分,除标注外,每空2分)
(1)
(2)cdbae 除去氯气中混有的HCI气体
(3)
(4)低 一(1分)
(5)7.3 0.2
19.(14分,除标注外,每空2分)
(1)+6(1分)
(2)是(1分),与盐酸反应生成了盐和水。
(3)
(4)碱性 KSCN溶液
(5)2∶1
20.(13分)
(1)(1分)
(2)氨气极易溶于水,使溶液呈碱性,有利于吸收二氧化碳,便于析出晶体(2分)
(3)过滤(1分);玻璃棒、漏斗、烧杯(2分);
(4)(2分)
(5)蒸发浓缩 降温结晶(2分)
(6)能(1分),NaCl溶液的溶解度最小,有利于析出晶体。(2分)
化学
班别:______ 姓名:______ 学号:______ 成绩:______
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mn 55 Fe 56
第一部分 选择题
一、选择题(本题包括16小题,1-10题每小题2分,11-16题每小题4分,共44分)
注意:每道选择题有四个选项,其中只有一个选项符合题意。请用铅笔在答题卡上作答。错选、不选、多选或涂改不清的,均不给分。
1.近年我国科技成果显著,下列说法不正确的是( )
A.三星堆遗址出土的黄金面具最薄处仅为0.2毫米,体现了金具有良好的延展性
B.蛟龙号载人潜水器外壳用特殊的钛合金材料制成,钛合合的熔点低于单质钛
C.中国天眼FAST用到的碳化硅(SiC)是一种新型的金属材料
D.Ti-Fe是新型储氢合金材料,为氢气作为能源的实际应用起到重要的推动作用。
2.中国科学技术大学的钱逸泰教授等以和金属钠为原料,在700℃时反应制得纳米级金刚石粉末和另一种化合物,该成果发表在世界权威的《科学》杂志上,以下说法不正确的是( )
A.反应过程中被还原 B.该反应不能在空气中进行
C.金刚石和石墨互为同素异形体 D.纳米级金刚石粉末为胶体
3.“奥利奥,黑白配”讲的是金属镁与二氧化碳燃烧的产物氧化镁和碳单质的颜色,其中下列化学用语不正确的是( )
A.的结构示意图: B. 的电子式:
C.C、H元素所形成的的结构式: D.中子数为8的碳原子:
4.吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手",服用含
硒元素(Se)的化合物亚硒酸钠(),能消除人体内的活性氧,由此判断的作用是( )
A.作还原剂 B.作氧化剂
C.既作氧化剂又作还原剂 D.作催化剂
5.分类是研究化学的基础,下列分类合理的是(括号内为类型)( )
A.空气(混合物)、(离子化合物)、(酸性氧化物)、(非电解质)
B.(铁盐)、豆浆(胶体)、生铁(混合物)、(钠盐)
C.(三元酸)、纯碱(碱)、(碱性氧化物)、(酸性氧化物)
D.(混合物)、(共价化合物)、CO(酸性氧化物)、(酸)
6.室温下,下列各组离子在指定溶液中可能大量共存的是( )
A.含有大量的溶液:、、、
B.pH试纸变深红色的溶液中:、、、
C.含有大量的溶液中:、、、
D.含有大量溶液中:、、、
7.实验室欲用晶体配制90mL1mol/L的溶液,下列说法正确的是( )
A.要完成实验需称取10.6g晶体
B.所需玻璃仪器有:100ml容量瓶、烧杯、玻璃棒、托盘天平
C.配制时若容量瓶不干燥,含有少量蒸馏水会导致所配的溶液浓度偏低
D.定容时俯视刻度线会导致所配的溶液浓度偏高
8.“氢气对水一心一意,水偏弄成三分四离。”其中“三分四离”指的是新制氯水中的七种微粒,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A.氯水使紫色石花溶液先变红后褪色,说明有和存在
B.向氯水中加入饱和溶液,有无色气体产生,说明有HClO存在
C.氯水使和KSCN的混合溶液变红,主要因为有分子存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
9.下列实验装置正确且能达到实验目的的是( )
A.验证Na和水反应是否为放热反应 B.实验室模拟蒸馏法制淡水 C.稀释浓硫酸 D.比较、的稳定性
A.A B.B C.C D.D
10.下列离子方程式书写正确的是( )
A.通入石灰乳中制取漂白粉:
B.向氯化铝溶液中滴加足量氨水:
C.向氢氧化钠溶液中逐滴加入几滴饱和溶液:
D.向溶液中滴入少量盐酸:
11.已知有下列三个反应:①、②、③。下列有关说法正确的是( )
A.反应①②③中的氧化产物分别是、、
B.根据以上化学方程式可以得到氧化性的强弱是
C.由上推理可得:
D.在反应③中有1mol生成,则被还原的HCl为2mol
12.设为阿伏加德罗常数值,下列有关叙述正确的是( )
A.标准状况下,22.4L盐酸中含有个HCl分子
B.常温常压下,44g含有的质子数数为24
C.1L 0.1溶液中含有0.1个
D.46g和混合气体所含氧原子数目约为2
13.印刷电路板时常用氯化铁溶液作为“腐蚀液”,发生的反应为。向盛有溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中有铁、无铜 B.烧杯中有铜、无铁
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
14.某小组通过如图所示实验,探究与水的反应。
下列说法中不正确的是( )
A.②和③中产生的气泡,均可使带余烬的木条复燃
B.充分振荡后,④中粉末溶解
C.⑤中溶液变红,说明有碱性物质生成
D.③~⑤的现象证明与水的反应过程中存在:和两个反应
15.一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法不正确的是( )
A.过程Ⅰ中,白磷既作氧化剂又作还原剂
B.过程Ⅱ中,发生复分解反应
C.过程Ⅰ中,反应的化学方程式为:(反应条件已省略)
D.理论上,通过本提纯工艺不会产生白磷损失
16.利用以下装置制备、纯化CO,并探究CO和的反应()。下列说法正确的是( )
A.装置b中的试剂可选用无水
B.装置d中的试剂可选用NaOH溶液
C.实验开始时,依次点燃a、c处酒精灯
D.加热一段时间后,硬质玻璃管中粉末由白色变为淡黄色
第二部分 非选择题
二、非选择题(包括4小题,共56分)
17.(14分)几种主族元素在周期表中的位置如下
族 周期 ⅠA 0
1 ④ ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ⑤ ⑥
3 ① ③ ⑦
4 ② Ga ⑧
(1)④⑦化合物属于______(填“离子化合物”或“共价化合物”),其电子式为:______。
(2)以上元素的最高价氧化物对应的水化物的酸性最强的分子式为:______。
(3)比较⑤、⑥简单氢化物稳定性:______;(填化学式,下同)
比较①、⑥、⑦三种简单离子的半径大小:______。
(4)下列可以判断①和③金属性强弱的是______(填字母)。
A.单质的熔点:①<③
B.化合价:①<③
C.单质与水反应的剧烈程度:①>③
D.最高价氧化物对应水化物的碱性:①>③
(5)金属镓(Ga)常用作光学玻璃、真空管、半导体的原料。
①预测Ga的化学性质并填写表格:
预测性质(所填物质类别不同) 反应后可能的生成物(填化学式)
Ga能与______溶液反应 、______
Ga能与______溶液反应 、
以上预测都是依据______________________________________________________________________________。
18.(15分)舍勒在研究软锰矿(主要成分是)的过程中,将它与浓盐酸混合加热,产生了一种黄绿气体“氯气”。
(1)实验室沿用含勒的方法制取的化学方程式为______。
(2)a、实验室制取干燥时,净化与收集所需装置的接口连接顺序为______;
b、饱和食盐水的作用:______。
(3)用NaOH吸收尾气时生成NaClO,NaCIO是漂白液的主要成分,用离子方程式写出其漂白的原理(查资料可知生成了):______。
(4)某兴趣小组在实验中发现浓盐酸与混合加热生成氯气,稀盐酸与混合加热不生成氯气。对用稀盐酸实验没有氯气生成的原因,兴趣小组经讨论后有如下猜想:
猜想一:小明认为是低导致。
猜想二:小红认为是______导致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入中,然后通入HCl气体加热
b.稀盐酸滴入中,然后加入NaCl固体加热
c.稀盐酸滴入中,然后加入浓硫酸加热
d.与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想______成立。
(5)若用8.7g与足量浓盐酸混合加热,则被氧化的HCl的质量为______g,反应中转移的电子为______mol。
19.(14分)元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。
请回答以下问题:
(1)中Fe的化合价为______。
(2)是否为碱性氧化物______(填是或否),理由:______。
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:______。
(4)已知在强碱溶液中稳定存在,PH越小稳定性越差;则制备时需要在______(填“酸性”“碱性”或“中性”)环境中进行:也可以作为净水剂,能与水反应生成具有吸附性的胶体,写出其中离子方程式:______。其中检验溶液中的试剂是______。
(5)FeO、是合成氨工业生产中所用的催化剂的主要成分。
某FeO、混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、的物质的量之比为______。
20.(13分)侯德榜先生是我国近代著名的化学家,他提出的联合制碱法得到世界各因的认可,主要反应为:。工业流程如下图:
资料:①同温下,NaCl固体溶解度大于固体的溶解度;
②常温时,1体积水大约溶解700体积氨气;1体积水大约溶解1体积二氧化碳。
(1)循环使用的物质X是______。
(2)向饱和食盐水中先通足量的氨气,再通入过量的二氧化碳。先通氨气再通二氧化碳的原因是:______
(3)沉淀池分离出沉淀的操作是______,在实验室中该操作使用的玻璃仪器有______。
(4)“煅烧”时发生反应的化学方程式为______。
(5)母液中主要成分是,为使沉淀充分析出并分离,根据NaCl和溶解度曲线(图一)可采用的操作为______、______。
(6)根据侯式制碱法的原理和上图二各物质的溶解度,判断和能否制备:______(填能或不能);若能,请解释其中原因:______。
参考答案
选择题:1-10每小题2分,11-16每小题4分,共44分。
题号 1 2 3 4 5 6 7 8
答案 C D B A B D D C
题号 9 10 11 12 13 14 15 16
答案 A B B D A B D C
17.(14分,除标注外,每空1分)
(1)共价化合物
(2)(2分)
(3) (2分)
(4)CD(2分)
(5) NaOH Al与Ga同族,化学性质相似(2分)
18.(15分,除标注外,每空2分)
(1)
(2)cdbae 除去氯气中混有的HCI气体
(3)
(4)低 一(1分)
(5)7.3 0.2
19.(14分,除标注外,每空2分)
(1)+6(1分)
(2)是(1分),与盐酸反应生成了盐和水。
(3)
(4)碱性 KSCN溶液
(5)2∶1
20.(13分)
(1)(1分)
(2)氨气极易溶于水,使溶液呈碱性,有利于吸收二氧化碳,便于析出晶体(2分)
(3)过滤(1分);玻璃棒、漏斗、烧杯(2分);
(4)(2分)
(5)蒸发浓缩 降温结晶(2分)
(6)能(1分),NaCl溶液的溶解度最小,有利于析出晶体。(2分)
同课章节目录
