江西省萍乡市芦溪中学2022-2023学年高二上学期期末考试化学试题(含解析)
文档属性
| 名称 | 江西省萍乡市芦溪中学2022-2023学年高二上学期期末考试化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 633.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 11:24:45 | ||
图片预览



文档简介
芦溪中学2022-2023学年高二上学期期末考试
化学试卷
一.单选题(每小题3分,共30分)
1.在压强为2.20×104Kpa、温度达到374℃时,水成为“超临界状态”,此时水与CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是
A.“水热反应”是一种复杂的物理化学变化
B.二氧化碳与超临界水作用生成汽油的反应,属于放热反应
C.火力发电厂可望利用废热,将二氧化碳转变为能源物质
D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
2.规范使用化学用语是基本学科素养的体现。下列化学用语正确的是
A.乙烯的结构简式为:
B.用电子式表示氧化钠的形成过程:
C.乙酸的最简式为:
D.氨气的电子式为:
3.完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,需消耗50 mL 8 mol/L的氢氧化钠溶液,则燃烧1mol无水乙醇放出的热量不可能是
A.10Q B.5Q~10Q C.大于10Q D.5Q
4.下列说法正确的是
A.稀有气体元素原子最外层电子数是所有元素中最多的
B.第五和第六两个周期都是长周期,容纳的元素种类数目相同
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强(除O、F外)
D.具有相同电子层结构的主族元素的简单离子,化合价越高,离子半径越小
5.一种高效电解质的结构如图所示,W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是
A.X与Q的最高化合价均为+6
B.第一电离能:W<Y<X<Z
C.简单氢化物的沸点:X>Z>Y
D.W单质在空气中燃烧的产物是W2O2
6.对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图正确的是
A. B. C. D.
7.下列关于金属腐蚀和防腐蚀的说法正确的是
A.金属腐蚀普遍属于化学腐蚀
B.牺牲阳极的阴极保护法是利用原电池的原理防止腐蚀
C.外加电流的阴极保护法是将被保护的金属与电源正极相连
D.钢铁在潮湿空气中的腐蚀大多数为析氢腐蚀
8.下列离子方程式书写正确的是 ( )
A.铁与稀硫酸反应:2Fe +6H+ = 2Fe3+ +3H2↑
B.铁片与氯化铜溶液反应:Fe +Cu2+ = Cu +Fe2+
C.氢氧化镁溶于盐酸:Mg(OH)2+H+ = Mg2+ +2H2O
D.Ba(OH)2溶液与稀H2SO4反应:Ba2+ + OH- + H+ +SO42- = H2O+BaSO4↓
9.我国科学家研制出与合成甲醇的高效催化剂。下列有关该反应的说法错误的是
A.有利于减排 B.反应生成甲醇和水
C.有利于碳资源循环利用 D.该高效催化剂提高了的平衡转化率
10.常温下,下列各组离子一定能大量共存的是
A.由水电离出的的溶液中:、、、
B.在含大量的溶液中:、、、
C.与Al反应能放出的溶液中:、、、
D.在的溶液中:、、、
二、不定项选择题(每题1-2个正确选项,每小题4分,共20分)
11.下列各选项中错误的是
A.离子半径:Li+H2S>HF
C.酸性:H2SiO312.把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(L min),下列叙述错误的是( )
A.P的平均反应速率是0.15mol/(L min)
B.Q的转化率是25%
C.Q的平衡浓度是1mol/L
D.x的值为2
13.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)NH3(g)+HI(g);②2HI(g)H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2·L-2)为
A.25 B.0.025 C.30.25 D.27.5
14.我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图所示),促进了世界制碱技术的发展.下列有关说法正确的是( )
A.沉淀池中的反应物共含有五种元素
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀
15.下列电化学装置能达到目的的是
A.图甲:实现原电池反应
B.图乙:制取少量
C.图丙:证明铁发生了吸氧腐蚀
D.图丁:在铁表面镀锌
三、填空题(共50分)
16.氮族元素N、P、As等元素在农药、化肥等领域有广泛应用。回答下列问题:
(1)基态磷原子中,电子占据的最高能层符号为___________。
(2)基态As原子的核外电子排布式为___________。
(3)氮元素的简单气态氢化物为,其沸点比的___________(填“高”或“低”),理由是___________。
(4)氮元素的常见含氧酸根为NO,其空间构型为___________,其中N的杂化方式为___________。NO和可形成配离子,该配离子中各元素的第一电离能由小到大的顺序为___________(用元素符号表示),1mol该配离子中含有的键数目为___________ NA。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的晶胞结构如图所示。
①A、B点的原子坐标如图所示,则C点的原子坐标为___________。
②磷化铝的晶胞参数(1pm=10-12m),其密度为___________g/cm3(列出计算式即可,NA表示阿伏加德罗常数的值)。
17.由于亚硝酸钠和食盐性状相似,曾多次发生过将误当食盐食用的事件。欲测定某样品中的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成溶液。
②取溶液于锥形瓶中,用标准溶液(酸性)进行滴定,滴定结束后消耗溶液。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒之外还有_______。
(2)在进行滴定操作时,溶液盛装在_______(填“酸式”或“碱式”)滴定管中。到达滴定终点的标志为_______。
(3)以下操作造成测定结果偏高的是_______。
A.锥形瓶末用待测液润洗
B.若滴定过程中刚出现颜色变化就停止滴定
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.滴定管未用标准溶液润洗
(4)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有、等离子,取一定量的浓缩液,向其中滴加溶液,当开始沉淀时,溶液中_______。(已知,)
(5)硫酸铁净水原因(离子方程式):_______,水解成碱式氯化亚锡(化学方程式)_______,要除去溶液中,可以向溶液中加入_______,将溶液蒸干并灼烧所得固体的化学式为_______。
18.铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+ CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+1/3CO(g)═ 2/3Fe3O4(s)+ 1/3 CO2(g)△H2
Fe3O4(s)+ CO(g)═3Fe(s)+CO2(g)△H3
Fe2O3(s)+ CO(g)═2Fe(s)+3CO2(g)△H4
则△H4 的表达式为_____(用含△H1、△H2、△H3 的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度 250℃ 600℃ 1000℃ 2000℃
主要成分 Fe2O3 Fe3O4 FeO Fe
1600℃时固体物质的主要成分为_____,该温度下若测得固体混合物中 m(Fe):m(O)=35:2, 则 FeO 被 CO 还原为 Fe 的百分率为_________(设其它固体杂质中不含 Fe、O 元素)。
(3)铁等金属可用作 CO 与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g) = CH4(g) +H2O(g)△H<0.在 T℃,106Pa 时将 l mol CO 和 3mol H2 加入体积可变的密闭容器 中.实验测得 CO 的体积分数 x(CO)如下表:
t/min 0 10 20 30 40 50
x(CO) 0.25 0.23 0.214 0.202 0.193 0.193
①能判断 CO(g)+3H2(g) CH4(g)+H2O(g)达到平衡的是_____(填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v 正(CO)=3v 逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时 CO 的转化率为___________;在 T℃106Pa 时该反应的压强平衡常数 Kp(用平衡分 压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为_____。
③图表示该反应 CO 的平衡转化率与温度、压强的关系.图中温度 T1、T2、T3 由高到低的顺序是_____,理由是_____________.
19.异丁烯[CH2=C(CH3)2]是一种重要的化工原料,常用于制备丁基橡胶、甲基丙烯氰等。工业上常利用异丁烷[CH3-CH(CH3)-CH3]为原料制备异丁烯,涉及的主要反应有:
反应I:CH3-CH(CH3)-CH3(g)CH2=C(CH3)2(g)+H2(g) ΔH1=+122kJ·mol-1
反应II:CH3-CH(CH3)-CH3(g)CH3-CH2-CH2-CH3(g) ΔH2=+9kJ·mol-1
请回答下列问题:
(1)已知生成1molH-H键放出能量436kJ,1molC=C键断键生成1molC-C键吸收能量274kJ,则断裂1molC-H键吸收能量为_______kJ。
(2)异丁烷和正丁烷中稳定性更好的是_______(填物质名称),反应II的正活化能与逆活化能之差为_______。
(3)T℃时,向压强恒定为p0kPa的密闭容器中通入一定量的异丁烷,达到平衡时,测得容器中H2的分压为akPa,正丁烷的分压为bkPa。
①T℃时,反应I的化学平衡常数Kp=_______kPa(Kp是用气体分压表示的平衡常数)。
②平衡后,若其他条件不变,向容器中再通入少量N2(不参与反应),则异丁烯的平衡产率将_______(填“增大”“减小”或“不变”),原因为_______。
(4)资料表明,在固体杂多酸盐(用S表示)作催化剂时反应I的反应机理如下:
i.CH3-CH(CH3)-CH3(g)+S→CH3-CH(CH3)-CH3…S;
ii.CH3-CH(CH3)-CH3…S+S→CH2=C(CH3)2…S+H2…S;
iii._______。
iv.H2…S→H2(g)+S。
表征CH3-CH(CH3)-CH3(g)在固体催化剂表面吸附过程的是_______(填反应序号),反应iii的化学方程式为_______。
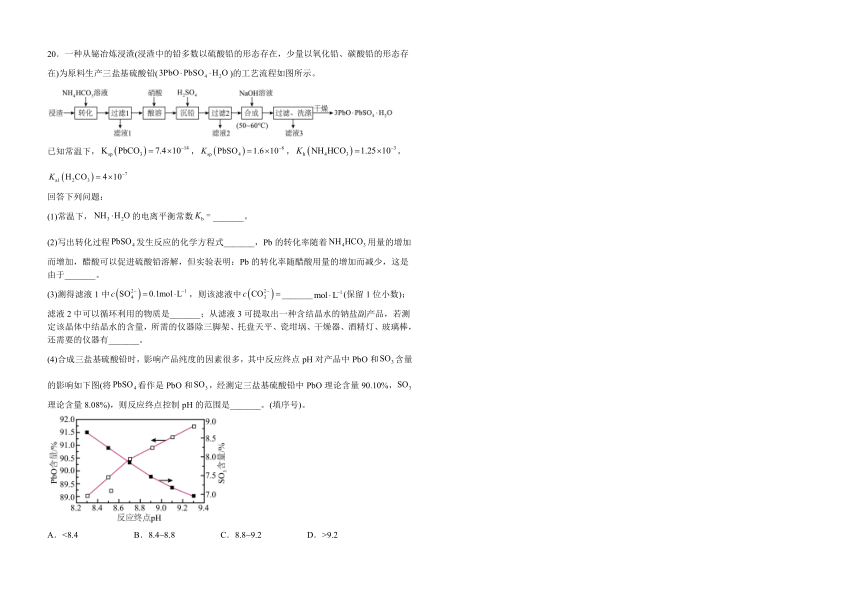
20.一种从铋冶炼浸渣(浸渣中的铅多数以硫酸铅的形态存在,少量以氧化铅、碳酸铅的形态存在)为原料生产三盐基硫酸铅()的工艺流程如图所示。
已知常温下,,,,
回答下列问题:
(1)常温下,的电离平衡常数_______。
(2)写出转化过程发生反应的化学方程式_______,Pb的转化率随着用量的增加而增加,醋酸可以促进硫酸铅溶解,但实验表明:Pb的转化率随醋酸用量的增加而减少,这是由于_______。
(3)测得滤液1中,则该滤液中_______(保留1位小数);滤液2中可以循环利用的物质是_______;从滤液3可提取出一种含结晶水的钠盐副产品,若测定该晶体中结晶水的含量,所需的仪器除三脚架、托盘天平、瓷坩埚、干燥器、酒精灯、玻璃棒,还需要的仪器有_______。
(4)合成三盐基硫酸铅时,影响产品纯度的因素很多,其中反应终点pH对产品中PbO和含量的影响如下图(将看作是PbO和,经测定三盐基硫酸铅中PbO理论含量90.10%,理论含量8.08%),则反应终点控制pH的范围是_______。(填序号)。
A.<8.4 B.8.4~8.8 C.8.8~9.2 D.>9.2
1.B
【详解】A、压强达到2.20×104kPa、温度达到374℃时,水成为“超临界状态”,该过程为物理变化,此时水可将CO2 等含碳化合物转化为有机物,为化学变化,选项A正确;B、由于反应是在高温高压条件下进行的,这说明高温有利于反应向正反应方向进行,因此正反应是吸热反应,选项B不正确,C、高压条件下将CO2等含碳化合物转化为有机物,是将二氧化碳转变为能源物质,选项C正确;D、充分利用地球上的碳资源,有利于碳资源的循环使用,选项D正确。答案选B。
点睛:本题考查新能源的开发和利用,题目难度不大,注意题中所给信息的理解和运用,注意化石能源的应用。
2.C
【详解】A.乙烯的结构简式为:CH2=CH2,A错误;
B.氧化钠形成过程有电子得失,图示电子式表示氧化钠的形成过程正确,但Na2O的电子式错误,Na2O的电子式为 ,B正确;
C.乙酸的分子式为C2H4O2,则其最简式为CH2O,C错误;
D.氨气的电子式为,D错误;
故选C。
3.C
【分析】据CO2与NaOH溶液反应,利用极限法计算出CO2的物质的量范围,进而计算出乙醇的物质的量范围,根据乙醇的物质的量和热量的关系计算出1mol乙醇完全燃烧生成水放出的热量即可。
【详解】n(NaOH)=0.05L×8mol/L=0.4mol,则由CO2~2NaOH~Na2CO3,可知,n(CO2)=0.2mol,则n(C2H6O)=×n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,由CO2~NaOH~NaHCO3可知,n(CO2)=0.4mol,则n(C2H6O)=×n(CO2)=0.2mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为5Q,若二氧化碳和氢氧化钠反应生成碳酸氢钠和碳酸钠的化合物,则乙醇的燃烧热在5Q~10Q之间,所以C不符合;答案选C。
【点睛】本题考查了化学反应极值分析计算,反应燃烧热概念的分析应用,掌握概念和计算方法是解题关键,题目难度中等。
4.D
【详解】A.氦元素原子最外层只有2个电子,故A错误;
B.第五和第六两个周期都是长周期,第五周期容纳18种元素,第六周期含有镧系元素,容纳32种元素,故C错误;
C.同周期非金属最高价氧化物对应水化物的酸性从左到右依次增强,若不是最高价含氧酸则酸性强弱不一定,如硫酸的酸性比次氯酸强,故C错误;
D.有相同电子层结构的主族元素的简单阳离子,化合价越高,原子核电荷数越大,离子半径越小,故D正确;
故答案为:D。
【点睛】“三看”法快速判断简单微粒半径的大小:
一看电子层数:最外层电子数相同时,电子层数越多,半径越大;
二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小;
三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
5.C
【分析】W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,W可形成1价阳离子、W为ⅠA,则X与Q同族,Q能共用6对电子对、则最外层有6个电子,X、Q为ⅥA,结合原子序数的相对大小可知:X为O元素、Q为S元素,W为Li元素;Z能共用1对电子对,Z为ⅦA、结合原子序数的相对大小,Z为F元素,Y和Z的原子序数之和与Q相等,Y的原子序数=16-9=7,Y为N元素,Y共用2对电子对、从W处得到1个电子,则Y也满足8电子结构,综上,W为Li、Y为N、X为O、Z为F、Q为S,据此回答。
【详解】A.X为O、Q为S,Q的最高化合价均为+6,X则没有+6价,A错误;
B.同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第VA族第一电离能大于其相邻元素,故N>O,B错误;
C.X为O、Z为F、Y为N,简单氢化物分别为H2O、HF、NH3,水分子、氟化氢分子、氨气分子之间都有氢键,分子间氢键作用:H2O>HF>NH3,故沸点:H2O>HF>NH3,C正确;
D.W单质(Li)在空气中燃烧的产物是W2O(Li2O),D错误;
答案选C。
6.A
【详解】A.温度越高反应速率越快,最先达到平衡,此反应为放热反应,升高温度,平衡左移,C的百分含量减小,图象符合实际,故A正确;
B.增大压强,各物质的浓度增大,正逆反应速率均加快,不会出现正反应速率加快而逆反应速率减慢的情况,故B错误;
C.催化剂只是改变反应的速率,不影响平衡移动,加入催化剂,反应速率加快,所用时间缩短,但是C的浓度应该不变,故C错误;
D.此反应为放热反应,升高温度,平衡左移,B的体积分数增大,而题给图象B的体积分数随温度升高而减小;增大压强,平衡右移,B的体积分数减小,而题给图象是增大,均和实际不符,故D错误;
故选A。
7.B
【详解】A.金属腐蚀普遍属于电化学腐蚀,A错误;
B.牺牲阳极的阴极保护法是将被保护的金属作原电池的正极,因此是利用原电池的原理防止腐蚀,B正确;
C.外加电流的阴极保护法是将被保护的金属与电源负极相连,作阴极被保护,C错误;
D.钢铁在潮湿空气中的腐蚀大多数为吸氧腐蚀,只有在酸性较强时才发生析氢腐蚀,D错误;答案选B。
8.B
【分析】A. 铁与稀硫酸反应生成硫酸亚铁和氢气。
B. 铁片与氯化铜溶液反应生成氯化亚铁和铜。
C. 氢氧化镁与盐酸反应生成氯化镁和水。
D. Ba(OH)2溶液与稀H2SO4反应生成硫酸钡和水。
【详解】A.铁与稀硫酸反应离子方程式:Fe +2H+ = Fe2+ +H2↑,A错误。
B.铁片与氯化铜溶液反应离子方程式:Fe +Cu2+ = Cu +Fe2+,B正确。
C.氢氧化镁溶于盐酸离子方程式:Mg(OH)2+2H+ = Mg2+ +2H2O,C错误。
D. Ba(OH)2溶液与稀H2SO4反应离子方程式:Ba2+ + 2OH- + 2H+ +SO42- = 2H2O+BaSO4↓,D错误。
【点睛】离子方程式书写除了要考虑客观事实、质量守恒、电荷守恒、不能拆成离子的沉淀弱电解质等,还要考虑反应时各物质中离子的数量比值。
9.D
【详解】A. 用生产甲醇,有利于减排,故A正确;
B. 根据质量守恒知反应生成甲醇和水,故B正确;
C. 与合成甲醇,甲醇在燃烧后产生二氧化碳,所以有利于碳资源循环利用,故C正确;
D. 催化剂只能加快反应速率,对的平衡转化率没有影响,故D错误;
答案选D。
10.D
【详解】A.由水电离的c(H+)=1×10﹣11mol L﹣1的溶液中存在大量的H+或OH﹣,Mg2+、离子与氢氧根离子反应,离子与氢离子反应,在溶液中一定不能大量共存,故A错误;
B.在含大量的溶液中,与不能大量共存,故B错误;
C.加入铝粉产生H2的溶液中存在大量的H+或OH﹣,Al3+、与氢氧根离子反应,与氢离子反应,且与会发生强烈双水解,在溶液中一定不能大量共存,故C错误;
D.的溶液中存在大量氢氧根离子,所给离子组都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D。
11.B
【详解】A项、同主族元素自上而下,离子半径依次增大,则离子半径的大小顺序为Li+B项、元素非金属性越强,氢化物的稳定性越强,非金属性的强弱顺序为SiC项、元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性的强弱顺序为SiD项、元素的金属性越强,最高价氧化物对应水化物的碱性越强,金属性的强弱顺序为Al故选B。
【点睛】本题考查元素周期律,侧重于分析能力的考查,注意把握周期律的内涵及应用,明确元素金属性和非金属性强弱的比较方法是解答关键。
12.BD
【详解】把3molP和2.5molQ置于2L密闭容器中,5min后达到平衡,生成1mol N,则:
3P(g)+Q(g)xM(g)+2N(g)
起始量(mol):3 2.5 0 0
变化量(mol):1.5 0.5 0.25x 1
平衡量(mol):1.5 2 0.25x 1
A.=0.15mol/(Lmin),故A正确;
B.Q转化率=×100%=20%,故B错误;
C.Q的平衡浓度为=1mol/L,故C正确;
D.根据M的速率,则0.25x=0.1mol/(Lmin)×5min×2L,解得x=4,故D错误;
故选BD。
【点评】本题考查化学平衡计算,理解掌握三段式在化学平衡计算中应用,比较基础。
13.D
【详解】平衡时c(HI)=5mol L-1,HI分解生成的H2的浓度为0.25mol L-1.
NH4I分解生成的HI的浓度为5mol L-1+2×0.25mol L-1=5.5mol L-1,所以NH4I分解生成的NH3的浓度为5.5mol L-1, 所以反应①的平衡常数k=c(NH3) c(HI)=5.5mol L-1×5mol L-1=27.5mol L-1。答案选D。
14.D
【详解】A.沉淀池中发生的反应的反应物是氯化钠、氨气、二氧化碳和水,所以含有钠、氯、氮、氢、碳、氧六种元素,故A错误;
B.过滤得到的“母液”中含有的溶质有碳酸氢钠、氯化铵,还有可能含有过量的氯化钠,故B错误;
C.碳酸氢钠分解生成碳酸钠、水、二氧化碳,所以X是二氧化碳,故C错误;
D.氨气的水溶液显碱性,能更好的吸收二氧化碳,使反应物浓度大,反应速度快,故D正确;
故答案为D。
15.AC
【详解】A.图甲中碳棒为负极,电解质溶液中Fe3+发生还原反应生成Fe2+,Cu棒为正极,电解质溶液中Cu2+发生还原反应生成Cu,总反应为,故A正确;
B.图乙中制取时,Fe应与电源正极相连作阳极,故B错误;
C.图丙中铁如果发生吸氧腐蚀,则右侧导管中能形成一段稳定高于试管内液面的液柱,故C正确;
D.由于氧化性:Fe2+>Zn2+,因此无法实现镀锌,故D错误;
综上所述,答案为AC。
16.(1)M
(2)或
(3) 高 分子间存在氢键
(4) 平面三角形 16
(5) (,,)
【解析】(1)
已知磷是15号元素,基态磷原子的核外电子排布式为:1s22s22p63s23p3,故基态磷原子中,电子占据的最高能层符号为M,故答案为:M;
(2)
已知As是33号元素,故基态As原子的核外电子排布式为或,故答案为:或;
(3)
由于NH3中存在分子间氢键,而PH3分子间不存在氢键,故导致氮元素的简单气态氢化物为的沸点比的高,故答案为:高;分子间存在氢键;
(4)
氮元素的常见含氧酸根为NO,NO中心原子N原子周围的价层电子对数为:3+(5+1-3×2)=3,根据价层电子对互斥理论可知其空间构型为平面三角形,根据杂化轨道理论可知, N的杂化方式为sp2,NO和可形成配离子,该配离子中各元素即N、O、Co,根据第一电离能同一周期从左往右呈增大趋势,IIA与IIIA、VA与VIA反常,金属的第一电离能一般小于非金属,故第一电离能由小到大的顺序为,已知单键、双键、三键均只有一个键,故1个NO含有3个NO,另外4个NO与Co2+之间形成4个配位键即4个键,1mol该配离子中含有的键数目为1mol×(4×3+4)×NAmol-1=16NA,故答案为:平面三角形;sp2;;16;
(5)
①由晶胞图结合A、B的坐标可知,C点与晶胞顶点连线处于晶胞体对角线上,且二者距离等于晶胞体对角线长度的,故C点到左侧面、前平面、下底面的距离分别为晶胞棱长的、、,故C点的原子坐标为(,,),故答案为:(,,);
③晶胞中,Al原子数目为4,P原子数目为8×+6×=4,晶胞质量=4×g,磷化铝的晶胞参数a=546.35pm,其密度=4×g,÷(546.35×10-10 cm)3= g/cm3,故答案为:。
17.(1)100mL容量瓶和胶头滴管
(2) 酸式 当滴入最后半滴高锰酸钾标准溶液时,溶液颜色由无色变为浅紫红色,且摇动半分钟颜色不褪去
(3)CE
(4)4.5×10-7
(5) Fe3++3H2OFe(OH)3(胶体)+3H+ SnCl2+H2OSn(OH)Cl+HCl CuO或Cu(OH)2 Al2O3
【分析】NaNO2中的N元素为+3价,有还原性,可以被酸性高锰酸钾溶液氧化。
【详解】(1)配制一定体积的溶液,需要用一定规格的容量瓶,还需要用胶头滴管定容,所以需要的玻璃仪器除了烧杯和玻璃棒之外,还需要100mL容量瓶和胶头滴管。
(2)高锰酸钾溶液有强氧化性,会腐蚀橡胶,应装在酸式滴定管中。向无色的NaNO2溶液中滴加紫色的酸性高锰酸钾溶液,当滴入最后半滴高锰酸钾标准溶液时,溶液颜色由无色变为浅紫红色,且摇动半分钟颜色不褪去,即达到了滴定终点。
(3)NaNO2的含量和所用的高锰酸钾溶液的体积成正比。
A.锥形瓶不用润洗,若用待测液润洗,会造成所用高锰酸钾溶液体积偏大,NaNO2含量偏高,锥形瓶没有润洗,对结果没有影响,故A不选;
B.若滴定过程中刚出现颜色变化就停止滴定,则滴入的高锰酸钾溶液体积偏小,NaNO2含量偏低,故B不选;
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失,读取的高锰酸钾溶液体积偏大,计算出的NaNO2含量偏高,故C选;
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数,读取的高锰酸钾溶液体积偏小,计算出的NaNO2含量偏低,故D不选;
E.滴定管未用 KMnO4标准溶液润洗,则所用的高锰酸钾溶液体积偏大,计算出的NaNO2含量偏高,故E选;
故选CE。
(4)由于Ksp(AgI)<Ksp(AgCl),所以当AgCl开始沉淀时,AgI已经沉淀完全,溶液中存在着AgCl和AgI的溶解平衡,所以=4.5×10-7。
(5)硫酸铁在水中电离的Fe3+水解生成氢氧化铁胶体,胶体具有吸附性,能净水,Fe3+水解的离子方程式为Fe3++3H2OFe(OH)3(胶体)+3H+;SnCl2水解成碱式氯化亚锡的化学方程式为SnCl2+H2OSn(OH)Cl+HCl;要除去 CuCl2溶液中 FeCl3,可以向溶液中加入CuO或Cu(OH)2,和溶液中的H+反应,使溶液的pH增大,促进Fe3+的水解,使Fe3+水解为Fe(OH)3沉淀而除去;AlCl3溶液中存在着AlCl3的水解:AlCl3+3H2OAl(OH)3+3HCl,将 AlCl3溶液加热,促进AlCl3的水解,同时生成的HCl挥发,从而使水解平衡正向移动,所以蒸干并灼烧所得固体为Al(OH)3分解生成的Al2O3。
18. △H2+△H3 FeO和Fe 80% bd 37.1% T3>T2>T1 正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率升高
【详解】(1)已知反应:Fe2O3(s)+CO(g)═Fe3O4(s)+CO2(g)△H2② Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3 ③,根据盖斯定律,将所给的反应②+③×可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故△H4=△H2+△H3 ,故答案为△H2+△H3 ;
(2)根据当1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:=,即可求的x:y=1:4,故剩余的FeO和被还原为铁的FeO的物质的量之比为1:4,则可知被还原的FeO的百分比为×100%=80%,故答案为FeO和Fe;80%;
(3)①a.由于此容器是个体积可变的容器,故为恒容的容器,则容器内压强一直不变,故不能作为反应达平衡的标志,故a错误;b.此反应在平衡前,气体的质量不变,但体积变小,故密度变大,故当混合气体的密度不再发生变化时能说明反应达平衡,故b正确;c.反应达平衡的根本标志是v正=v逆,所以3v正(CO)=v逆(H2),故c错误;d.在反应达平衡之前,混合气体的质量不变,但物质的量变小,故混合气体的平均相对分子质量在变小,故当不变时能说明反应达平衡,故d正确。故选bd;
②设反应达平衡时CO转化了xmol,则根据三段式可知:
CO(g) + 3H2(g)CH4(g)+H2O(g)
初始(n): 1mol 3mol 0 0
△n: xmol 3xmol xmol xmol
平衡(n): (1-x)mol (3-3x)mol xmol xmol
结合平衡时CO的体积分数为0.193可知:=0.193,解得x=0.371,故达到平衡时CO的转化率为=×100%=37.1%;在T℃106Pa时该反应的压强平衡常数Kp==,故答案为37.1%;;
③反应CO(g)+3H2(g)CH4(g)+H2O(g)△H<0,温度越高,则平衡左移,CO的平衡转化率越低,根据图象可知,温度T3>T2>T1,故答案为T3>T2>T1;正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高。
19.(1)416
(2) 异丁烷 9 kJ·mol-1
(3) 增大 反应I 是气体体积增大的反应,总压恒定时,通入N2会降低反应I的分压,使反应I正向进行程度增大
(4) i CH2 =C(CH3)2 …S→CH2 =C(CH3)2(g)+ S
【解析】(1)
反应I中断裂2 molC- H键、形成1 mol碳碳π键和1 mol H一H键,故2E(C-H)- E(碳碳π键)-E(H- H)=+122 kJ·mol-1,解得E(C-H)=416 kJ·mol-1。
(2)
反应I为吸热反应,故与正丁烷相比,异丁烷能量更低,稳定性更高;反应II为吸热反应,正活化能大于逆活化能,二者的差值刚好为ΔH2即9 kJ·mol-1。
(3)
①由压强恒定为p0 kPa,达到平衡时,H2的分压为a kPa,正丁烷的分压为b kPa可知,平衡时,异丁烯的分压为a kPa,异丁烷的分压为p0kPa-a kPa-a kPa-b kPa=(p0-2a-b) kPa,将相关数据代入Kp表达式计算可得Kp= kPa。
②若其他条件不变,平衡后再通入少量N2,则对反应I相当于减压,由于反应I正反应气体体积增大,故反应I正向进行程度会增大,异丁烯的平衡产率增大。
(4)
由反应机理可知,反应i表示的是异丁烷在催化剂上的吸附过程;由总反应及反应机理可知反应iii表示的是异丁烯在催化剂上的脱附过程,化学方程式为CH2 =C(CH3)2 …S→CH2 =C(CH3)2(g)+ S。
20.(1)2×10-5
(2) PbSO4+2NH4HCO3=PbCO3+(NH4)2SO4+H2O+CO2↑ 醋酸易与碳酸氢铵反应,降低了碳酸氢铵的量
(3) 4.6×10-7 硝酸 坩埚钳、泥三角
(4)B
【分析】一种从铋冶炼浸渣(浸渣中的铅多数以硫酸铅的形态存在,少量以氧化铅、碳酸铅的形态存在)加碳酸氢铵,PbSO4+2NH4HCO3=PbCO3+(NH4)2SO4+H2O+CO2↑,过滤后滤渣用硝酸酸溶,再加硫酸得到PbSO4,过滤得滤渣,加NaOH溶液在50-60℃合成,过滤、洗涤、干燥得三盐基硫酸铅()。
【详解】(1)在NH4HCO3溶液中,反应NH +HCO+H2O NH3 H2O+H2CO3的平衡常数K===1.25×10-3,常温下,的电离平衡常数2×10-5。故答案为:2×10-5;
(2)转化过程转化为更难溶的PbCO3,发生反应的化学方程式PbSO4+2NH4HCO3=PbCO3+(NH4)2SO4+H2O+CO2↑,Pb的转化率随着用量的增加而增加,醋酸可以促进硫酸铅溶解,但实验表明:Pb的转化率随醋酸用量的增加而减少,这是由于醋酸易与碳酸氢铵反应,降低了碳酸氢铵的量。故答案为:PbSO4+2NH4HCO3=PbCO3+(NH4)2SO4+H2O+CO2↑;醋酸易与碳酸氢铵反应,降低了碳酸氢铵的量;
(3)测得滤液1中,PbSO4+CO PbCO3+SO, ,则该滤液中4.6×10-7;滤液2中可以循环利用的物质是硝酸;加热固体要在坩埚中进行,从滤液3可提取出一种含结晶水的钠盐副产品,若测定该晶体中结晶水的含量,所需的仪器除三脚架、托盘天平、瓷坩埚、干燥器、酒精灯、玻璃棒,还需要的仪器有坩埚钳、泥三角。故答案为:4.6×10-7;硝酸;坩埚钳、泥三角;
(4)三盐基硫酸铅中PbO理论含量90.10%,理论含量8.08%),结合图形分析反应终点控制pH的范围是8.4~8.8,则反应终点控制pH的范围是B。故答案为:B。
化学试卷
一.单选题(每小题3分,共30分)
1.在压强为2.20×104Kpa、温度达到374℃时,水成为“超临界状态”,此时水与CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是
A.“水热反应”是一种复杂的物理化学变化
B.二氧化碳与超临界水作用生成汽油的反应,属于放热反应
C.火力发电厂可望利用废热,将二氧化碳转变为能源物质
D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
2.规范使用化学用语是基本学科素养的体现。下列化学用语正确的是
A.乙烯的结构简式为:
B.用电子式表示氧化钠的形成过程:
C.乙酸的最简式为:
D.氨气的电子式为:
3.完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,需消耗50 mL 8 mol/L的氢氧化钠溶液,则燃烧1mol无水乙醇放出的热量不可能是
A.10Q B.5Q~10Q C.大于10Q D.5Q
4.下列说法正确的是
A.稀有气体元素原子最外层电子数是所有元素中最多的
B.第五和第六两个周期都是长周期,容纳的元素种类数目相同
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强(除O、F外)
D.具有相同电子层结构的主族元素的简单离子,化合价越高,离子半径越小
5.一种高效电解质的结构如图所示,W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是
A.X与Q的最高化合价均为+6
B.第一电离能:W<Y<X<Z
C.简单氢化物的沸点:X>Z>Y
D.W单质在空气中燃烧的产物是W2O2
6.对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图正确的是
A. B. C. D.
7.下列关于金属腐蚀和防腐蚀的说法正确的是
A.金属腐蚀普遍属于化学腐蚀
B.牺牲阳极的阴极保护法是利用原电池的原理防止腐蚀
C.外加电流的阴极保护法是将被保护的金属与电源正极相连
D.钢铁在潮湿空气中的腐蚀大多数为析氢腐蚀
8.下列离子方程式书写正确的是 ( )
A.铁与稀硫酸反应:2Fe +6H+ = 2Fe3+ +3H2↑
B.铁片与氯化铜溶液反应:Fe +Cu2+ = Cu +Fe2+
C.氢氧化镁溶于盐酸:Mg(OH)2+H+ = Mg2+ +2H2O
D.Ba(OH)2溶液与稀H2SO4反应:Ba2+ + OH- + H+ +SO42- = H2O+BaSO4↓
9.我国科学家研制出与合成甲醇的高效催化剂。下列有关该反应的说法错误的是
A.有利于减排 B.反应生成甲醇和水
C.有利于碳资源循环利用 D.该高效催化剂提高了的平衡转化率
10.常温下,下列各组离子一定能大量共存的是
A.由水电离出的的溶液中:、、、
B.在含大量的溶液中:、、、
C.与Al反应能放出的溶液中:、、、
D.在的溶液中:、、、
二、不定项选择题(每题1-2个正确选项,每小题4分,共20分)
11.下列各选项中错误的是
A.离子半径:Li+
C.酸性:H2SiO3
A.P的平均反应速率是0.15mol/(L min)
B.Q的转化率是25%
C.Q的平衡浓度是1mol/L
D.x的值为2
13.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)NH3(g)+HI(g);②2HI(g)H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2·L-2)为
A.25 B.0.025 C.30.25 D.27.5
14.我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图所示),促进了世界制碱技术的发展.下列有关说法正确的是( )
A.沉淀池中的反应物共含有五种元素
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀
15.下列电化学装置能达到目的的是
A.图甲:实现原电池反应
B.图乙:制取少量
C.图丙:证明铁发生了吸氧腐蚀
D.图丁:在铁表面镀锌
三、填空题(共50分)
16.氮族元素N、P、As等元素在农药、化肥等领域有广泛应用。回答下列问题:
(1)基态磷原子中,电子占据的最高能层符号为___________。
(2)基态As原子的核外电子排布式为___________。
(3)氮元素的简单气态氢化物为,其沸点比的___________(填“高”或“低”),理由是___________。
(4)氮元素的常见含氧酸根为NO,其空间构型为___________,其中N的杂化方式为___________。NO和可形成配离子,该配离子中各元素的第一电离能由小到大的顺序为___________(用元素符号表示),1mol该配离子中含有的键数目为___________ NA。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的晶胞结构如图所示。
①A、B点的原子坐标如图所示,则C点的原子坐标为___________。
②磷化铝的晶胞参数(1pm=10-12m),其密度为___________g/cm3(列出计算式即可,NA表示阿伏加德罗常数的值)。
17.由于亚硝酸钠和食盐性状相似,曾多次发生过将误当食盐食用的事件。欲测定某样品中的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成溶液。
②取溶液于锥形瓶中,用标准溶液(酸性)进行滴定,滴定结束后消耗溶液。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒之外还有_______。
(2)在进行滴定操作时,溶液盛装在_______(填“酸式”或“碱式”)滴定管中。到达滴定终点的标志为_______。
(3)以下操作造成测定结果偏高的是_______。
A.锥形瓶末用待测液润洗
B.若滴定过程中刚出现颜色变化就停止滴定
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.滴定管未用标准溶液润洗
(4)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有、等离子,取一定量的浓缩液,向其中滴加溶液,当开始沉淀时,溶液中_______。(已知,)
(5)硫酸铁净水原因(离子方程式):_______,水解成碱式氯化亚锡(化学方程式)_______,要除去溶液中,可以向溶液中加入_______,将溶液蒸干并灼烧所得固体的化学式为_______。
18.铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+ CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+1/3CO(g)═ 2/3Fe3O4(s)+ 1/3 CO2(g)△H2
Fe3O4(s)+ CO(g)═3Fe(s)+CO2(g)△H3
Fe2O3(s)+ CO(g)═2Fe(s)+3CO2(g)△H4
则△H4 的表达式为_____(用含△H1、△H2、△H3 的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度 250℃ 600℃ 1000℃ 2000℃
主要成分 Fe2O3 Fe3O4 FeO Fe
1600℃时固体物质的主要成分为_____,该温度下若测得固体混合物中 m(Fe):m(O)=35:2, 则 FeO 被 CO 还原为 Fe 的百分率为_________(设其它固体杂质中不含 Fe、O 元素)。
(3)铁等金属可用作 CO 与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g) = CH4(g) +H2O(g)△H<0.在 T℃,106Pa 时将 l mol CO 和 3mol H2 加入体积可变的密闭容器 中.实验测得 CO 的体积分数 x(CO)如下表:
t/min 0 10 20 30 40 50
x(CO) 0.25 0.23 0.214 0.202 0.193 0.193
①能判断 CO(g)+3H2(g) CH4(g)+H2O(g)达到平衡的是_____(填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v 正(CO)=3v 逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时 CO 的转化率为___________;在 T℃106Pa 时该反应的压强平衡常数 Kp(用平衡分 压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为_____。
③图表示该反应 CO 的平衡转化率与温度、压强的关系.图中温度 T1、T2、T3 由高到低的顺序是_____,理由是_____________.
19.异丁烯[CH2=C(CH3)2]是一种重要的化工原料,常用于制备丁基橡胶、甲基丙烯氰等。工业上常利用异丁烷[CH3-CH(CH3)-CH3]为原料制备异丁烯,涉及的主要反应有:
反应I:CH3-CH(CH3)-CH3(g)CH2=C(CH3)2(g)+H2(g) ΔH1=+122kJ·mol-1
反应II:CH3-CH(CH3)-CH3(g)CH3-CH2-CH2-CH3(g) ΔH2=+9kJ·mol-1
请回答下列问题:
(1)已知生成1molH-H键放出能量436kJ,1molC=C键断键生成1molC-C键吸收能量274kJ,则断裂1molC-H键吸收能量为_______kJ。
(2)异丁烷和正丁烷中稳定性更好的是_______(填物质名称),反应II的正活化能与逆活化能之差为_______。
(3)T℃时,向压强恒定为p0kPa的密闭容器中通入一定量的异丁烷,达到平衡时,测得容器中H2的分压为akPa,正丁烷的分压为bkPa。
①T℃时,反应I的化学平衡常数Kp=_______kPa(Kp是用气体分压表示的平衡常数)。
②平衡后,若其他条件不变,向容器中再通入少量N2(不参与反应),则异丁烯的平衡产率将_______(填“增大”“减小”或“不变”),原因为_______。
(4)资料表明,在固体杂多酸盐(用S表示)作催化剂时反应I的反应机理如下:
i.CH3-CH(CH3)-CH3(g)+S→CH3-CH(CH3)-CH3…S;
ii.CH3-CH(CH3)-CH3…S+S→CH2=C(CH3)2…S+H2…S;
iii._______。
iv.H2…S→H2(g)+S。
表征CH3-CH(CH3)-CH3(g)在固体催化剂表面吸附过程的是_______(填反应序号),反应iii的化学方程式为_______。
20.一种从铋冶炼浸渣(浸渣中的铅多数以硫酸铅的形态存在,少量以氧化铅、碳酸铅的形态存在)为原料生产三盐基硫酸铅()的工艺流程如图所示。
已知常温下,,,,
回答下列问题:
(1)常温下,的电离平衡常数_______。
(2)写出转化过程发生反应的化学方程式_______,Pb的转化率随着用量的增加而增加,醋酸可以促进硫酸铅溶解,但实验表明:Pb的转化率随醋酸用量的增加而减少,这是由于_______。
(3)测得滤液1中,则该滤液中_______(保留1位小数);滤液2中可以循环利用的物质是_______;从滤液3可提取出一种含结晶水的钠盐副产品,若测定该晶体中结晶水的含量,所需的仪器除三脚架、托盘天平、瓷坩埚、干燥器、酒精灯、玻璃棒,还需要的仪器有_______。
(4)合成三盐基硫酸铅时,影响产品纯度的因素很多,其中反应终点pH对产品中PbO和含量的影响如下图(将看作是PbO和,经测定三盐基硫酸铅中PbO理论含量90.10%,理论含量8.08%),则反应终点控制pH的范围是_______。(填序号)。
A.<8.4 B.8.4~8.8 C.8.8~9.2 D.>9.2
1.B
【详解】A、压强达到2.20×104kPa、温度达到374℃时,水成为“超临界状态”,该过程为物理变化,此时水可将CO2 等含碳化合物转化为有机物,为化学变化,选项A正确;B、由于反应是在高温高压条件下进行的,这说明高温有利于反应向正反应方向进行,因此正反应是吸热反应,选项B不正确,C、高压条件下将CO2等含碳化合物转化为有机物,是将二氧化碳转变为能源物质,选项C正确;D、充分利用地球上的碳资源,有利于碳资源的循环使用,选项D正确。答案选B。
点睛:本题考查新能源的开发和利用,题目难度不大,注意题中所给信息的理解和运用,注意化石能源的应用。
2.C
【详解】A.乙烯的结构简式为:CH2=CH2,A错误;
B.氧化钠形成过程有电子得失,图示电子式表示氧化钠的形成过程正确,但Na2O的电子式错误,Na2O的电子式为 ,B正确;
C.乙酸的分子式为C2H4O2,则其最简式为CH2O,C错误;
D.氨气的电子式为,D错误;
故选C。
3.C
【分析】据CO2与NaOH溶液反应,利用极限法计算出CO2的物质的量范围,进而计算出乙醇的物质的量范围,根据乙醇的物质的量和热量的关系计算出1mol乙醇完全燃烧生成水放出的热量即可。
【详解】n(NaOH)=0.05L×8mol/L=0.4mol,则由CO2~2NaOH~Na2CO3,可知,n(CO2)=0.2mol,则n(C2H6O)=×n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,由CO2~NaOH~NaHCO3可知,n(CO2)=0.4mol,则n(C2H6O)=×n(CO2)=0.2mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为5Q,若二氧化碳和氢氧化钠反应生成碳酸氢钠和碳酸钠的化合物,则乙醇的燃烧热在5Q~10Q之间,所以C不符合;答案选C。
【点睛】本题考查了化学反应极值分析计算,反应燃烧热概念的分析应用,掌握概念和计算方法是解题关键,题目难度中等。
4.D
【详解】A.氦元素原子最外层只有2个电子,故A错误;
B.第五和第六两个周期都是长周期,第五周期容纳18种元素,第六周期含有镧系元素,容纳32种元素,故C错误;
C.同周期非金属最高价氧化物对应水化物的酸性从左到右依次增强,若不是最高价含氧酸则酸性强弱不一定,如硫酸的酸性比次氯酸强,故C错误;
D.有相同电子层结构的主族元素的简单阳离子,化合价越高,原子核电荷数越大,离子半径越小,故D正确;
故答案为:D。
【点睛】“三看”法快速判断简单微粒半径的大小:
一看电子层数:最外层电子数相同时,电子层数越多,半径越大;
二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小;
三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
5.C
【分析】W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,W可形成1价阳离子、W为ⅠA,则X与Q同族,Q能共用6对电子对、则最外层有6个电子,X、Q为ⅥA,结合原子序数的相对大小可知:X为O元素、Q为S元素,W为Li元素;Z能共用1对电子对,Z为ⅦA、结合原子序数的相对大小,Z为F元素,Y和Z的原子序数之和与Q相等,Y的原子序数=16-9=7,Y为N元素,Y共用2对电子对、从W处得到1个电子,则Y也满足8电子结构,综上,W为Li、Y为N、X为O、Z为F、Q为S,据此回答。
【详解】A.X为O、Q为S,Q的最高化合价均为+6,X则没有+6价,A错误;
B.同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第VA族第一电离能大于其相邻元素,故N>O,B错误;
C.X为O、Z为F、Y为N,简单氢化物分别为H2O、HF、NH3,水分子、氟化氢分子、氨气分子之间都有氢键,分子间氢键作用:H2O>HF>NH3,故沸点:H2O>HF>NH3,C正确;
D.W单质(Li)在空气中燃烧的产物是W2O(Li2O),D错误;
答案选C。
6.A
【详解】A.温度越高反应速率越快,最先达到平衡,此反应为放热反应,升高温度,平衡左移,C的百分含量减小,图象符合实际,故A正确;
B.增大压强,各物质的浓度增大,正逆反应速率均加快,不会出现正反应速率加快而逆反应速率减慢的情况,故B错误;
C.催化剂只是改变反应的速率,不影响平衡移动,加入催化剂,反应速率加快,所用时间缩短,但是C的浓度应该不变,故C错误;
D.此反应为放热反应,升高温度,平衡左移,B的体积分数增大,而题给图象B的体积分数随温度升高而减小;增大压强,平衡右移,B的体积分数减小,而题给图象是增大,均和实际不符,故D错误;
故选A。
7.B
【详解】A.金属腐蚀普遍属于电化学腐蚀,A错误;
B.牺牲阳极的阴极保护法是将被保护的金属作原电池的正极,因此是利用原电池的原理防止腐蚀,B正确;
C.外加电流的阴极保护法是将被保护的金属与电源负极相连,作阴极被保护,C错误;
D.钢铁在潮湿空气中的腐蚀大多数为吸氧腐蚀,只有在酸性较强时才发生析氢腐蚀,D错误;答案选B。
8.B
【分析】A. 铁与稀硫酸反应生成硫酸亚铁和氢气。
B. 铁片与氯化铜溶液反应生成氯化亚铁和铜。
C. 氢氧化镁与盐酸反应生成氯化镁和水。
D. Ba(OH)2溶液与稀H2SO4反应生成硫酸钡和水。
【详解】A.铁与稀硫酸反应离子方程式:Fe +2H+ = Fe2+ +H2↑,A错误。
B.铁片与氯化铜溶液反应离子方程式:Fe +Cu2+ = Cu +Fe2+,B正确。
C.氢氧化镁溶于盐酸离子方程式:Mg(OH)2+2H+ = Mg2+ +2H2O,C错误。
D. Ba(OH)2溶液与稀H2SO4反应离子方程式:Ba2+ + 2OH- + 2H+ +SO42- = 2H2O+BaSO4↓,D错误。
【点睛】离子方程式书写除了要考虑客观事实、质量守恒、电荷守恒、不能拆成离子的沉淀弱电解质等,还要考虑反应时各物质中离子的数量比值。
9.D
【详解】A. 用生产甲醇,有利于减排,故A正确;
B. 根据质量守恒知反应生成甲醇和水,故B正确;
C. 与合成甲醇,甲醇在燃烧后产生二氧化碳,所以有利于碳资源循环利用,故C正确;
D. 催化剂只能加快反应速率,对的平衡转化率没有影响,故D错误;
答案选D。
10.D
【详解】A.由水电离的c(H+)=1×10﹣11mol L﹣1的溶液中存在大量的H+或OH﹣,Mg2+、离子与氢氧根离子反应,离子与氢离子反应,在溶液中一定不能大量共存,故A错误;
B.在含大量的溶液中,与不能大量共存,故B错误;
C.加入铝粉产生H2的溶液中存在大量的H+或OH﹣,Al3+、与氢氧根离子反应,与氢离子反应,且与会发生强烈双水解,在溶液中一定不能大量共存,故C错误;
D.的溶液中存在大量氢氧根离子,所给离子组都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D。
11.B
【详解】A项、同主族元素自上而下,离子半径依次增大,则离子半径的大小顺序为Li+
【点睛】本题考查元素周期律,侧重于分析能力的考查,注意把握周期律的内涵及应用,明确元素金属性和非金属性强弱的比较方法是解答关键。
12.BD
【详解】把3molP和2.5molQ置于2L密闭容器中,5min后达到平衡,生成1mol N,则:
3P(g)+Q(g)xM(g)+2N(g)
起始量(mol):3 2.5 0 0
变化量(mol):1.5 0.5 0.25x 1
平衡量(mol):1.5 2 0.25x 1
A.=0.15mol/(Lmin),故A正确;
B.Q转化率=×100%=20%,故B错误;
C.Q的平衡浓度为=1mol/L,故C正确;
D.根据M的速率,则0.25x=0.1mol/(Lmin)×5min×2L,解得x=4,故D错误;
故选BD。
【点评】本题考查化学平衡计算,理解掌握三段式在化学平衡计算中应用,比较基础。
13.D
【详解】平衡时c(HI)=5mol L-1,HI分解生成的H2的浓度为0.25mol L-1.
NH4I分解生成的HI的浓度为5mol L-1+2×0.25mol L-1=5.5mol L-1,所以NH4I分解生成的NH3的浓度为5.5mol L-1, 所以反应①的平衡常数k=c(NH3) c(HI)=5.5mol L-1×5mol L-1=27.5mol L-1。答案选D。
14.D
【详解】A.沉淀池中发生的反应的反应物是氯化钠、氨气、二氧化碳和水,所以含有钠、氯、氮、氢、碳、氧六种元素,故A错误;
B.过滤得到的“母液”中含有的溶质有碳酸氢钠、氯化铵,还有可能含有过量的氯化钠,故B错误;
C.碳酸氢钠分解生成碳酸钠、水、二氧化碳,所以X是二氧化碳,故C错误;
D.氨气的水溶液显碱性,能更好的吸收二氧化碳,使反应物浓度大,反应速度快,故D正确;
故答案为D。
15.AC
【详解】A.图甲中碳棒为负极,电解质溶液中Fe3+发生还原反应生成Fe2+,Cu棒为正极,电解质溶液中Cu2+发生还原反应生成Cu,总反应为,故A正确;
B.图乙中制取时,Fe应与电源正极相连作阳极,故B错误;
C.图丙中铁如果发生吸氧腐蚀,则右侧导管中能形成一段稳定高于试管内液面的液柱,故C正确;
D.由于氧化性:Fe2+>Zn2+,因此无法实现镀锌,故D错误;
综上所述,答案为AC。
16.(1)M
(2)或
(3) 高 分子间存在氢键
(4) 平面三角形 16
(5) (,,)
【解析】(1)
已知磷是15号元素,基态磷原子的核外电子排布式为:1s22s22p63s23p3,故基态磷原子中,电子占据的最高能层符号为M,故答案为:M;
(2)
已知As是33号元素,故基态As原子的核外电子排布式为或,故答案为:或;
(3)
由于NH3中存在分子间氢键,而PH3分子间不存在氢键,故导致氮元素的简单气态氢化物为的沸点比的高,故答案为:高;分子间存在氢键;
(4)
氮元素的常见含氧酸根为NO,NO中心原子N原子周围的价层电子对数为:3+(5+1-3×2)=3,根据价层电子对互斥理论可知其空间构型为平面三角形,根据杂化轨道理论可知, N的杂化方式为sp2,NO和可形成配离子,该配离子中各元素即N、O、Co,根据第一电离能同一周期从左往右呈增大趋势,IIA与IIIA、VA与VIA反常,金属的第一电离能一般小于非金属,故第一电离能由小到大的顺序为,已知单键、双键、三键均只有一个键,故1个NO含有3个NO,另外4个NO与Co2+之间形成4个配位键即4个键,1mol该配离子中含有的键数目为1mol×(4×3+4)×NAmol-1=16NA,故答案为:平面三角形;sp2;;16;
(5)
①由晶胞图结合A、B的坐标可知,C点与晶胞顶点连线处于晶胞体对角线上,且二者距离等于晶胞体对角线长度的,故C点到左侧面、前平面、下底面的距离分别为晶胞棱长的、、,故C点的原子坐标为(,,),故答案为:(,,);
③晶胞中,Al原子数目为4,P原子数目为8×+6×=4,晶胞质量=4×g,磷化铝的晶胞参数a=546.35pm,其密度=4×g,÷(546.35×10-10 cm)3= g/cm3,故答案为:。
17.(1)100mL容量瓶和胶头滴管
(2) 酸式 当滴入最后半滴高锰酸钾标准溶液时,溶液颜色由无色变为浅紫红色,且摇动半分钟颜色不褪去
(3)CE
(4)4.5×10-7
(5) Fe3++3H2OFe(OH)3(胶体)+3H+ SnCl2+H2OSn(OH)Cl+HCl CuO或Cu(OH)2 Al2O3
【分析】NaNO2中的N元素为+3价,有还原性,可以被酸性高锰酸钾溶液氧化。
【详解】(1)配制一定体积的溶液,需要用一定规格的容量瓶,还需要用胶头滴管定容,所以需要的玻璃仪器除了烧杯和玻璃棒之外,还需要100mL容量瓶和胶头滴管。
(2)高锰酸钾溶液有强氧化性,会腐蚀橡胶,应装在酸式滴定管中。向无色的NaNO2溶液中滴加紫色的酸性高锰酸钾溶液,当滴入最后半滴高锰酸钾标准溶液时,溶液颜色由无色变为浅紫红色,且摇动半分钟颜色不褪去,即达到了滴定终点。
(3)NaNO2的含量和所用的高锰酸钾溶液的体积成正比。
A.锥形瓶不用润洗,若用待测液润洗,会造成所用高锰酸钾溶液体积偏大,NaNO2含量偏高,锥形瓶没有润洗,对结果没有影响,故A不选;
B.若滴定过程中刚出现颜色变化就停止滴定,则滴入的高锰酸钾溶液体积偏小,NaNO2含量偏低,故B不选;
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失,读取的高锰酸钾溶液体积偏大,计算出的NaNO2含量偏高,故C选;
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数,读取的高锰酸钾溶液体积偏小,计算出的NaNO2含量偏低,故D不选;
E.滴定管未用 KMnO4标准溶液润洗,则所用的高锰酸钾溶液体积偏大,计算出的NaNO2含量偏高,故E选;
故选CE。
(4)由于Ksp(AgI)<Ksp(AgCl),所以当AgCl开始沉淀时,AgI已经沉淀完全,溶液中存在着AgCl和AgI的溶解平衡,所以=4.5×10-7。
(5)硫酸铁在水中电离的Fe3+水解生成氢氧化铁胶体,胶体具有吸附性,能净水,Fe3+水解的离子方程式为Fe3++3H2OFe(OH)3(胶体)+3H+;SnCl2水解成碱式氯化亚锡的化学方程式为SnCl2+H2OSn(OH)Cl+HCl;要除去 CuCl2溶液中 FeCl3,可以向溶液中加入CuO或Cu(OH)2,和溶液中的H+反应,使溶液的pH增大,促进Fe3+的水解,使Fe3+水解为Fe(OH)3沉淀而除去;AlCl3溶液中存在着AlCl3的水解:AlCl3+3H2OAl(OH)3+3HCl,将 AlCl3溶液加热,促进AlCl3的水解,同时生成的HCl挥发,从而使水解平衡正向移动,所以蒸干并灼烧所得固体为Al(OH)3分解生成的Al2O3。
18. △H2+△H3 FeO和Fe 80% bd 37.1% T3>T2>T1 正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率升高
【详解】(1)已知反应:Fe2O3(s)+CO(g)═Fe3O4(s)+CO2(g)△H2② Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3 ③,根据盖斯定律,将所给的反应②+③×可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故△H4=△H2+△H3 ,故答案为△H2+△H3 ;
(2)根据当1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:=,即可求的x:y=1:4,故剩余的FeO和被还原为铁的FeO的物质的量之比为1:4,则可知被还原的FeO的百分比为×100%=80%,故答案为FeO和Fe;80%;
(3)①a.由于此容器是个体积可变的容器,故为恒容的容器,则容器内压强一直不变,故不能作为反应达平衡的标志,故a错误;b.此反应在平衡前,气体的质量不变,但体积变小,故密度变大,故当混合气体的密度不再发生变化时能说明反应达平衡,故b正确;c.反应达平衡的根本标志是v正=v逆,所以3v正(CO)=v逆(H2),故c错误;d.在反应达平衡之前,混合气体的质量不变,但物质的量变小,故混合气体的平均相对分子质量在变小,故当不变时能说明反应达平衡,故d正确。故选bd;
②设反应达平衡时CO转化了xmol,则根据三段式可知:
CO(g) + 3H2(g)CH4(g)+H2O(g)
初始(n): 1mol 3mol 0 0
△n: xmol 3xmol xmol xmol
平衡(n): (1-x)mol (3-3x)mol xmol xmol
结合平衡时CO的体积分数为0.193可知:=0.193,解得x=0.371,故达到平衡时CO的转化率为=×100%=37.1%;在T℃106Pa时该反应的压强平衡常数Kp==,故答案为37.1%;;
③反应CO(g)+3H2(g)CH4(g)+H2O(g)△H<0,温度越高,则平衡左移,CO的平衡转化率越低,根据图象可知,温度T3>T2>T1,故答案为T3>T2>T1;正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高。
19.(1)416
(2) 异丁烷 9 kJ·mol-1
(3) 增大 反应I 是气体体积增大的反应,总压恒定时,通入N2会降低反应I的分压,使反应I正向进行程度增大
(4) i CH2 =C(CH3)2 …S→CH2 =C(CH3)2(g)+ S
【解析】(1)
反应I中断裂2 molC- H键、形成1 mol碳碳π键和1 mol H一H键,故2E(C-H)- E(碳碳π键)-E(H- H)=+122 kJ·mol-1,解得E(C-H)=416 kJ·mol-1。
(2)
反应I为吸热反应,故与正丁烷相比,异丁烷能量更低,稳定性更高;反应II为吸热反应,正活化能大于逆活化能,二者的差值刚好为ΔH2即9 kJ·mol-1。
(3)
①由压强恒定为p0 kPa,达到平衡时,H2的分压为a kPa,正丁烷的分压为b kPa可知,平衡时,异丁烯的分压为a kPa,异丁烷的分压为p0kPa-a kPa-a kPa-b kPa=(p0-2a-b) kPa,将相关数据代入Kp表达式计算可得Kp= kPa。
②若其他条件不变,平衡后再通入少量N2,则对反应I相当于减压,由于反应I正反应气体体积增大,故反应I正向进行程度会增大,异丁烯的平衡产率增大。
(4)
由反应机理可知,反应i表示的是异丁烷在催化剂上的吸附过程;由总反应及反应机理可知反应iii表示的是异丁烯在催化剂上的脱附过程,化学方程式为CH2 =C(CH3)2 …S→CH2 =C(CH3)2(g)+ S。
20.(1)2×10-5
(2) PbSO4+2NH4HCO3=PbCO3+(NH4)2SO4+H2O+CO2↑ 醋酸易与碳酸氢铵反应,降低了碳酸氢铵的量
(3) 4.6×10-7 硝酸 坩埚钳、泥三角
(4)B
【分析】一种从铋冶炼浸渣(浸渣中的铅多数以硫酸铅的形态存在,少量以氧化铅、碳酸铅的形态存在)加碳酸氢铵,PbSO4+2NH4HCO3=PbCO3+(NH4)2SO4+H2O+CO2↑,过滤后滤渣用硝酸酸溶,再加硫酸得到PbSO4,过滤得滤渣,加NaOH溶液在50-60℃合成,过滤、洗涤、干燥得三盐基硫酸铅()。
【详解】(1)在NH4HCO3溶液中,反应NH +HCO+H2O NH3 H2O+H2CO3的平衡常数K===1.25×10-3,常温下,的电离平衡常数2×10-5。故答案为:2×10-5;
(2)转化过程转化为更难溶的PbCO3,发生反应的化学方程式PbSO4+2NH4HCO3=PbCO3+(NH4)2SO4+H2O+CO2↑,Pb的转化率随着用量的增加而增加,醋酸可以促进硫酸铅溶解,但实验表明:Pb的转化率随醋酸用量的增加而减少,这是由于醋酸易与碳酸氢铵反应,降低了碳酸氢铵的量。故答案为:PbSO4+2NH4HCO3=PbCO3+(NH4)2SO4+H2O+CO2↑;醋酸易与碳酸氢铵反应,降低了碳酸氢铵的量;
(3)测得滤液1中,PbSO4+CO PbCO3+SO, ,则该滤液中4.6×10-7;滤液2中可以循环利用的物质是硝酸;加热固体要在坩埚中进行,从滤液3可提取出一种含结晶水的钠盐副产品,若测定该晶体中结晶水的含量,所需的仪器除三脚架、托盘天平、瓷坩埚、干燥器、酒精灯、玻璃棒,还需要的仪器有坩埚钳、泥三角。故答案为:4.6×10-7;硝酸;坩埚钳、泥三角;
(4)三盐基硫酸铅中PbO理论含量90.10%,理论含量8.08%),结合图形分析反应终点控制pH的范围是8.4~8.8,则反应终点控制pH的范围是B。故答案为:B。
同课章节目录
