第五章 第一节 硫及其化合物 第一课时 硫单质 课件(共16张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章 第一节 硫及其化合物 第一课时 硫单质 课件(共16张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 14:39:32 | ||
图片预览





文档简介
(共16张PPT)
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第1课时 硫
印尼伊真火山
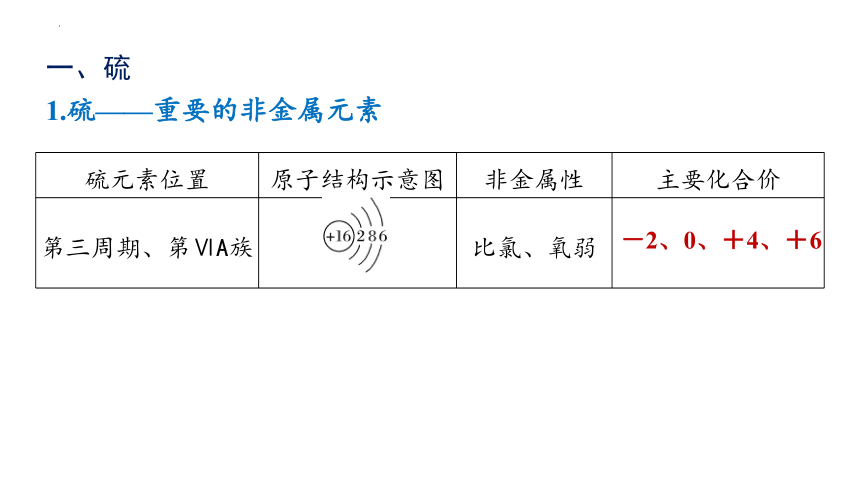
一、硫
硫元素位置 原子结构示意图 非金属性 主要化合价
第三周期、第ⅥA族 比氯、氧弱
1.硫——重要的非金属元素
-2、0、+4、+6
2.硫的性质
(1)物理性质
单质硫(俗称 ),是一种 晶体,质脆,易研成粉末。
溶于水, 于酒精, 溶于 (CS2)。
硫黄
黄色
难
微溶
易
二硫化碳
硫磺
硫在水中的硫结晶
熔点:113℃
沸点:445℃
密度:2.06 g/cm3
(2)化学性质
①与非金属单质反应
△
H2+S === H2S(臭鸡蛋气味)
△
S+O2 === SO2 (空气:淡蓝色火焰;纯氧:深蓝色火焰)
注意:硫与氧气在点燃的情况下生成SO2,不生成SO3
②与金属单质反应得到金属硫化物
△
Fe + S === FeS(硫化亚铁)
2Cu + S === Cu2S (硫化亚铜)
2Na + S === Na2S
Mg + S === MgS
2Al + 3S === Al2S3
2Ag+ S === Ag2S
… …
△
注意:因为硫的氧化性较弱,所以硫与变价金属反应通常不能反应到最高价
△
△
△
△
硫化亚铁
硫化亚铜
硫化镁
硫化钠
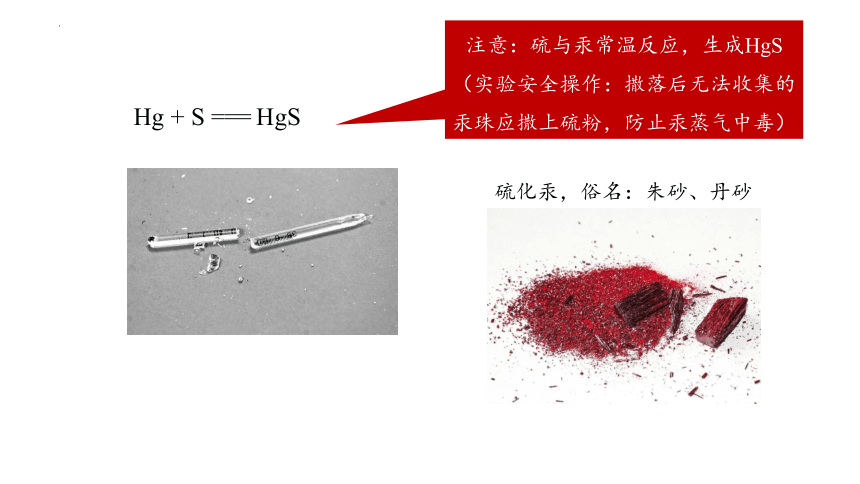
Hg + S === HgS
注意:硫与汞常温反应,生成HgS(实验安全操作:撒落后无法收集的汞珠应撒上硫粉,防止汞蒸气中毒)
硫化汞,俗名:朱砂、丹砂
中华文化源远流长、博大精深,下列传统文化中蕴含的化学知识或原理不正确的是
A.《肘后备急方》中记载:“青蒿一握,以水二升渍,绞取汁,尽服之……”,提取青蒿素属于化学变化
B.《梦溪笔谈》中:“石穴中水,所滴者皆为钟乳”,该现象未涉及氧化还原反应
C.《抱朴子·金丹篇》记载:“凡草木烧之即烬,而丹砂(硫化汞)烧之成水银,积变又还成丹砂”,该过程涉及的反应都是氧化还原反应
D.《梦溪笔谈》中“方家以磁石磨针锋,则能指南”中的磁石主要成分为
√
氧化还原角度分析:
(1)高价态的含硫物质要实现向低价态含硫物质转化,一定发生还原反应( )
(2)要洗涤试管壁上附着的硫单质,不能用水洗 ,可以用酒精洗涤( )
(3)硫和铁、铜在加热条件下生成Fe2S3和CuS( )
(4)单质硫在纯氧中燃烧,其氧化产物为SO3( )
(5)硫是一种非金属单质,与其他单质反应,只能作氧化剂( )
√
×
×
×
×
判断正误
1.实验室洗涤试管壁上附着的硫单质,常用两种方法。
(1)物理方法:用CS2洗涤,利用单质硫的性质为____________________。
(2)化学方法:用热的NaOH溶液洗涤,该反应原理为
3S + 6NaOH === 2Na2S + Na2SO3 + 3H2O,
在该反应中,硫单质表现________性和________性,
氧化剂和还原剂的物质的量之比为__________,
写出上述反应的离子方程式: 。
2∶1
还原
氧化
易溶于CS2
△
3S+6OH- === 2S2-+SO32-+3H2O
△
应用体验
(3)向上述反应的溶液中再加入适量的稀H2SO4,会产生淡黄色沉淀,写出该反应的离子方程式:__________________________________________________。
(4)由第(2)(3)问我们可看出S2-与SO32-在_____性条件下可共存,在_____性条件下可反应,不能共存。
碱
酸
2S2-+ SO32- +6H+ === 3S↓+3H2O
③跟其他物质反应
S与碱反应:
化:3S+6KOH === 2K2S+K2SO3+3H2O
S与强氧化剂反应:
3S+2H2SO4(浓) === 3SO2↑+2H2O
△
离:3S+6OH-=== 2S2-+SO32-+3H2O
(2)化学性质
△
△
2.下列化合物能用相应的单质直接化合制得的是______(填序号)。
①CuS ②FeS ③HCl ④SO2 ⑤SO3
⑥FeCl2 ⑦CuCl2 ⑧Cu2S ⑨HgS ⑩Ag2S
答案 ②③④⑦⑧⑨⑩
(1)从物质类别和元素化合价角度理解硫的化学性质:
(2)硫在一定条件下与大多数金属反应生成相应的金属硫化物,与变价金属反应生成其低价金属硫化物。
(3)硫与氧气反应,不论氧气是否足量、浓度如何,其一步反应都只能生成SO2,不能生成SO3。
归纳应用
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第1课时 硫
印尼伊真火山
一、硫
硫元素位置 原子结构示意图 非金属性 主要化合价
第三周期、第ⅥA族 比氯、氧弱
1.硫——重要的非金属元素
-2、0、+4、+6
2.硫的性质
(1)物理性质
单质硫(俗称 ),是一种 晶体,质脆,易研成粉末。
溶于水, 于酒精, 溶于 (CS2)。
硫黄
黄色
难
微溶
易
二硫化碳
硫磺
硫在水中的硫结晶
熔点:113℃
沸点:445℃
密度:2.06 g/cm3
(2)化学性质
①与非金属单质反应
△
H2+S === H2S(臭鸡蛋气味)
△
S+O2 === SO2 (空气:淡蓝色火焰;纯氧:深蓝色火焰)
注意:硫与氧气在点燃的情况下生成SO2,不生成SO3
②与金属单质反应得到金属硫化物
△
Fe + S === FeS(硫化亚铁)
2Cu + S === Cu2S (硫化亚铜)
2Na + S === Na2S
Mg + S === MgS
2Al + 3S === Al2S3
2Ag+ S === Ag2S
… …
△
注意:因为硫的氧化性较弱,所以硫与变价金属反应通常不能反应到最高价
△
△
△
△
硫化亚铁
硫化亚铜
硫化镁
硫化钠
Hg + S === HgS
注意:硫与汞常温反应,生成HgS(实验安全操作:撒落后无法收集的汞珠应撒上硫粉,防止汞蒸气中毒)
硫化汞,俗名:朱砂、丹砂
中华文化源远流长、博大精深,下列传统文化中蕴含的化学知识或原理不正确的是
A.《肘后备急方》中记载:“青蒿一握,以水二升渍,绞取汁,尽服之……”,提取青蒿素属于化学变化
B.《梦溪笔谈》中:“石穴中水,所滴者皆为钟乳”,该现象未涉及氧化还原反应
C.《抱朴子·金丹篇》记载:“凡草木烧之即烬,而丹砂(硫化汞)烧之成水银,积变又还成丹砂”,该过程涉及的反应都是氧化还原反应
D.《梦溪笔谈》中“方家以磁石磨针锋,则能指南”中的磁石主要成分为
√
氧化还原角度分析:
(1)高价态的含硫物质要实现向低价态含硫物质转化,一定发生还原反应( )
(2)要洗涤试管壁上附着的硫单质,不能用水洗 ,可以用酒精洗涤( )
(3)硫和铁、铜在加热条件下生成Fe2S3和CuS( )
(4)单质硫在纯氧中燃烧,其氧化产物为SO3( )
(5)硫是一种非金属单质,与其他单质反应,只能作氧化剂( )
√
×
×
×
×
判断正误
1.实验室洗涤试管壁上附着的硫单质,常用两种方法。
(1)物理方法:用CS2洗涤,利用单质硫的性质为____________________。
(2)化学方法:用热的NaOH溶液洗涤,该反应原理为
3S + 6NaOH === 2Na2S + Na2SO3 + 3H2O,
在该反应中,硫单质表现________性和________性,
氧化剂和还原剂的物质的量之比为__________,
写出上述反应的离子方程式: 。
2∶1
还原
氧化
易溶于CS2
△
3S+6OH- === 2S2-+SO32-+3H2O
△
应用体验
(3)向上述反应的溶液中再加入适量的稀H2SO4,会产生淡黄色沉淀,写出该反应的离子方程式:__________________________________________________。
(4)由第(2)(3)问我们可看出S2-与SO32-在_____性条件下可共存,在_____性条件下可反应,不能共存。
碱
酸
2S2-+ SO32- +6H+ === 3S↓+3H2O
③跟其他物质反应
S与碱反应:
化:3S+6KOH === 2K2S+K2SO3+3H2O
S与强氧化剂反应:
3S+2H2SO4(浓) === 3SO2↑+2H2O
△
离:3S+6OH-=== 2S2-+SO32-+3H2O
(2)化学性质
△
△
2.下列化合物能用相应的单质直接化合制得的是______(填序号)。
①CuS ②FeS ③HCl ④SO2 ⑤SO3
⑥FeCl2 ⑦CuCl2 ⑧Cu2S ⑨HgS ⑩Ag2S
答案 ②③④⑦⑧⑨⑩
(1)从物质类别和元素化合价角度理解硫的化学性质:
(2)硫在一定条件下与大多数金属反应生成相应的金属硫化物,与变价金属反应生成其低价金属硫化物。
(3)硫与氧气反应,不论氧气是否足量、浓度如何,其一步反应都只能生成SO2,不能生成SO3。
归纳应用
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
