第一节 化学反应速率2.1.2课件(共25张PPT)
文档属性
| 名称 | 第一节 化学反应速率2.1.2课件(共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
课时2
影响化学反应速率的因素
第一节 化学反应速率
01
学习目标
CONTENT
影响化学反应速率的因素
02
化学反应速率的应用
影响化学反应速率的因素
影响化学反应速率的因素
1.内因
2.外因
浓度
压强
温度
催化剂
其它
物质本身的结构和性质
(主要)
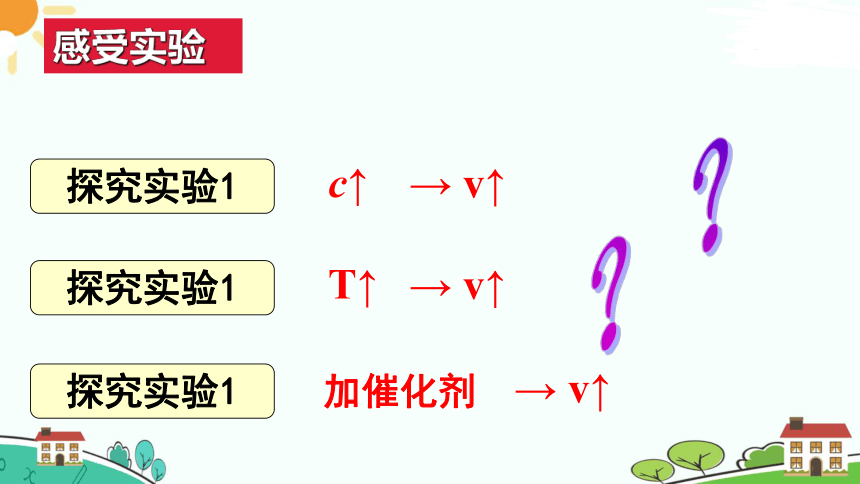
感受实验
探究实验1
探究实验1
探究实验1
→ v↑
c↑
→ v↑
T↑
→ v↑
加催化剂
??
一、浓度对反应速率的影响
应用举例
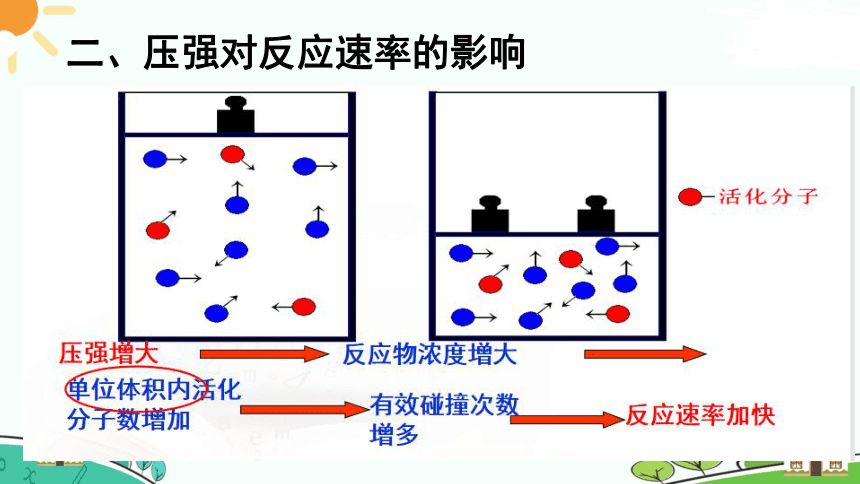
二、压强对反应速率的影响
如果反应物是固体、液体或溶液时,改变压强对它们又有什么影响?
无影响
思考与讨论
应用举例
应用举例
三、温度对反应速率的影响
【原因】温度升高
(1)分子获得能量,活化分子百分数提高;
(2)分子热运动加快,碰撞频率提高。
思考与讨论
应用举例
四、催化剂对反应速率的影响
科学探究
1、Fe3+、Cu2+对H2O2的分解都有催化作用,但Cu2+催化作用强。
2、Mn2+是该反应的催化剂。
3、硫酸溶液比唾液对淀粉水解的催化效果弱。
应用举例
影响化学速率的外因
应用8:
1.增大反应物的浓度使反应速率加快的主要原因( )
2.对于气体参与体系增大压强使反应速率加快的主要
原因是( )
3.升高温度使反应速率加快的主要原因是( )
A
A
C
应用举例
1.下列说法正确的是
A、一定条件下,增大反应物的量会加快化
学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
√
课堂练习
课堂练习
2、一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的
A、Na2CO3晶体
B、NaOH晶体
C、水
D、CH3COONa晶体
√
√
课堂练习
3.在C(固)+CO2(气)=2CO(气) 的反应中。现采取下列措施:
(1)增大压强 ;(2)增加碳的量
(3)通入CO2;(4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么?
答案:(1)(3)
课堂练习
4、对于反应M+N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为
A.2min B.3min C.6min D.9min
√
课堂练习
5、下列条件一定能使反应速率加快的是:①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A、全部
B、 ① ② ⑤
C、 ②
D、 ② ③
√
课堂练习
课时2
影响化学反应速率的因素
第一节 化学反应速率
01
学习目标
CONTENT
影响化学反应速率的因素
02
化学反应速率的应用
影响化学反应速率的因素
影响化学反应速率的因素
1.内因
2.外因
浓度
压强
温度
催化剂
其它
物质本身的结构和性质
(主要)
感受实验
探究实验1
探究实验1
探究实验1
→ v↑
c↑
→ v↑
T↑
→ v↑
加催化剂
??
一、浓度对反应速率的影响
应用举例
二、压强对反应速率的影响
如果反应物是固体、液体或溶液时,改变压强对它们又有什么影响?
无影响
思考与讨论
应用举例
应用举例
三、温度对反应速率的影响
【原因】温度升高
(1)分子获得能量,活化分子百分数提高;
(2)分子热运动加快,碰撞频率提高。
思考与讨论
应用举例
四、催化剂对反应速率的影响
科学探究
1、Fe3+、Cu2+对H2O2的分解都有催化作用,但Cu2+催化作用强。
2、Mn2+是该反应的催化剂。
3、硫酸溶液比唾液对淀粉水解的催化效果弱。
应用举例
影响化学速率的外因
应用8:
1.增大反应物的浓度使反应速率加快的主要原因( )
2.对于气体参与体系增大压强使反应速率加快的主要
原因是( )
3.升高温度使反应速率加快的主要原因是( )
A
A
C
应用举例
1.下列说法正确的是
A、一定条件下,增大反应物的量会加快化
学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
√
课堂练习
课堂练习
2、一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的
A、Na2CO3晶体
B、NaOH晶体
C、水
D、CH3COONa晶体
√
√
课堂练习
3.在C(固)+CO2(气)=2CO(气) 的反应中。现采取下列措施:
(1)增大压强 ;(2)增加碳的量
(3)通入CO2;(4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么?
答案:(1)(3)
课堂练习
4、对于反应M+N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为
A.2min B.3min C.6min D.9min
√
课堂练习
5、下列条件一定能使反应速率加快的是:①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A、全部
B、 ① ② ⑤
C、 ②
D、 ② ③
√
课堂练习
