第五章 第三节 第一课时 传统无机非金属材料 课件(共32张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章 第三节 第一课时 传统无机非金属材料 课件(共32张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 122.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 00:00:00 | ||
图片预览









文档简介
(共32张PPT)
无机非金属材料
二氧化硅
硅酸
硅酸盐
硅单质
1
2
3
4
材料是人类赖以生存和发展的物质基础,人类使用材料除了金属材料,还有无机非金属材料等。
从组成上看,许多无机非金属材料(如水泥、玻璃、陶瓷)含有硅、氧等元素,具有耐高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。
随着工业生产和社会发展对材料性能要求的提高,一批新型无机非金属材料相继诞生,成为航空、航天、信息和新能源等高技术领域必需的材料。(如石墨烯、碳纤维等)
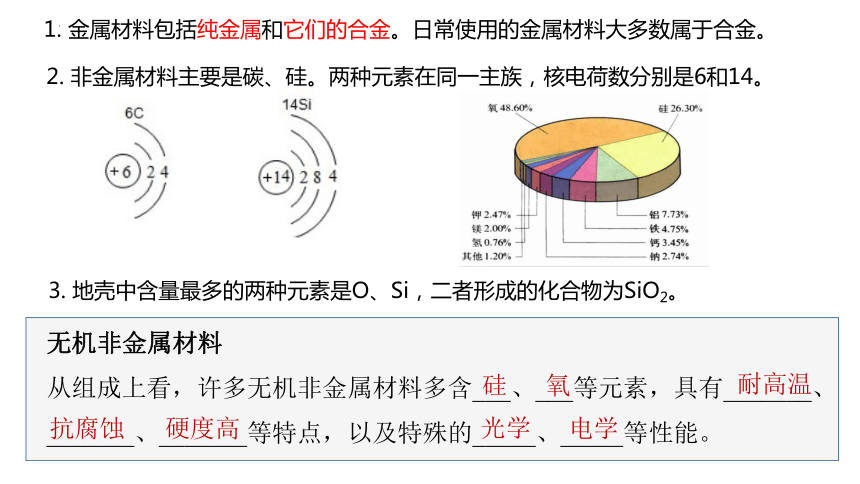
1. 金属材料包括纯金属和它们的合金。日常使用的金属材料大多数属于合金。
2. 非金属材料主要是碳、硅。两种元素在同一主族,核电荷数分别是6和14。
3. 地壳中含量最多的两种元素是O、Si,二者形成的化合物为SiO2。
无机非金属材料
从组成上看,许多无机非金属材料多含___、___等元素,具有_______、_______、_______等特点,以及特殊的_____、_____等性能。
硅
氧
耐高温
抗腐蚀
硬度高
光学
电学
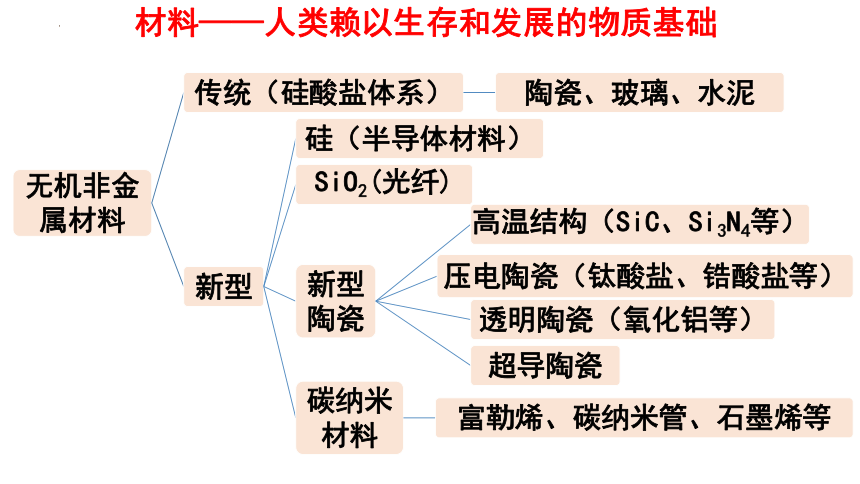
材料——人类赖以生存和发展的物质基础
01
传统无机非金属材料
普通玻璃 Na2CaSi6O14
石棉 Mg3CaSi4O12
黏土 Al2Si2H4O9
长石 K2Al2Si6O16
一、硅酸盐概述
硅酸盐是由硅、氧和金属元素组成的化合物的总称。硅酸盐是一类结构复杂的物质,一般都不溶于水,化学性质很稳定。
1、硅酸盐的表示方法:
如:硅酸钠:Na2SiO3 硅酸钙:CaSiO3
用二氧化硅和金属氧化物的形式来表示其组成
(1)化学式法(表示组成简单的硅酸盐):
(2)氧化物法(表示复杂的硅酸盐):
如:硅酸钠:Na2O · SiO2
硅酸钙: CaO · SiO2
各元素原子总个数比符合原来的组成
分数化整
金属氧化物 · 二氧化硅 · 水
按金属活动顺序表依次排列
书写原则
Al2O3·2SiO2·2H2O
KAlSi3O8:
CaMg3Si4O12:
CaO·3MgO·4SiO2
Al2(Si2O5)(OH)4:
K2O·Al2O3·6SiO2
硅酸盐结构
Si 和 O 构成了硅氧四面体
每个 Si 结合 4 个 O, Si 在中心,O 在四面体的 4 个顶角
许多四面体通过顶角的O相互连接
每个 O 为两个四面体所共有,与 2 个 Si 相结合
大多硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等
硅酸盐性质
有例外:Na2SiO3
一、硅酸盐概述
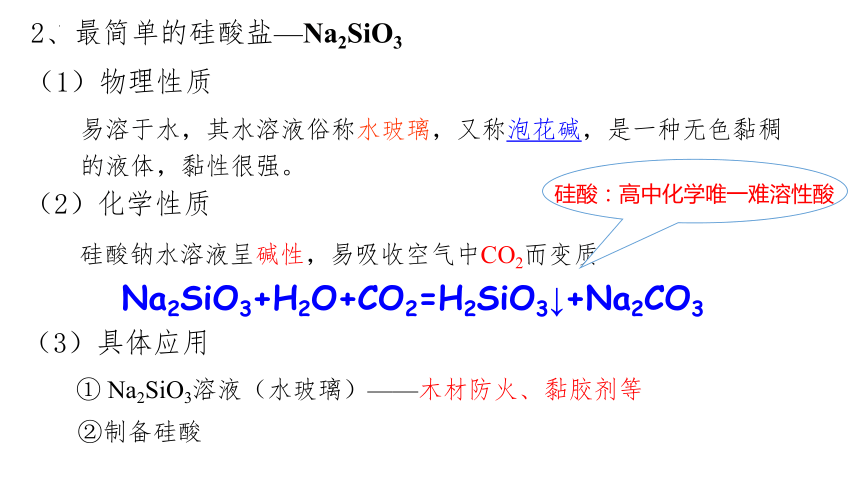
硅酸钠水溶液呈碱性,易吸收空气中CO2而变质
Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3
① Na2SiO3溶液(水玻璃)——木材防火、黏胶剂等
②制备硅酸
(1)物理性质
易溶于水,其水溶液俗称水玻璃,又称泡花碱,是一种无色黏稠的液体,黏性很强。
2、最简单的硅酸盐—Na2SiO3
(2)化学性质
(3)具体应用
硅酸:高中化学唯一难溶性酸
3、传统的三大硅酸盐产品
(1)陶瓷
(2)水泥
(3)玻璃
使用量最大的
无机非金属材料
玻璃、水泥、陶瓷生产的共同点:
都在高温下,发生了复杂的物理和化学变化。原料都有含硅元素的物质,产品都含有硅酸盐,且都是混合物。
陶
器
陶瓷
原料
性质
黏土 (主要成分为含水的铝硅酸盐)
抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点
生产建筑材料、
绝缘材料、
日用器皿、
卫生洁具等
应用
3、传统的三大硅酸盐产品
水泥
原料
设备
万丈高楼平地起,穿针引线是水泥
黏土、石灰石(再加入少量石膏)
水泥回转窑
作用:调节水泥硬化速率
3、传统的三大硅酸盐产品
(1)水泥具有吸水性,在空气中吸水发生复杂的物理、化学变化而失去了原有的性质,因而变硬的水泥不能使用(水硬性)
(2)水泥不能抗酸的腐蚀是因为水泥的成分中有碳酸盐,碳酸盐与酸反应会放出CO2。
世界第一大坝——长江三峡大坝使用水泥将达1.082×1010kg
玻璃
原料
设备
原理
纯碱、石灰石和石英砂
玻璃窑
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
Na2SiO3 、CaSiO3、SiO2
成分
沙与火的猝练
3、传统的三大硅酸盐产品
玻璃
原料
设备
原理
纯碱、石灰石和石英砂
玻璃窑
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
Na2SiO3 、CaSiO3、SiO2
成分
【思考】
高温条件下反应的原理是什么?
沙与火的猝练
3、传统的三大硅酸盐产品
几种常见玻璃
a.石英玻璃——成分为SiO2,以纯净的石英为主要原料制成。
b.钢化玻璃——普通玻璃在电炉中加热软化,然后急速冷却而成,机械强度是普通玻璃的4~6倍。
c.有色玻璃——普通玻璃中加入一些金属氧化物,如Cu2O:红色玻璃,CuO:蓝绿色玻璃,Co2O3:蓝色玻璃,MnO2:紫色玻璃等。
(1)硅酸盐结构较为复杂,大多难溶于水,化学性质稳定( )
(2)硅氧四面体中,硅原子与氧原子都是以共价键结合( )
(3)水泥与玻璃的共同原料是石灰石,水泥与陶瓷的共同原料是黏土( )
(4)陶瓷、玻璃、水泥的生产都需要在高温下进行( )
(5)玻璃和水泥生产中都发生复杂的物理和化学变化( )
正误判断
√
√
√
√
√
应用体验
1.(2022·济南高一月考)“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英砂
C.硅酸盐制品的性质稳定、耐高温
D.沙子和黏土的主要成分均为硅酸盐
√
2.世博会中国馆——“东方之冠”由钢筋混凝土、7 000多块铝板和1 200多块玻璃等建成。
(1)生产硅酸盐产品水泥和普通玻璃都需要用到的主要原料是______。制
备普通玻璃的主要反应的化学方程式为____________________________
_______________________________________。由方程式_____(填“能”
或“不能”)判断出酸性H2SiO3>H2CO3。
石灰石
CaCO3+SiO2 CaSiO3+
CO2↑、Na2CO3+SiO2 Na2SiO3+CO2↑
不能
(2)作场馆建筑材料黏合剂和防火剂的硅酸钠(俗名泡花碱)是一种最简单的硅酸盐。
①硅酸钠在空气中易与二氧化碳和水生成硅酸(H2SiO3)沉淀,其离子方程式:___________________________________。由此得出酸性:H2SiO3___(填“>”或“<”)H2CO3。
②硅酸钠和盐酸反应的离子方程式:_____________________。
<
(3)博物馆陈列着大量明清砖瓦和精美瓷器(婺州窑),婺州窑瓷器胎体的原料为高岭土[AlnSi2O5(OH)4]。下列说法正确的是______(填字母)。
A.古代的陶瓷、砖瓦都是硅酸盐产品
B.高岭土为含水的铝硅酸盐
C.n=3
D.我国在新石器时代已能烧制陶器
根据化合物中正负化合价代数和为0的原则:n×(+3)+2×(+4)+5×(-2)+4×(-1)=0,解得n=2,C错误。
ABD
返回
拓展
硅酸
硅酸(H2SiO3)的用途
1、物理性质
硅酸是一种白色粉末状的固体,它不溶于水;
2、化学性质
①是一种很弱的酸,不能使指示剂变色
(1)具有酸的通性:
②能与碱发生中和反应
H2SiO3+2NaOH===Na2SiO3+2H2O
二、硅酸(H2SiO3)
2、化学性质
二、硅酸(H2SiO3)
(2)具有不稳定性:
H2SiO3 === SiO2+2H2O
△
思考
SiO2不能直接和水化合成H2SiO3,那怎样制备H2SiO3呢?
(1)原理:强酸制弱酸
(2)现象:
①往硅酸钠溶液中滴入酚酞,溶液呈红色
②再滴入稀盐酸,溶液红色变浅至无色,有透明胶冻状物质产生
(3)结论:
a、Na2SiO3溶液呈碱性;
b、可溶性硅酸盐与盐酸反应生成不溶于水的硅酸;
c、先形成硅酸溶胶,后形成硅酸凝胶
(4)方程式:
Na2SiO3+2HCl===H2SiO3(胶体)+2NaCl
SiO32- + 2H+ ===H2SiO3 (胶体)
3、硅酸的制备(硅酸盐和盐酸)
https://www./video/BV1CZ4y1w7Ru from=search&seid=3254961970201260633&spm_id_from=333.337.0.0
如何证明酸性盐酸>碳酸>硅酸?
【思考】
A
B
C
D
A:Na2CO3/NaHCO3
B : HCl
C : 饱和NaHCO3
D : Na2SiO3
3、硅酸的制备(硅酸盐和盐酸)
硅酸钠水溶液久置在空气中会出现什么现象?为什么?
硅酸钠水溶液久置在空气中会出现白色浑浊。
SiO32-+H2O+CO2===CO32-+H2SiO3↓
Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓
思考
无机非金属材料
二氧化硅
硅酸
硅酸盐
硅单质
1
2
3
4
材料是人类赖以生存和发展的物质基础,人类使用材料除了金属材料,还有无机非金属材料等。
从组成上看,许多无机非金属材料(如水泥、玻璃、陶瓷)含有硅、氧等元素,具有耐高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。
随着工业生产和社会发展对材料性能要求的提高,一批新型无机非金属材料相继诞生,成为航空、航天、信息和新能源等高技术领域必需的材料。(如石墨烯、碳纤维等)
1. 金属材料包括纯金属和它们的合金。日常使用的金属材料大多数属于合金。
2. 非金属材料主要是碳、硅。两种元素在同一主族,核电荷数分别是6和14。
3. 地壳中含量最多的两种元素是O、Si,二者形成的化合物为SiO2。
无机非金属材料
从组成上看,许多无机非金属材料多含___、___等元素,具有_______、_______、_______等特点,以及特殊的_____、_____等性能。
硅
氧
耐高温
抗腐蚀
硬度高
光学
电学
材料——人类赖以生存和发展的物质基础
01
传统无机非金属材料
普通玻璃 Na2CaSi6O14
石棉 Mg3CaSi4O12
黏土 Al2Si2H4O9
长石 K2Al2Si6O16
一、硅酸盐概述
硅酸盐是由硅、氧和金属元素组成的化合物的总称。硅酸盐是一类结构复杂的物质,一般都不溶于水,化学性质很稳定。
1、硅酸盐的表示方法:
如:硅酸钠:Na2SiO3 硅酸钙:CaSiO3
用二氧化硅和金属氧化物的形式来表示其组成
(1)化学式法(表示组成简单的硅酸盐):
(2)氧化物法(表示复杂的硅酸盐):
如:硅酸钠:Na2O · SiO2
硅酸钙: CaO · SiO2
各元素原子总个数比符合原来的组成
分数化整
金属氧化物 · 二氧化硅 · 水
按金属活动顺序表依次排列
书写原则
Al2O3·2SiO2·2H2O
KAlSi3O8:
CaMg3Si4O12:
CaO·3MgO·4SiO2
Al2(Si2O5)(OH)4:
K2O·Al2O3·6SiO2
硅酸盐结构
Si 和 O 构成了硅氧四面体
每个 Si 结合 4 个 O, Si 在中心,O 在四面体的 4 个顶角
许多四面体通过顶角的O相互连接
每个 O 为两个四面体所共有,与 2 个 Si 相结合
大多硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等
硅酸盐性质
有例外:Na2SiO3
一、硅酸盐概述
硅酸钠水溶液呈碱性,易吸收空气中CO2而变质
Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3
① Na2SiO3溶液(水玻璃)——木材防火、黏胶剂等
②制备硅酸
(1)物理性质
易溶于水,其水溶液俗称水玻璃,又称泡花碱,是一种无色黏稠的液体,黏性很强。
2、最简单的硅酸盐—Na2SiO3
(2)化学性质
(3)具体应用
硅酸:高中化学唯一难溶性酸
3、传统的三大硅酸盐产品
(1)陶瓷
(2)水泥
(3)玻璃
使用量最大的
无机非金属材料
玻璃、水泥、陶瓷生产的共同点:
都在高温下,发生了复杂的物理和化学变化。原料都有含硅元素的物质,产品都含有硅酸盐,且都是混合物。
陶
器
陶瓷
原料
性质
黏土 (主要成分为含水的铝硅酸盐)
抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点
生产建筑材料、
绝缘材料、
日用器皿、
卫生洁具等
应用
3、传统的三大硅酸盐产品
水泥
原料
设备
万丈高楼平地起,穿针引线是水泥
黏土、石灰石(再加入少量石膏)
水泥回转窑
作用:调节水泥硬化速率
3、传统的三大硅酸盐产品
(1)水泥具有吸水性,在空气中吸水发生复杂的物理、化学变化而失去了原有的性质,因而变硬的水泥不能使用(水硬性)
(2)水泥不能抗酸的腐蚀是因为水泥的成分中有碳酸盐,碳酸盐与酸反应会放出CO2。
世界第一大坝——长江三峡大坝使用水泥将达1.082×1010kg
玻璃
原料
设备
原理
纯碱、石灰石和石英砂
玻璃窑
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
Na2SiO3 、CaSiO3、SiO2
成分
沙与火的猝练
3、传统的三大硅酸盐产品
玻璃
原料
设备
原理
纯碱、石灰石和石英砂
玻璃窑
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
Na2SiO3 、CaSiO3、SiO2
成分
【思考】
高温条件下反应的原理是什么?
沙与火的猝练
3、传统的三大硅酸盐产品
几种常见玻璃
a.石英玻璃——成分为SiO2,以纯净的石英为主要原料制成。
b.钢化玻璃——普通玻璃在电炉中加热软化,然后急速冷却而成,机械强度是普通玻璃的4~6倍。
c.有色玻璃——普通玻璃中加入一些金属氧化物,如Cu2O:红色玻璃,CuO:蓝绿色玻璃,Co2O3:蓝色玻璃,MnO2:紫色玻璃等。
(1)硅酸盐结构较为复杂,大多难溶于水,化学性质稳定( )
(2)硅氧四面体中,硅原子与氧原子都是以共价键结合( )
(3)水泥与玻璃的共同原料是石灰石,水泥与陶瓷的共同原料是黏土( )
(4)陶瓷、玻璃、水泥的生产都需要在高温下进行( )
(5)玻璃和水泥生产中都发生复杂的物理和化学变化( )
正误判断
√
√
√
√
√
应用体验
1.(2022·济南高一月考)“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英砂
C.硅酸盐制品的性质稳定、耐高温
D.沙子和黏土的主要成分均为硅酸盐
√
2.世博会中国馆——“东方之冠”由钢筋混凝土、7 000多块铝板和1 200多块玻璃等建成。
(1)生产硅酸盐产品水泥和普通玻璃都需要用到的主要原料是______。制
备普通玻璃的主要反应的化学方程式为____________________________
_______________________________________。由方程式_____(填“能”
或“不能”)判断出酸性H2SiO3>H2CO3。
石灰石
CaCO3+SiO2 CaSiO3+
CO2↑、Na2CO3+SiO2 Na2SiO3+CO2↑
不能
(2)作场馆建筑材料黏合剂和防火剂的硅酸钠(俗名泡花碱)是一种最简单的硅酸盐。
①硅酸钠在空气中易与二氧化碳和水生成硅酸(H2SiO3)沉淀,其离子方程式:___________________________________。由此得出酸性:H2SiO3___(填“>”或“<”)H2CO3。
②硅酸钠和盐酸反应的离子方程式:_____________________。
<
(3)博物馆陈列着大量明清砖瓦和精美瓷器(婺州窑),婺州窑瓷器胎体的原料为高岭土[AlnSi2O5(OH)4]。下列说法正确的是______(填字母)。
A.古代的陶瓷、砖瓦都是硅酸盐产品
B.高岭土为含水的铝硅酸盐
C.n=3
D.我国在新石器时代已能烧制陶器
根据化合物中正负化合价代数和为0的原则:n×(+3)+2×(+4)+5×(-2)+4×(-1)=0,解得n=2,C错误。
ABD
返回
拓展
硅酸
硅酸(H2SiO3)的用途
1、物理性质
硅酸是一种白色粉末状的固体,它不溶于水;
2、化学性质
①是一种很弱的酸,不能使指示剂变色
(1)具有酸的通性:
②能与碱发生中和反应
H2SiO3+2NaOH===Na2SiO3+2H2O
二、硅酸(H2SiO3)
2、化学性质
二、硅酸(H2SiO3)
(2)具有不稳定性:
H2SiO3 === SiO2+2H2O
△
思考
SiO2不能直接和水化合成H2SiO3,那怎样制备H2SiO3呢?
(1)原理:强酸制弱酸
(2)现象:
①往硅酸钠溶液中滴入酚酞,溶液呈红色
②再滴入稀盐酸,溶液红色变浅至无色,有透明胶冻状物质产生
(3)结论:
a、Na2SiO3溶液呈碱性;
b、可溶性硅酸盐与盐酸反应生成不溶于水的硅酸;
c、先形成硅酸溶胶,后形成硅酸凝胶
(4)方程式:
Na2SiO3+2HCl===H2SiO3(胶体)+2NaCl
SiO32- + 2H+ ===H2SiO3 (胶体)
3、硅酸的制备(硅酸盐和盐酸)
https://www./video/BV1CZ4y1w7Ru from=search&seid=3254961970201260633&spm_id_from=333.337.0.0
如何证明酸性盐酸>碳酸>硅酸?
【思考】
A
B
C
D
A:Na2CO3/NaHCO3
B : HCl
C : 饱和NaHCO3
D : Na2SiO3
3、硅酸的制备(硅酸盐和盐酸)
硅酸钠水溶液久置在空气中会出现什么现象?为什么?
硅酸钠水溶液久置在空气中会出现白色浑浊。
SiO32-+H2O+CO2===CO32-+H2SiO3↓
Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓
思考
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
