1.2 溶液组成的定量表示 同步练习 (含答案) 2022-2023学年鲁教版(五四制)九年级全册化学
文档属性
| 名称 | 1.2 溶液组成的定量表示 同步练习 (含答案) 2022-2023学年鲁教版(五四制)九年级全册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 67.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-27 16:54:35 | ||
图片预览


文档简介
1.2 溶液组成的定量表示 同步练习
一、单选题
1.为处理某厂排放的含氢氧化钠的碱性废液,原定用5kg14.6%的盐酸刚好处理成中性,因库存盐酸不足,换用5kg硫酸溶液处理,则所用硫酸溶液中溶质的质量分数为( )
A.14.6% B.9.8%
C.19.6% D.39.2%
2.如图是固体甲、乙的溶解度曲线图,下列说法正确的是( )
A.甲物质的溶解度大于乙物质的溶解度
B.甲、乙两物质的溶解度都随温度升高而减小
C.用冷却热饱和溶液的方法可除去混在甲中的乙物质
D.20℃时,可配制质量分数为30%的乙物质溶液
3.下表列出了部分温度下Ca(OH)2和KNO3的溶解度。下列说法正确的是( )
温度/℃ 10 30 50 60
溶解度/g Ca(OH)2 0.18 0.15 0.12 0.11
KNO3 20.9 45.8 85.5 110
A.将50℃的Ca(OH)2饱和溶液降温到10℃有晶体析出
B.30℃时KNO3的饱和溶液中溶质的质量分数为45.8%
C.50℃时不可能配制溶质质量分数相等的Ca(OH)2、KNO3溶液
D.当KNO3中混有少量Ca(OH)2时,可采用降温结晶的方法提纯
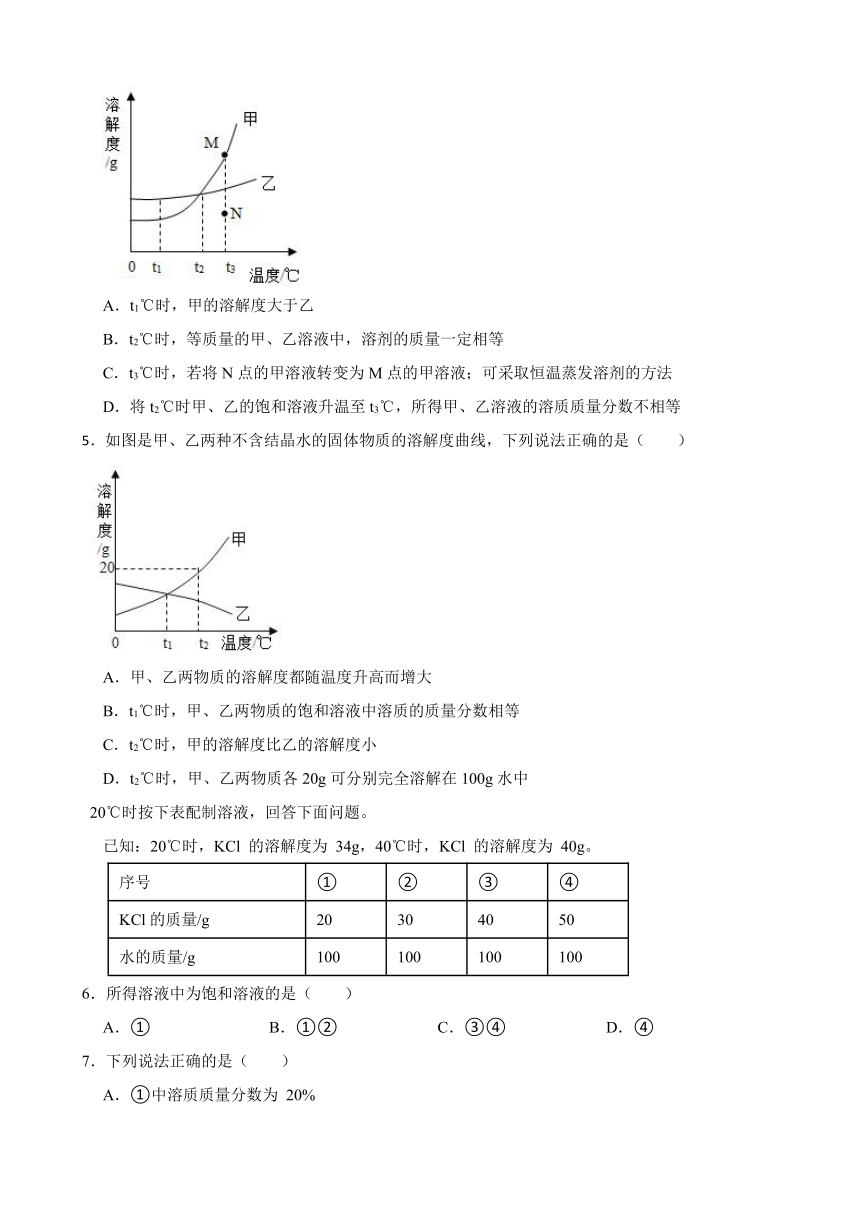
4.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
A.t1℃时,甲的溶解度大于乙
B.t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3℃时,若将N点的甲溶液转变为M点的甲溶液;可采取恒温蒸发溶剂的方法
D.将t2℃时甲、乙的饱和溶液升温至t3℃,所得甲、乙溶液的溶质质量分数不相等
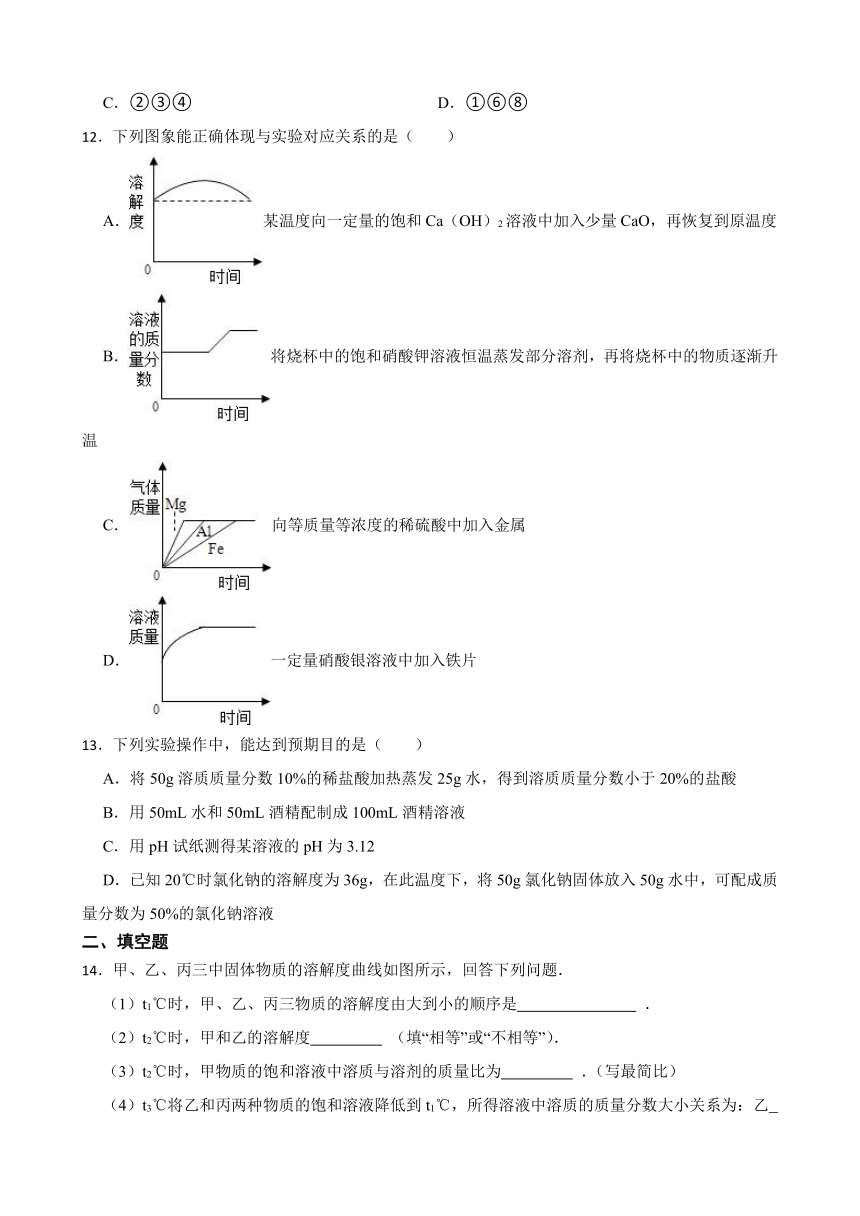
5.如图是甲、乙两种不含结晶水的固体物质的溶解度曲线,下列说法正确的是( )
A.甲、乙两物质的溶解度都随温度升高而增大
B.t1℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等
C.t2℃时,甲的溶解度比乙的溶解度小
D.t2℃时,甲、乙两物质各20g可分别完全溶解在100g水中
20℃时按下表配制溶液,回答下面问题。
已知:20℃时,KCl 的溶解度为 34g,40℃时,KCl 的溶解度为 40g。
序号 ① ② ③ ④
KCl的质量/g 20 30 40 50
水的质量/g 100 100 100 100
6.所得溶液中为饱和溶液的是( )
A.① B.①② C.③④ D.④
7.下列说法正确的是( )
A.①中溶质质量分数为 20%
B.②中溶液质量为 130g
C.③中溶质和溶剂的质量比为 2:5
D.④中溶液升温至 40℃,溶质质量分数不变
8.化学中有许多“相等”,下列有关“相等”的说法错误的是( )
A.溶液加水稀释前后溶质的质量一定相等
B.化合物中化合价的正价总数与负价总数一定相等
C.酒精和水混合前总体积之和与混合后的总体积一定相等
D.参加反应的各物质质量总和与生成的各物质质量总和一定相等
9.高氯酸钾( KClO4 ) 可用作火箭推进剂, 其溶解度如下表。下列说法错误的是( )
温度 /℃ 20 40 60 80
溶解度 /g 1.68 3.73 7.3 13.4
A.高氯酸钾的溶解度随温度降低而减小
B.20℃时, 将 2g 高氯酸钾溶于 98g 水中, 所得溶液中溶质的质量分数小于 2%
C.60℃时, 高氯酸钾饱和溶液中溶质的质量分数小于 7.3%
D.80℃的高氯酸钾溶液冷却至 40℃肯定有晶体析出
10.某氯化钠溶液的质量分数是10%,关于它的叙述中错误的是( )
A.90克水中溶解了10克氯化钠
B.100克氯化钠溶液中含有10克氯化钠
C.180克水中溶解了20克氯化钠
D.100mL氯化钠溶液中含有10克氯化钠
11.下列关于溶液的说法中,正确的是 ( )
①.溶液都是无色透明的混合物
②.均一、稳定的液体一定是溶液
③.任何溶液中只可能含有一种溶剂,溶质可有几种
④.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
⑤.同一温度下,饱和溶液比不饱和溶液浓度大
⑥.溶质以分子或离子的形式均匀分散在溶剂中
⑦.同一温度,同一溶质的饱和溶液所含溶质一定比不饱和溶液所含溶质多
⑧.任何饱和溶液升温后都会变成不饱和溶液
A.③⑤⑦ B.③⑥
C.②③④ D.①⑥⑧
12.下列图象能正确体现与实验对应关系的是( )
A.某温度向一定量的饱和Ca(OH)2溶液中加入少量CaO,再恢复到原温度
B.将烧杯中的饱和硝酸钾溶液恒温蒸发部分溶剂,再将烧杯中的物质逐渐升温
C.向等质量等浓度的稀硫酸中加入金属
D.一定量硝酸银溶液中加入铁片
13.下列实验操作中,能达到预期目的是( )
A.将50g溶质质量分数10%的稀盐酸加热蒸发25g水,得到溶质质量分数小于20%的盐酸
B.用50mL水和50mL酒精配制成100mL酒精溶液
C.用pH试纸测得某溶液的pH为3.12
D.已知20℃时氯化钠的溶解度为36g,在此温度下,将50g氯化钠固体放入50g水中,可配成质量分数为50%的氯化钠溶液
二、填空题
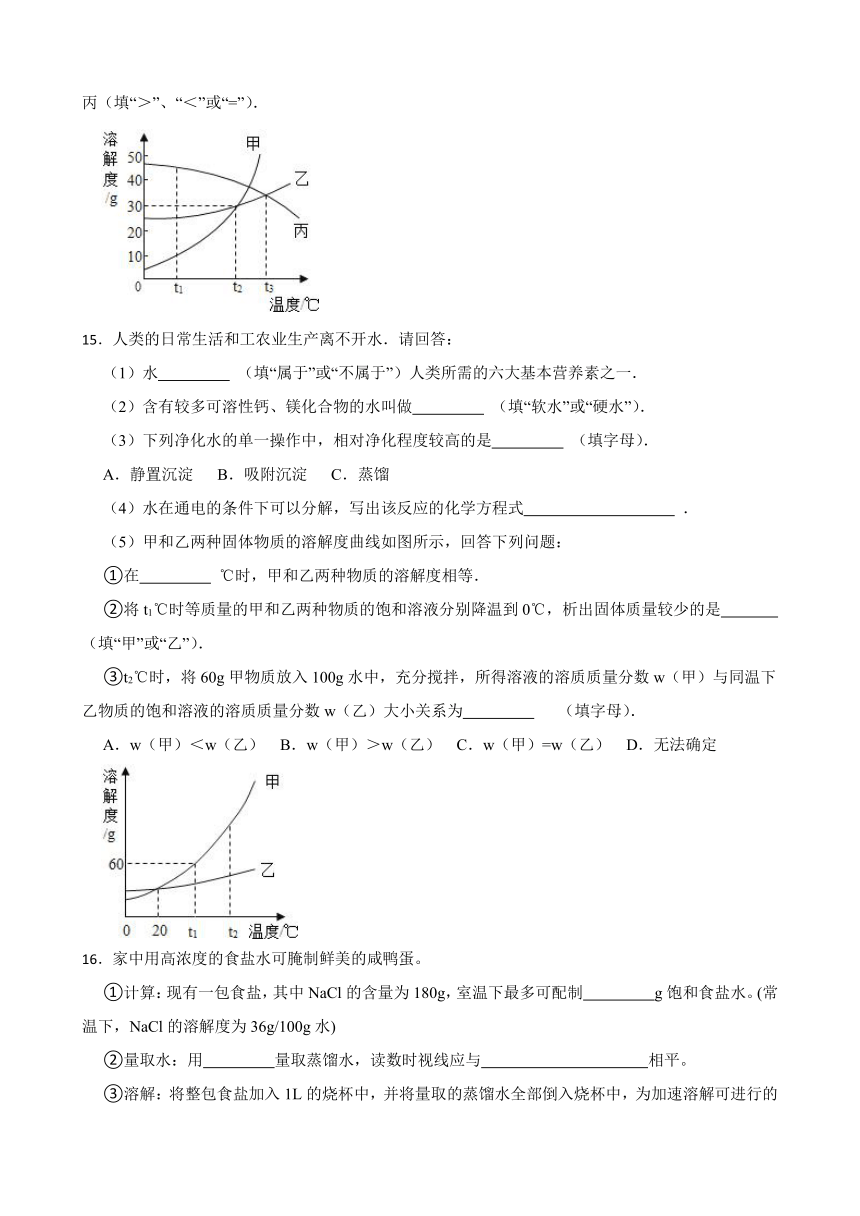
14.甲、乙、丙三中固体物质的溶解度曲线如图所示,回答下列问题.
(1)t1℃时,甲、乙、丙三物质的溶解度由大到小的顺序是 .
(2)t2℃时,甲和乙的溶解度 (填“相等”或“不相等”).
(3)t2℃时,甲物质的饱和溶液中溶质与溶剂的质量比为 .(写最简比)
(4)t3℃将乙和丙两种物质的饱和溶液降低到t1℃,所得溶液中溶质的质量分数大小关系为:乙 丙(填“>”、“<”或“=”).
15.人类的日常生活和工农业生产离不开水.请回答:
(1)水 (填“属于”或“不属于”)人类所需的六大基本营养素之一.
(2)含有较多可溶性钙、镁化合物的水叫做 (填“软水”或“硬水”).
(3)下列净化水的单一操作中,相对净化程度较高的是 (填字母).
A.静置沉淀 B.吸附沉淀 C.蒸馏
(4)水在通电的条件下可以分解,写出该反应的化学方程式 .
(5)甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:
①在 ℃时,甲和乙两种物质的溶解度相等.
②将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是 (填“甲”或“乙”).
③t2℃时,将60g甲物质放入100g水中,充分搅拌,所得溶液的溶质质量分数w(甲)与同温下乙物质的饱和溶液的溶质质量分数w(乙)大小关系为 (填字母).
A.w(甲)<w(乙) B.w(甲)>w(乙) C.w(甲)=w(乙) D.无法确定
16.家中用高浓度的食盐水可腌制鲜美的咸鸭蛋。
①计算:现有一包食盐,其中NaCl的含量为180g,室温下最多可配制 g饱和食盐水。(常温下,NaCl的溶解度为36g/100g水)
②量取水:用 量取蒸馏水,读数时视线应与 相平。
③溶解:将整包食盐加入1L的烧杯中,并将量取的蒸馏水全部倒入烧杯中,为加速溶解可进行的操作是 。
④腌制:将洗净晾干的鸭蛋,放入饱和食盐水中,密封,25天后即可食用。若在夏天腌制,可向密封容器中多加一勺食盐,可能的原因是 。
a 相同条件下,食盐越多,食盐水的浓度越高,腌制的咸鸭蛋越鲜美
b 加入足量的食盐,保证食盐水一直是饱和状态
c 夏天气压低,食盐水中能溶解更多的食盐
d 不同温度下,一定量溶剂中所能溶解的食盐的质量不同
17.用4g酚酞与酒精配制溶质质量分数为4%的酚酞溶液,需要酒精的质量是 g,这些酒精的体积为 mL(酒精的密度为0.8g/mL)。
18.填充气体、添加防腐剂是食品防腐保鲜常用的方法。
(1)选用氮气作为填充的气体,其原因是 。
(2)丙酸钠是一种常用的防腐剂,其化学式为C3H5O2Na.它由
种元素组成。丙酸钠分子中碳、氢原子个数比为 。
19.大型纪录片《水问》,向人们说明了水是生命之源、万物之基,是人类最宝贵的自然资源,唤起人们认识水、了解水、关心水、爱护水、节约水的意识。
(1)水的天然循环既实现了水的自身净化,又完成了水资源的重新分配。水在天然循环是通过其 实现的。
(2)对天然水进行净化处理,可以得到自来水将自来水进一步净化处理得到可直接饮用的水。机场、车站等公共场所设有许多直饮水机,其处理水的过程如下图所示。
图中①对应的作用是____(选填字母序号,下同)。
A.杀菌消毒 B.过滤 C.吸附杂质 D.蒸馏
(3)t1℃时,将a、b两种固体各18g,分别加入到盛有100g水的烧杯中,充分搅拌后现象如下图甲所示,升温到t2℃时,现象如下图乙所示,a、b两种固体在水中的溶解度曲线如下图丙所示。
②从t1℃到t2℃的变化过程中,一直处于饱和状态的是 (填“a”或“b”)的溶液。
②图丙中曲线M表示的是 (填“a”或“b”)的溶解度曲线。
三、综合题
20.化学兴趣小组对某工业废水(溶质为HCl、NaCl)中的HCl含量进行测定,甲、乙两位同学各提供不同的测定方法:
(1)甲同学:酸碱中和法
取50g废水于烧杯中,逐滴滴入溶质质量分数为10%的NaOH溶液,反应过程中溶液的pH变化如图所示,求废水中HCl的质量分数(写出详细的计算过程).
(2)乙同学:沉淀法
改用AgNO3溶液代替NaOH溶液,根据生成沉淀的质量来确定废水中HCl的质量分数,你认为结果将 (填“偏大”“偏小”或“无影响”).
21.下表是甲和乙在不同温度时水中的溶解度,根据此表回答:
温度/℃ 10 20 30 40 50
溶解度/g 甲 30 33 35 38 41
乙 21 31 45 65 88
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是 。
(2)在30℃时,100g水中加入50g甲,充分搅拌后得到的溶液质量为 g。
(3)由表中的数据分析可知,甲和乙在某一温度时具有相同的溶解度xg。则x取值范围是 。
(4)某同学取甲、乙中的一种物质,按如图所示进行实验,下列有关说法错误的是 (填序号)。
①烧杯中加入的是乙
②w取值为50
③40℃时,甲、乙的饱和溶液中溶质的质量乙>甲
④将等质量的甲、乙分别加入等质量的水中,所得溶液的溶质质量分数甲=乙
22.某盐矿井采出的食盐(俗称井盐)中含有CaCl2,为测定CaCl2的含量;准确称量上述井盐22.8g,向其中加入87.2克水使其完全溶解,然后向其中加入10.6%的Na2CO3溶液,生成沉淀的质量与加入Na2CO3溶液的质量关系如图所示(恰好完全反应时所得食盐溶液仍为不饱和溶液)。
求:
(1)井盐中CaCl2的质量分数;
(2)恰好完全反应后所得溶液中NaCl的质量分数(结果都保留一位小数)。
23.我国的航空航天领域已经处于世界领先的水平,请回答下列问题:
(1)2008年9月27日,太空第一次留下了“中国人的脚印”.我国研制的航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是 (填字母序号).
A.与二氧化碳反应 B.使酚酞变红
C.与盐酸反应 D.与锌粒反应
(2)火箭是航天器的运载工具,火箭用液氢做燃料,请写出液氢燃烧的化学方程式 ,该反应是将 能转化为热能.
(3)2011年我国首个火星探测器“萤火一号”将踏上访问火星的旅程.太阳能帆板是探测器的重要部件,其制作材料之一的高纯硅(Si)是用氢气与四氯化硅(SiCl4)在高温条件下反应生成硅和氯化氢,该反应的化学方程式为: ,属于 反应.
答案解析部分
1.【答案】C
2.【答案】C
3.【答案】D
4.【答案】C
5.【答案】B
【答案】6.C
7.B
8.【答案】C
9.【答案】D
10.【答案】D
11.【答案】B
12.【答案】B
13.【答案】A
14.【答案】丙>乙>甲;相等;3:10;<
15.【答案】属于;硬水;C;2H2O2H2↑+O2↑;20;乙;B
16.【答案】680;量筒;液体凹液面最低处;搅拌;bd
17.【答案】96;120
18.【答案】(1)氮气的化学性质不活泼
(2)四;3:5
19.【答案】(1)三态变化
(2)C
(3)b;a
20.【答案】(1)解:设废水中氯化氢的质量为x
HCl+ NaOH=NaCl+H2O
36.5 40
x 40g×10%=4g
解得:x=3.65g
废水中HCl的质量分数: =7.3%
答:废水中HCl的质量分数为7.3%;
(2)偏高
21.【答案】(1)乙
(2)135
(3)33<x<35
(4)②③④
22.【答案】(1)解∶设井盐中CaCl2的质量为xg,反应生成氯化钠质量为yg,生成沉淀zg
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
106 71 100 117
10.6%×100g x z y
= ,x=7.1g. 井盐中CaCl2的质量分数∶ ×100%=48.7%;
= ,y=11.7g. = ,z=10g
答∶井盐中CaCl2的质量分数是48.7%
(2)解∶恰好完全反应后所得溶液中NaCl的质量分数∶ ×100%=11.7%.
答∶恰好完全反应后所得溶液中NaCl的质量分数是11.7%
23.【答案】(1)D
(2)2H2+O2 2H2O;化学
(3)SiCl4+2H2 Si+4HCl;置换
一、单选题
1.为处理某厂排放的含氢氧化钠的碱性废液,原定用5kg14.6%的盐酸刚好处理成中性,因库存盐酸不足,换用5kg硫酸溶液处理,则所用硫酸溶液中溶质的质量分数为( )
A.14.6% B.9.8%
C.19.6% D.39.2%
2.如图是固体甲、乙的溶解度曲线图,下列说法正确的是( )
A.甲物质的溶解度大于乙物质的溶解度
B.甲、乙两物质的溶解度都随温度升高而减小
C.用冷却热饱和溶液的方法可除去混在甲中的乙物质
D.20℃时,可配制质量分数为30%的乙物质溶液
3.下表列出了部分温度下Ca(OH)2和KNO3的溶解度。下列说法正确的是( )
温度/℃ 10 30 50 60
溶解度/g Ca(OH)2 0.18 0.15 0.12 0.11
KNO3 20.9 45.8 85.5 110
A.将50℃的Ca(OH)2饱和溶液降温到10℃有晶体析出
B.30℃时KNO3的饱和溶液中溶质的质量分数为45.8%
C.50℃时不可能配制溶质质量分数相等的Ca(OH)2、KNO3溶液
D.当KNO3中混有少量Ca(OH)2时,可采用降温结晶的方法提纯
4.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
A.t1℃时,甲的溶解度大于乙
B.t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3℃时,若将N点的甲溶液转变为M点的甲溶液;可采取恒温蒸发溶剂的方法
D.将t2℃时甲、乙的饱和溶液升温至t3℃,所得甲、乙溶液的溶质质量分数不相等
5.如图是甲、乙两种不含结晶水的固体物质的溶解度曲线,下列说法正确的是( )
A.甲、乙两物质的溶解度都随温度升高而增大
B.t1℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等
C.t2℃时,甲的溶解度比乙的溶解度小
D.t2℃时,甲、乙两物质各20g可分别完全溶解在100g水中
20℃时按下表配制溶液,回答下面问题。
已知:20℃时,KCl 的溶解度为 34g,40℃时,KCl 的溶解度为 40g。
序号 ① ② ③ ④
KCl的质量/g 20 30 40 50
水的质量/g 100 100 100 100
6.所得溶液中为饱和溶液的是( )
A.① B.①② C.③④ D.④
7.下列说法正确的是( )
A.①中溶质质量分数为 20%
B.②中溶液质量为 130g
C.③中溶质和溶剂的质量比为 2:5
D.④中溶液升温至 40℃,溶质质量分数不变
8.化学中有许多“相等”,下列有关“相等”的说法错误的是( )
A.溶液加水稀释前后溶质的质量一定相等
B.化合物中化合价的正价总数与负价总数一定相等
C.酒精和水混合前总体积之和与混合后的总体积一定相等
D.参加反应的各物质质量总和与生成的各物质质量总和一定相等
9.高氯酸钾( KClO4 ) 可用作火箭推进剂, 其溶解度如下表。下列说法错误的是( )
温度 /℃ 20 40 60 80
溶解度 /g 1.68 3.73 7.3 13.4
A.高氯酸钾的溶解度随温度降低而减小
B.20℃时, 将 2g 高氯酸钾溶于 98g 水中, 所得溶液中溶质的质量分数小于 2%
C.60℃时, 高氯酸钾饱和溶液中溶质的质量分数小于 7.3%
D.80℃的高氯酸钾溶液冷却至 40℃肯定有晶体析出
10.某氯化钠溶液的质量分数是10%,关于它的叙述中错误的是( )
A.90克水中溶解了10克氯化钠
B.100克氯化钠溶液中含有10克氯化钠
C.180克水中溶解了20克氯化钠
D.100mL氯化钠溶液中含有10克氯化钠
11.下列关于溶液的说法中,正确的是 ( )
①.溶液都是无色透明的混合物
②.均一、稳定的液体一定是溶液
③.任何溶液中只可能含有一种溶剂,溶质可有几种
④.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
⑤.同一温度下,饱和溶液比不饱和溶液浓度大
⑥.溶质以分子或离子的形式均匀分散在溶剂中
⑦.同一温度,同一溶质的饱和溶液所含溶质一定比不饱和溶液所含溶质多
⑧.任何饱和溶液升温后都会变成不饱和溶液
A.③⑤⑦ B.③⑥
C.②③④ D.①⑥⑧
12.下列图象能正确体现与实验对应关系的是( )
A.某温度向一定量的饱和Ca(OH)2溶液中加入少量CaO,再恢复到原温度
B.将烧杯中的饱和硝酸钾溶液恒温蒸发部分溶剂,再将烧杯中的物质逐渐升温
C.向等质量等浓度的稀硫酸中加入金属
D.一定量硝酸银溶液中加入铁片
13.下列实验操作中,能达到预期目的是( )
A.将50g溶质质量分数10%的稀盐酸加热蒸发25g水,得到溶质质量分数小于20%的盐酸
B.用50mL水和50mL酒精配制成100mL酒精溶液
C.用pH试纸测得某溶液的pH为3.12
D.已知20℃时氯化钠的溶解度为36g,在此温度下,将50g氯化钠固体放入50g水中,可配成质量分数为50%的氯化钠溶液
二、填空题
14.甲、乙、丙三中固体物质的溶解度曲线如图所示,回答下列问题.
(1)t1℃时,甲、乙、丙三物质的溶解度由大到小的顺序是 .
(2)t2℃时,甲和乙的溶解度 (填“相等”或“不相等”).
(3)t2℃时,甲物质的饱和溶液中溶质与溶剂的质量比为 .(写最简比)
(4)t3℃将乙和丙两种物质的饱和溶液降低到t1℃,所得溶液中溶质的质量分数大小关系为:乙 丙(填“>”、“<”或“=”).
15.人类的日常生活和工农业生产离不开水.请回答:
(1)水 (填“属于”或“不属于”)人类所需的六大基本营养素之一.
(2)含有较多可溶性钙、镁化合物的水叫做 (填“软水”或“硬水”).
(3)下列净化水的单一操作中,相对净化程度较高的是 (填字母).
A.静置沉淀 B.吸附沉淀 C.蒸馏
(4)水在通电的条件下可以分解,写出该反应的化学方程式 .
(5)甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:
①在 ℃时,甲和乙两种物质的溶解度相等.
②将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是 (填“甲”或“乙”).
③t2℃时,将60g甲物质放入100g水中,充分搅拌,所得溶液的溶质质量分数w(甲)与同温下乙物质的饱和溶液的溶质质量分数w(乙)大小关系为 (填字母).
A.w(甲)<w(乙) B.w(甲)>w(乙) C.w(甲)=w(乙) D.无法确定
16.家中用高浓度的食盐水可腌制鲜美的咸鸭蛋。
①计算:现有一包食盐,其中NaCl的含量为180g,室温下最多可配制 g饱和食盐水。(常温下,NaCl的溶解度为36g/100g水)
②量取水:用 量取蒸馏水,读数时视线应与 相平。
③溶解:将整包食盐加入1L的烧杯中,并将量取的蒸馏水全部倒入烧杯中,为加速溶解可进行的操作是 。
④腌制:将洗净晾干的鸭蛋,放入饱和食盐水中,密封,25天后即可食用。若在夏天腌制,可向密封容器中多加一勺食盐,可能的原因是 。
a 相同条件下,食盐越多,食盐水的浓度越高,腌制的咸鸭蛋越鲜美
b 加入足量的食盐,保证食盐水一直是饱和状态
c 夏天气压低,食盐水中能溶解更多的食盐
d 不同温度下,一定量溶剂中所能溶解的食盐的质量不同
17.用4g酚酞与酒精配制溶质质量分数为4%的酚酞溶液,需要酒精的质量是 g,这些酒精的体积为 mL(酒精的密度为0.8g/mL)。
18.填充气体、添加防腐剂是食品防腐保鲜常用的方法。
(1)选用氮气作为填充的气体,其原因是 。
(2)丙酸钠是一种常用的防腐剂,其化学式为C3H5O2Na.它由
种元素组成。丙酸钠分子中碳、氢原子个数比为 。
19.大型纪录片《水问》,向人们说明了水是生命之源、万物之基,是人类最宝贵的自然资源,唤起人们认识水、了解水、关心水、爱护水、节约水的意识。
(1)水的天然循环既实现了水的自身净化,又完成了水资源的重新分配。水在天然循环是通过其 实现的。
(2)对天然水进行净化处理,可以得到自来水将自来水进一步净化处理得到可直接饮用的水。机场、车站等公共场所设有许多直饮水机,其处理水的过程如下图所示。
图中①对应的作用是____(选填字母序号,下同)。
A.杀菌消毒 B.过滤 C.吸附杂质 D.蒸馏
(3)t1℃时,将a、b两种固体各18g,分别加入到盛有100g水的烧杯中,充分搅拌后现象如下图甲所示,升温到t2℃时,现象如下图乙所示,a、b两种固体在水中的溶解度曲线如下图丙所示。
②从t1℃到t2℃的变化过程中,一直处于饱和状态的是 (填“a”或“b”)的溶液。
②图丙中曲线M表示的是 (填“a”或“b”)的溶解度曲线。
三、综合题
20.化学兴趣小组对某工业废水(溶质为HCl、NaCl)中的HCl含量进行测定,甲、乙两位同学各提供不同的测定方法:
(1)甲同学:酸碱中和法
取50g废水于烧杯中,逐滴滴入溶质质量分数为10%的NaOH溶液,反应过程中溶液的pH变化如图所示,求废水中HCl的质量分数(写出详细的计算过程).
(2)乙同学:沉淀法
改用AgNO3溶液代替NaOH溶液,根据生成沉淀的质量来确定废水中HCl的质量分数,你认为结果将 (填“偏大”“偏小”或“无影响”).
21.下表是甲和乙在不同温度时水中的溶解度,根据此表回答:
温度/℃ 10 20 30 40 50
溶解度/g 甲 30 33 35 38 41
乙 21 31 45 65 88
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是 。
(2)在30℃时,100g水中加入50g甲,充分搅拌后得到的溶液质量为 g。
(3)由表中的数据分析可知,甲和乙在某一温度时具有相同的溶解度xg。则x取值范围是 。
(4)某同学取甲、乙中的一种物质,按如图所示进行实验,下列有关说法错误的是 (填序号)。
①烧杯中加入的是乙
②w取值为50
③40℃时,甲、乙的饱和溶液中溶质的质量乙>甲
④将等质量的甲、乙分别加入等质量的水中,所得溶液的溶质质量分数甲=乙
22.某盐矿井采出的食盐(俗称井盐)中含有CaCl2,为测定CaCl2的含量;准确称量上述井盐22.8g,向其中加入87.2克水使其完全溶解,然后向其中加入10.6%的Na2CO3溶液,生成沉淀的质量与加入Na2CO3溶液的质量关系如图所示(恰好完全反应时所得食盐溶液仍为不饱和溶液)。
求:
(1)井盐中CaCl2的质量分数;
(2)恰好完全反应后所得溶液中NaCl的质量分数(结果都保留一位小数)。
23.我国的航空航天领域已经处于世界领先的水平,请回答下列问题:
(1)2008年9月27日,太空第一次留下了“中国人的脚印”.我国研制的航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是 (填字母序号).
A.与二氧化碳反应 B.使酚酞变红
C.与盐酸反应 D.与锌粒反应
(2)火箭是航天器的运载工具,火箭用液氢做燃料,请写出液氢燃烧的化学方程式 ,该反应是将 能转化为热能.
(3)2011年我国首个火星探测器“萤火一号”将踏上访问火星的旅程.太阳能帆板是探测器的重要部件,其制作材料之一的高纯硅(Si)是用氢气与四氯化硅(SiCl4)在高温条件下反应生成硅和氯化氢,该反应的化学方程式为: ,属于 反应.
答案解析部分
1.【答案】C
2.【答案】C
3.【答案】D
4.【答案】C
5.【答案】B
【答案】6.C
7.B
8.【答案】C
9.【答案】D
10.【答案】D
11.【答案】B
12.【答案】B
13.【答案】A
14.【答案】丙>乙>甲;相等;3:10;<
15.【答案】属于;硬水;C;2H2O2H2↑+O2↑;20;乙;B
16.【答案】680;量筒;液体凹液面最低处;搅拌;bd
17.【答案】96;120
18.【答案】(1)氮气的化学性质不活泼
(2)四;3:5
19.【答案】(1)三态变化
(2)C
(3)b;a
20.【答案】(1)解:设废水中氯化氢的质量为x
HCl+ NaOH=NaCl+H2O
36.5 40
x 40g×10%=4g
解得:x=3.65g
废水中HCl的质量分数: =7.3%
答:废水中HCl的质量分数为7.3%;
(2)偏高
21.【答案】(1)乙
(2)135
(3)33<x<35
(4)②③④
22.【答案】(1)解∶设井盐中CaCl2的质量为xg,反应生成氯化钠质量为yg,生成沉淀zg
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
106 71 100 117
10.6%×100g x z y
= ,x=7.1g. 井盐中CaCl2的质量分数∶ ×100%=48.7%;
= ,y=11.7g. = ,z=10g
答∶井盐中CaCl2的质量分数是48.7%
(2)解∶恰好完全反应后所得溶液中NaCl的质量分数∶ ×100%=11.7%.
答∶恰好完全反应后所得溶液中NaCl的质量分数是11.7%
23.【答案】(1)D
(2)2H2+O2 2H2O;化学
(3)SiCl4+2H2 Si+4HCl;置换
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
