2.2-1 价层电子互斥理论 课件 (共24张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2-1 价层电子互斥理论 课件 (共24张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | zip | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 00:00:00 | ||
图片预览





文档简介
(共24张PPT)
2.2-1:价层电子互斥理论
2.2 分子的空间结构
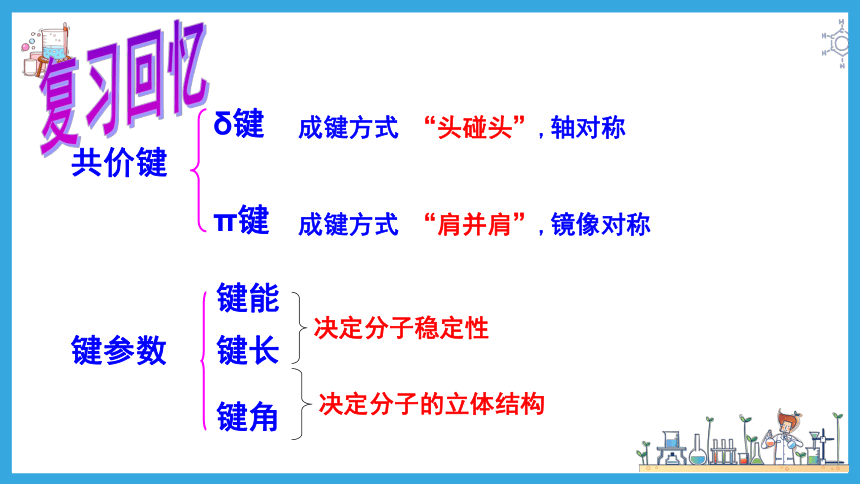
共价键
δ键
π键
键参数
键能
键长
键角
决定分子稳定性
决定分子的立体结构
成键方式 “头碰头”,轴对称
成键方式 “肩并肩”,镜像对称
复习回忆
1
分子结构的测定
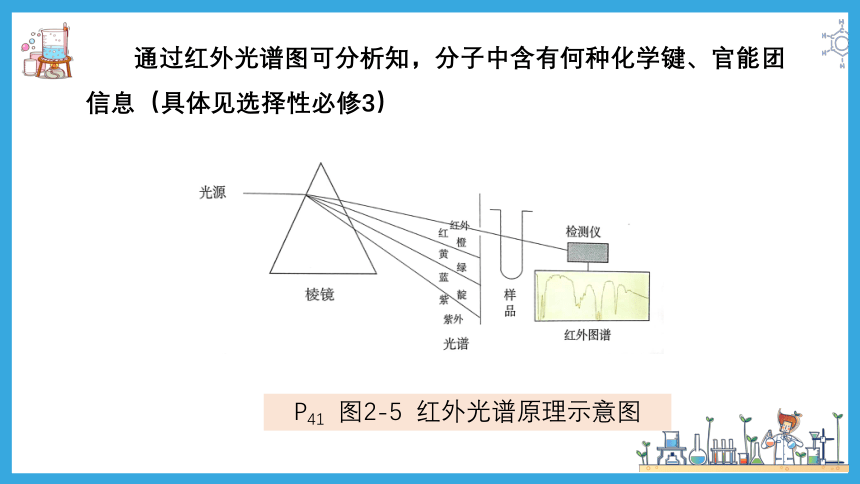
分子中的原子不是固定不动的,而是不断地震动着的,但肉眼看不到分子,那么科学家是怎么知道分子的结构的呢?
1、分子结构的测定:
红外光谱、晶体X射线衍射
当一束红外线透过分子时,分子会吸收跟他的某些化学键的震动评率相同的红外线,再记录到图谱上呈现吸收峰
P41
通过红外光谱图可分析知,分子中含有何种化学键、官能团信息(具体见选择性必修3)
P41 图2-5 红外光谱原理示意图
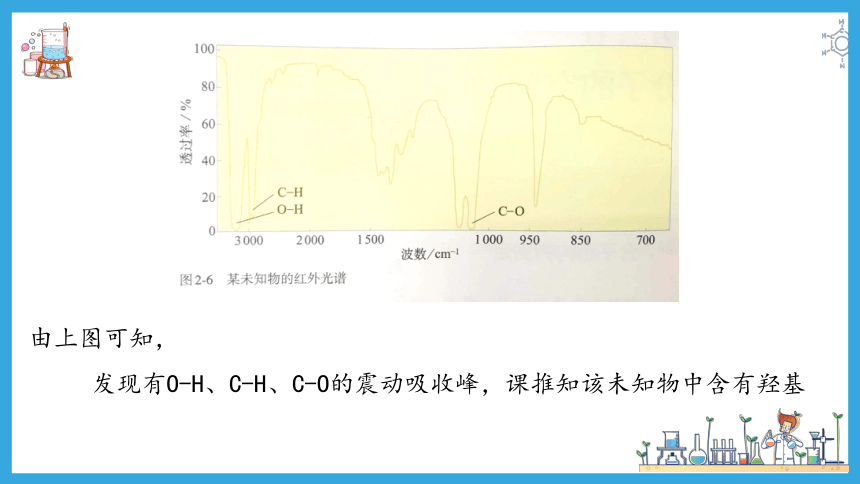
由上图可知,
发现有O-H、C-H、C-O的震动吸收峰,课推知该未知物中含有羟基
2
形形色色的分子体
一、形形色色的分子
O2
HCl
H2O
CO2
1、双原子分子
2、三原子分子立体结构
直线形 180°
V形 105°
3、四原子分子立体结构
HCHO
NH3
平面三角形 120°
三角锥形 107°18′
4、五原子分子立体结构
CH4
正四面体
化学式 电子式 结构式 键角 分子的立体构型
三原子 分子 CO2
H2O
四原子 分子 BF3
NH3
五原子 分子 CH4
CH3Cl ---
O=C=O
H-O-H
180°
105°
120°
107°
109°28′
直线形
V形
平面三角形
三角锥
正四面体
四面体
同为三原子分子,CO2 和 H2O 分子的空间结构却不
同,什么原因?
同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
3
价层电子互斥理论
1、价层电子互斥理论
价层电子互斥理论认为,分子的例题构型是“价层电子互斥理论”相互排斥的结果。夹层电子对是指分子中的中心原子上的电子对,包括δ间电子对和中心原子上的孤电子对。
☆ 价层电子对数=δ键电子对数+孤电子对数
δ键电子对数= 与中心原子结合的原子数
孤电子对数 = (a-xb)
a 对于原子:为中心原子的最外层电子数
(离子:a为中心原子最外层电子数减去离子电荷数)
x 为与中心原子结合的原子数
b 为与中心原子结合的原子最多能接受的电子数
(H为1,其他原子为“8-该原子的最外层电子数)
分子或离子 δ键电子对 a x b 孤电子对数 价层电子对数
CO2
SO3
CO32-
CH4
NH4+
SO2
NH3
SO32-
H2O
0
0
0
0
0
2
3
3
4
4
1
1
1
2
3
4
4
4
4 2 2
6 3 2
4+2=6 3 2
5-1=4 4 1
6+2=8 3 2
4 4 1
6 2 2
6 2 1
5 3 1
孤电子对数、价层电子对数的计算:
2
3
3
4
42
3
3
2
A
价层电子对
为使排斥力最小,原子轨道在空间取最大夹角分布,分子体系能量最低,最稳定。
直线
平面三角形
正四面体
2
3
4
价电子互斥模型即VSEPR模型
价层电子对
VSEPR模型
a、中心原子无孤电子对:
2、分子的立体结构与VSEPR模型的关系
分子式 孤电子对 δ键电子对 价层电子对 VSEPR模型 分子空间构型
CO2 0 2 2
CO3 ˉ SO3 0 3 3
CH4 0 4 4
直线形
平面三角形
VSEPR模型与分子空间构型相同
正四面体
直线形
平面三角形
正四面体
分子式 孤电子对 δ键电子对 价层电子对 VSEPR模型 分子空间构型
SO2 1 2 3
NH3 1 3 4
H2O 2 2 4
VSEPR模型略去孤电子对轨道后为分子空间构型
b.中心原子有孤电子对:
V形
三角锥形
V形
平面三
角形
四面体形
四面体形
孤电子对间斥力>孤电子对与δ键电子对斥力>δ键电子对间斥力
价层电子对数 原子数 VSEPR模型 分子的立体构型
2
3 3
4
4 3
4
5
直线形
平面三角形
四面体形
V形
平面三角形
V形
三角锥形
四面体形
2.2-1:价层电子互斥理论
2.2 分子的空间结构
共价键
δ键
π键
键参数
键能
键长
键角
决定分子稳定性
决定分子的立体结构
成键方式 “头碰头”,轴对称
成键方式 “肩并肩”,镜像对称
复习回忆
1
分子结构的测定
分子中的原子不是固定不动的,而是不断地震动着的,但肉眼看不到分子,那么科学家是怎么知道分子的结构的呢?
1、分子结构的测定:
红外光谱、晶体X射线衍射
当一束红外线透过分子时,分子会吸收跟他的某些化学键的震动评率相同的红外线,再记录到图谱上呈现吸收峰
P41
通过红外光谱图可分析知,分子中含有何种化学键、官能团信息(具体见选择性必修3)
P41 图2-5 红外光谱原理示意图
由上图可知,
发现有O-H、C-H、C-O的震动吸收峰,课推知该未知物中含有羟基
2
形形色色的分子体
一、形形色色的分子
O2
HCl
H2O
CO2
1、双原子分子
2、三原子分子立体结构
直线形 180°
V形 105°
3、四原子分子立体结构
HCHO
NH3
平面三角形 120°
三角锥形 107°18′
4、五原子分子立体结构
CH4
正四面体
化学式 电子式 结构式 键角 分子的立体构型
三原子 分子 CO2
H2O
四原子 分子 BF3
NH3
五原子 分子 CH4
CH3Cl ---
O=C=O
H-O-H
180°
105°
120°
107°
109°28′
直线形
V形
平面三角形
三角锥
正四面体
四面体
同为三原子分子,CO2 和 H2O 分子的空间结构却不
同,什么原因?
同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
3
价层电子互斥理论
1、价层电子互斥理论
价层电子互斥理论认为,分子的例题构型是“价层电子互斥理论”相互排斥的结果。夹层电子对是指分子中的中心原子上的电子对,包括δ间电子对和中心原子上的孤电子对。
☆ 价层电子对数=δ键电子对数+孤电子对数
δ键电子对数= 与中心原子结合的原子数
孤电子对数 = (a-xb)
a 对于原子:为中心原子的最外层电子数
(离子:a为中心原子最外层电子数减去离子电荷数)
x 为与中心原子结合的原子数
b 为与中心原子结合的原子最多能接受的电子数
(H为1,其他原子为“8-该原子的最外层电子数)
分子或离子 δ键电子对 a x b 孤电子对数 价层电子对数
CO2
SO3
CO32-
CH4
NH4+
SO2
NH3
SO32-
H2O
0
0
0
0
0
2
3
3
4
4
1
1
1
2
3
4
4
4
4 2 2
6 3 2
4+2=6 3 2
5-1=4 4 1
6+2=8 3 2
4 4 1
6 2 2
6 2 1
5 3 1
孤电子对数、价层电子对数的计算:
2
3
3
4
42
3
3
2
A
价层电子对
为使排斥力最小,原子轨道在空间取最大夹角分布,分子体系能量最低,最稳定。
直线
平面三角形
正四面体
2
3
4
价电子互斥模型即VSEPR模型
价层电子对
VSEPR模型
a、中心原子无孤电子对:
2、分子的立体结构与VSEPR模型的关系
分子式 孤电子对 δ键电子对 价层电子对 VSEPR模型 分子空间构型
CO2 0 2 2
CO3 ˉ SO3 0 3 3
CH4 0 4 4
直线形
平面三角形
VSEPR模型与分子空间构型相同
正四面体
直线形
平面三角形
正四面体
分子式 孤电子对 δ键电子对 价层电子对 VSEPR模型 分子空间构型
SO2 1 2 3
NH3 1 3 4
H2O 2 2 4
VSEPR模型略去孤电子对轨道后为分子空间构型
b.中心原子有孤电子对:
V形
三角锥形
V形
平面三
角形
四面体形
四面体形
孤电子对间斥力>孤电子对与δ键电子对斥力>δ键电子对间斥力
价层电子对数 原子数 VSEPR模型 分子的立体构型
2
3 3
4
4 3
4
5
直线形
平面三角形
四面体形
V形
平面三角形
V形
三角锥形
四面体形
