第一节 化学反应速率2.1.3课(共21张PPT)
文档属性
| 名称 | 第一节 化学反应速率2.1.3课(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
课时3
活化能
第一节 化学反应速率
研究化学反应规律的方法
——概念模型法
1、活化分子
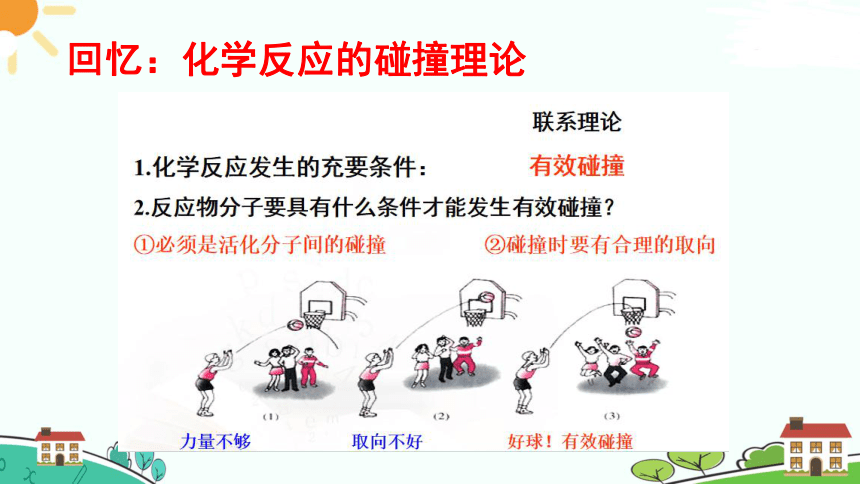
回忆:化学反应的碰撞理论
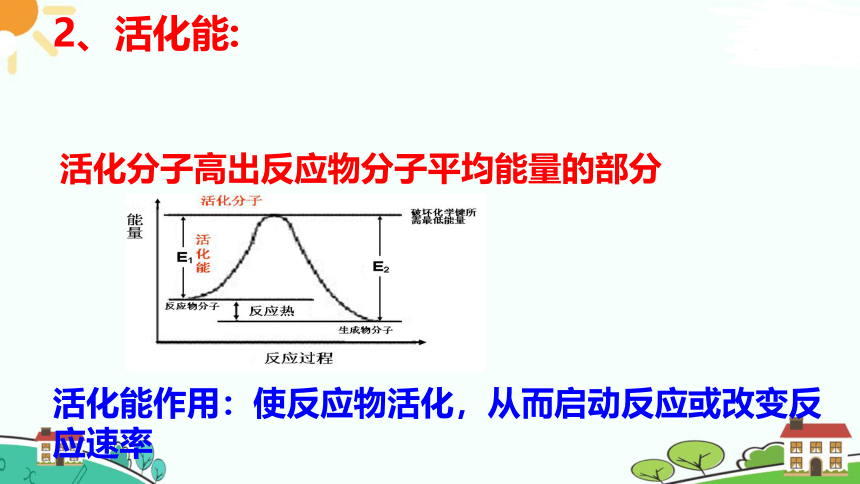
2、活化能:
活化分子高出反应物分子平均能量的部分
活化能作用:使反应物活化,从而启动反应或改变反应速率
3.活化分子的特点:
①活化分子具有较高的能量,能量不足的分子
获取能量(活化能)后才能变成活化分子。
②其他条件不变时,同一反应活化分子在反应物
中所占的百分数是一定的。
活化分子百分数=
活化分子数
反应物分子数
×100%
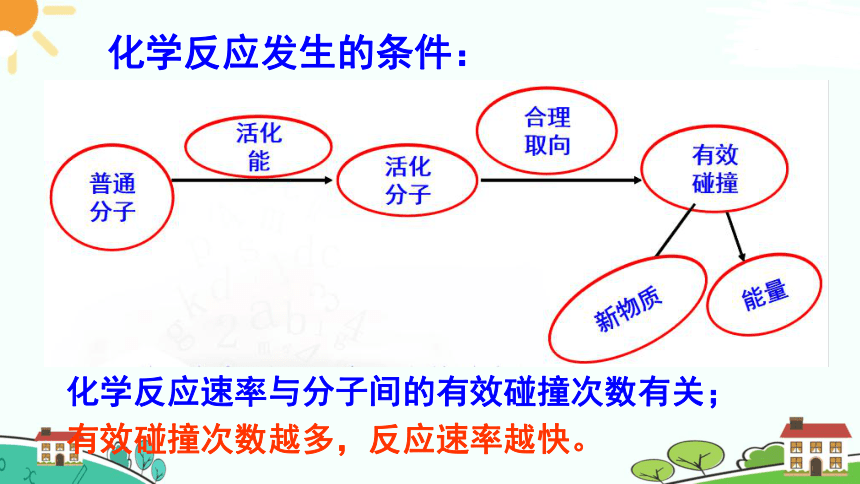
化学反应发生的条件:
有效碰撞次数越多,反应速率越快。
化学反应速率与分子间的有效碰撞次数有关;
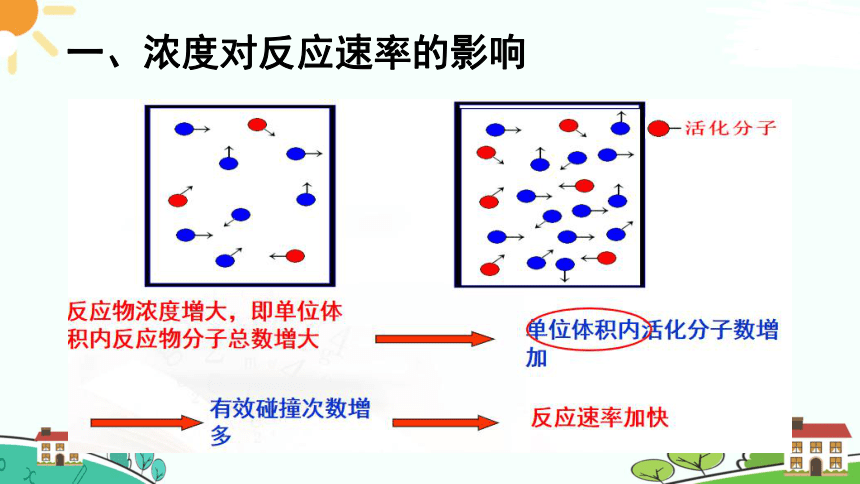
一、浓度对反应速率的影响
二、压强对反应速率的影响
三、温度对反应速率的影响
【原因】温度升高
(1)分子获得能量,活化分子百分数提高;
(2)分子热运动加快,碰撞频率提高。
四、催化剂对反应速率的影响
思考:加了催化剂,反应热有无改变?
催化剂作用:降低化学反应所需活化能, 从而提高反应速率.
注意事项
归纳总结
1.下列说法错误的是
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
√
√
【课堂练习】
2.参照反应Br2 + H2 HBr 的能量对反应历程的示意图,下列叙述中正确的( )
A. 正反应为放热反应
B. 加入催化剂,该化学反应的反应热不改变
C. 正反应为放热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
B
【课堂练习】
3.下列说法不正确的是( )
A.能量较高、有可能发生有效碰撞的分子称为活化分子
B.活化分子的平均能量与所有分子的平均能量之差称为活化能
C.催化剂能参与反应,可降低原反应所需活化能
D.非活化分子也有可能发生有效碰撞
【课堂练习】
课时3
活化能
第一节 化学反应速率
研究化学反应规律的方法
——概念模型法
1、活化分子
回忆:化学反应的碰撞理论
2、活化能:
活化分子高出反应物分子平均能量的部分
活化能作用:使反应物活化,从而启动反应或改变反应速率
3.活化分子的特点:
①活化分子具有较高的能量,能量不足的分子
获取能量(活化能)后才能变成活化分子。
②其他条件不变时,同一反应活化分子在反应物
中所占的百分数是一定的。
活化分子百分数=
活化分子数
反应物分子数
×100%
化学反应发生的条件:
有效碰撞次数越多,反应速率越快。
化学反应速率与分子间的有效碰撞次数有关;
一、浓度对反应速率的影响
二、压强对反应速率的影响
三、温度对反应速率的影响
【原因】温度升高
(1)分子获得能量,活化分子百分数提高;
(2)分子热运动加快,碰撞频率提高。
四、催化剂对反应速率的影响
思考:加了催化剂,反应热有无改变?
催化剂作用:降低化学反应所需活化能, 从而提高反应速率.
注意事项
归纳总结
1.下列说法错误的是
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
√
√
【课堂练习】
2.参照反应Br2 + H2 HBr 的能量对反应历程的示意图,下列叙述中正确的( )
A. 正反应为放热反应
B. 加入催化剂,该化学反应的反应热不改变
C. 正反应为放热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
B
【课堂练习】
3.下列说法不正确的是( )
A.能量较高、有可能发生有效碰撞的分子称为活化分子
B.活化分子的平均能量与所有分子的平均能量之差称为活化能
C.催化剂能参与反应,可降低原反应所需活化能
D.非活化分子也有可能发生有效碰撞
【课堂练习】
