第一节 原电池4.1.1课件(共20张PPT)
文档属性
| 名称 | 第一节 原电池4.1.1课件(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1011.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 08:48:18 | ||
图片预览






文档简介
(共20张PPT)
第一节 原电池
课时1
原电池的工作原理
第四章 化学反应与电能
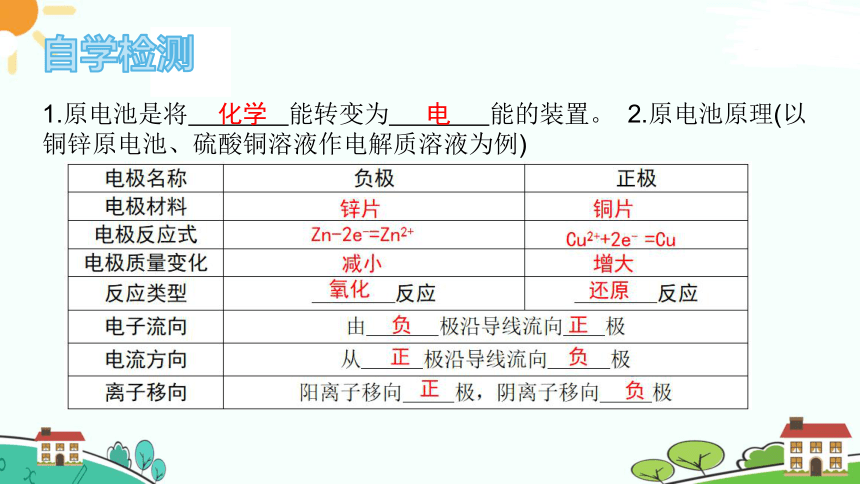
1.原电池是将 能转变为 能的装置。 2.原电池原理(以铜锌原电池、硫酸铜溶液作电解质溶液为例)
化学
电
自学检测
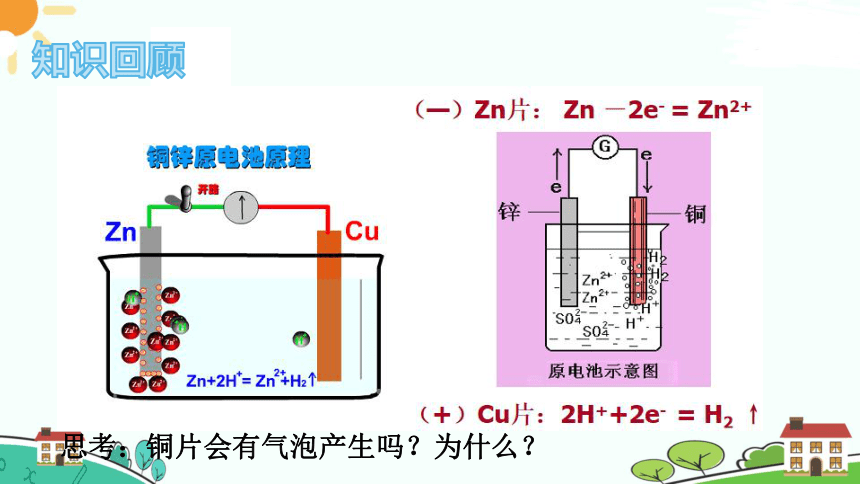
知识回顾
思考:铜片会有气泡产生吗?为什么?
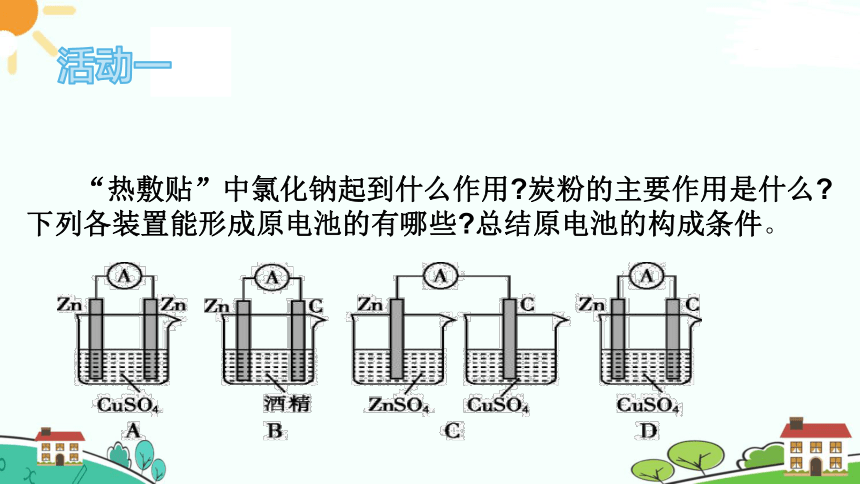
活动一
“热敷贴”中氯化钠起到什么作用 炭粉的主要作用是什么 下列各装置能形成原电池的有哪些 总结原电池的构成条件。
氯化钠溶于水形成电解质溶液。炭粉作原电池的正极材料,与铁、氯化钠溶液构成原电池,从而加速铁的氧化。
原电池构成的条件:①有活性不同的两个电极;②有电解质溶液;③形成闭合回路;④能自发进行的氧化还原反应。
上述实验设计的电池因锌与CuSO4溶液直接接触能反应,时间稍长电流很快就减弱,效率比较低,不适合实际应用。若设计成双液原电池,避免了Cu2+在锌片上直接还原析出铜,以延长电池的放电时间,提高供电效率。
(1)下图装置能构成原电池吗 若不能,怎样才能构成原电池
(2)盐桥有什么作用
(3)叙述实验现象,写出电极反应式及电池反应。
(4)分析盐桥中离子的移动方向。
活动二
因左边烧杯的溶液中c(Zn2+)增大,右边烧杯的溶液中c(Cu2+)减小,为了使溶液保持电中性,盐桥中的Cl-移向负极区(ZnSO4溶液),K+移向正极区(CuSO4溶液)。
①构成闭合回路,形成原电池。
②盐桥中阴、阳离子定向迁移,电解质溶液呈电中性。
③避免电极与电解质溶液直接反应,放电更持久。
盐桥的作用:
思考与讨论
1.课本中图4-1所示的铜锌原电池工作时,电子导线中的运动方向是怎样的?阴离子和阳离子在电解质溶液中的运动方向是怎样的?
2.铜锌原电池可以看作由两个半电池组成,一个发生氧化反应,另一个发生还原反应。试分别写出两个电极上的反应及总反应的离子方程式。
铜锌原电池工作时,电子由锌片沿导线移向铜片,阴离子(Cl-,SO42-)在电解质溶液中移向锌片,阳离子(K+,Cu2+)移向铜片
3.请结合课本中图4-1绘制反映原电池工作原理的示意图,并与同学交流。示意图要求包括以下内容:
(1)注明原电池的组成;
(2)标明氧化反应和还原反应发生的区域
(3)标明电子的运动方向和阴离子、阳离子的迁移方向。
思考与讨论
双液电池工作原理示意图
微思考
1.盐桥中有电子流过吗 溶液中的离子能通过盐桥吗 溶液中的SO42-浓度如何变化
2.原电池的负极失去电子的总数与正极得到电子的总数有什么关系
没有;不能;不变。
相等。
3.试判断图中原电池装置的正、负极。你认为判断原电池正、负极时需要注意什么
甲池:Mg作负极,Al作正极;乙池:Al作负极,Mg作正极。需要注意:在原电池中,失电子(电子流出)发生氧化反应的一极为负极,得电子(电子流入)发生还原反应的一极为正极。在判断原电池正、负极时,不能只考虑金属活动性的相对强弱,还要考虑其能否与电解质溶液发生氧化还原反应。
微思考
试写出“热敷贴”中正、负极的电极反应式。并归纳原电池的电极反应式的书写思路。
负极:Fe-2e- = Fe2+;正极:O2+4e-+2H2O = 4OH-。
电极反应方程式的书写
书写思路:
1.先判断原电池的正、负极,即找出氧化剂和还原剂;
2.再结合电解质溶液的酸碱性确定还原产物和氧化产物;
3.根据情况补充H+、OH-、H2O。
3.然后根据电荷守恒、原子守恒等书写并配平电极反应式。
原电池的设计
从理论上讲,能自发进行的氧化还原反应均可以设计成原电池,实际设计时应注意以下几点:
1.外电路:负极(________较强的物质) e- 正极(________较强的物质)。
2.内电路:将两电极浸入_____________中,阴、阳离子作________________。
还原性
氧化性
电解质溶液
定向运动
3.闭合回路
负
正
原电池的设计
原电池原理的应用
(1)增大氧化还原反应速率。
如实验室用Zn和稀硫酸反应制H2,常用粗锌,它产生H2的速率大。原因是粗锌中的杂质和锌、稀硫酸形成原电池,增大了锌与稀硫酸的反应速率,使产生H2的速率增大。
(2)比较金属的活动性强弱。
原电池中,负极一般为活动性较强的金属,正极一般为活动性较弱的金属。
(3)设计原电池
例如,以2FeCl3+Cu=2FeCl2+CuCl2为依据,设计一个原电池。
①将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应。
本例的电极反应为 负极:Cu-2e-=Cu2+,正极:2Fe3++2e-=2Fe2+。
原电池原理的应用
②确定电极材料。
如发生氧化反应的物质为金属单质,可用该金属直接作负极;如为气体(如H2)或溶液中的还原性离子,可用惰性电极(如Pt、石墨棒)作负极。
发生还原反应的电极材料一般不如负极材料活泼。
本例中可用铜棒作负极,用铂丝或石墨棒作正极。
原电池原理的应用
③确定电解质溶液。
电解质是使负极放电的物质,因此电解质溶液一般能够与负极发生反应。或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。但如果两个半反应分别在两个容器中进行(中间连接盐桥),则左右两个容器中的电解质溶液选择与电极材料相同的阳离子。
如本例中可用FeCl3溶液作电解质溶液。
原电池原理的应用
④构成闭合回路:将电极用导线连接,使之构成闭合回路。
设计原电池时,若氧化还原反应方程式中无明确的电解质溶液,可用水作电解质,但为了增强其导电性,通常加入强碱或强酸。如燃料电池,水中一般要加入KOH或H2SO4。
原电池原理的应用
第一节 原电池
课时1
原电池的工作原理
第四章 化学反应与电能
1.原电池是将 能转变为 能的装置。 2.原电池原理(以铜锌原电池、硫酸铜溶液作电解质溶液为例)
化学
电
自学检测
知识回顾
思考:铜片会有气泡产生吗?为什么?
活动一
“热敷贴”中氯化钠起到什么作用 炭粉的主要作用是什么 下列各装置能形成原电池的有哪些 总结原电池的构成条件。
氯化钠溶于水形成电解质溶液。炭粉作原电池的正极材料,与铁、氯化钠溶液构成原电池,从而加速铁的氧化。
原电池构成的条件:①有活性不同的两个电极;②有电解质溶液;③形成闭合回路;④能自发进行的氧化还原反应。
上述实验设计的电池因锌与CuSO4溶液直接接触能反应,时间稍长电流很快就减弱,效率比较低,不适合实际应用。若设计成双液原电池,避免了Cu2+在锌片上直接还原析出铜,以延长电池的放电时间,提高供电效率。
(1)下图装置能构成原电池吗 若不能,怎样才能构成原电池
(2)盐桥有什么作用
(3)叙述实验现象,写出电极反应式及电池反应。
(4)分析盐桥中离子的移动方向。
活动二
因左边烧杯的溶液中c(Zn2+)增大,右边烧杯的溶液中c(Cu2+)减小,为了使溶液保持电中性,盐桥中的Cl-移向负极区(ZnSO4溶液),K+移向正极区(CuSO4溶液)。
①构成闭合回路,形成原电池。
②盐桥中阴、阳离子定向迁移,电解质溶液呈电中性。
③避免电极与电解质溶液直接反应,放电更持久。
盐桥的作用:
思考与讨论
1.课本中图4-1所示的铜锌原电池工作时,电子导线中的运动方向是怎样的?阴离子和阳离子在电解质溶液中的运动方向是怎样的?
2.铜锌原电池可以看作由两个半电池组成,一个发生氧化反应,另一个发生还原反应。试分别写出两个电极上的反应及总反应的离子方程式。
铜锌原电池工作时,电子由锌片沿导线移向铜片,阴离子(Cl-,SO42-)在电解质溶液中移向锌片,阳离子(K+,Cu2+)移向铜片
3.请结合课本中图4-1绘制反映原电池工作原理的示意图,并与同学交流。示意图要求包括以下内容:
(1)注明原电池的组成;
(2)标明氧化反应和还原反应发生的区域
(3)标明电子的运动方向和阴离子、阳离子的迁移方向。
思考与讨论
双液电池工作原理示意图
微思考
1.盐桥中有电子流过吗 溶液中的离子能通过盐桥吗 溶液中的SO42-浓度如何变化
2.原电池的负极失去电子的总数与正极得到电子的总数有什么关系
没有;不能;不变。
相等。
3.试判断图中原电池装置的正、负极。你认为判断原电池正、负极时需要注意什么
甲池:Mg作负极,Al作正极;乙池:Al作负极,Mg作正极。需要注意:在原电池中,失电子(电子流出)发生氧化反应的一极为负极,得电子(电子流入)发生还原反应的一极为正极。在判断原电池正、负极时,不能只考虑金属活动性的相对强弱,还要考虑其能否与电解质溶液发生氧化还原反应。
微思考
试写出“热敷贴”中正、负极的电极反应式。并归纳原电池的电极反应式的书写思路。
负极:Fe-2e- = Fe2+;正极:O2+4e-+2H2O = 4OH-。
电极反应方程式的书写
书写思路:
1.先判断原电池的正、负极,即找出氧化剂和还原剂;
2.再结合电解质溶液的酸碱性确定还原产物和氧化产物;
3.根据情况补充H+、OH-、H2O。
3.然后根据电荷守恒、原子守恒等书写并配平电极反应式。
原电池的设计
从理论上讲,能自发进行的氧化还原反应均可以设计成原电池,实际设计时应注意以下几点:
1.外电路:负极(________较强的物质) e- 正极(________较强的物质)。
2.内电路:将两电极浸入_____________中,阴、阳离子作________________。
还原性
氧化性
电解质溶液
定向运动
3.闭合回路
负
正
原电池的设计
原电池原理的应用
(1)增大氧化还原反应速率。
如实验室用Zn和稀硫酸反应制H2,常用粗锌,它产生H2的速率大。原因是粗锌中的杂质和锌、稀硫酸形成原电池,增大了锌与稀硫酸的反应速率,使产生H2的速率增大。
(2)比较金属的活动性强弱。
原电池中,负极一般为活动性较强的金属,正极一般为活动性较弱的金属。
(3)设计原电池
例如,以2FeCl3+Cu=2FeCl2+CuCl2为依据,设计一个原电池。
①将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应。
本例的电极反应为 负极:Cu-2e-=Cu2+,正极:2Fe3++2e-=2Fe2+。
原电池原理的应用
②确定电极材料。
如发生氧化反应的物质为金属单质,可用该金属直接作负极;如为气体(如H2)或溶液中的还原性离子,可用惰性电极(如Pt、石墨棒)作负极。
发生还原反应的电极材料一般不如负极材料活泼。
本例中可用铜棒作负极,用铂丝或石墨棒作正极。
原电池原理的应用
③确定电解质溶液。
电解质是使负极放电的物质,因此电解质溶液一般能够与负极发生反应。或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。但如果两个半反应分别在两个容器中进行(中间连接盐桥),则左右两个容器中的电解质溶液选择与电极材料相同的阳离子。
如本例中可用FeCl3溶液作电解质溶液。
原电池原理的应用
④构成闭合回路:将电极用导线连接,使之构成闭合回路。
设计原电池时,若氧化还原反应方程式中无明确的电解质溶液,可用水作电解质,但为了增强其导电性,通常加入强碱或强酸。如燃料电池,水中一般要加入KOH或H2SO4。
原电池原理的应用
