第五章——实践与探究测定雨水PH及酸雨防治 教学课件 (共29张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章——实践与探究测定雨水PH及酸雨防治 教学课件 (共29张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 302.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 08:56:02 | ||
图片预览







文档简介
(共29张PPT)
2019人教版第二册
第五章 化工生产中的重要非金属元素
研究与实践
雨水PH测定及酸雨防治选择
1.核心素养:
(1)科学探究与创新意识:能发现和提出有探究价值的问题,能从问题和假设出发,依据研究目的,设计探究方案。
(2)科学态度与社会责任:具有探索未知、崇尚真理的意识;具有节约资源、保护环境的可持续发展意识。
学习目标
2.素养目标:
通过课题的探究学习,掌握硫、氮及其化合物的相关知识,初步养成绿色应用意识,增强社会责任感。
课题任务:
以硫及其化合物、氮及其化合物的知识为载体,了解酸雨,解决酸雨的防治问题
柳州蝶变:从“酸雨之都”到“宜居花城”在上世纪80至90年代,广西柳州传统重工业聚集,粗放型发展模式使大气遭到严重污染,年酸雨出现频率最高达98%,被列为全国四大“酸雨之都”之一。
作为广西最大的工业基地和西南工业重镇,柳州市多年来一直努力在工业发展与环境保护之间寻求平衡,现已成为践行绿色发展理念的城市典范。近20多年来,柳州市经过酸雨治理、生态建设和新型工业化探索,已经由过去的“酸雨之都”蜕变为“宜居花城”。
情景创设
在绿色发展理念的指引下,柳州实现了经济效益与环境效益的统一,工业发展与生态环境的良性互动,走出了一条“生态工业城”的发展新路。如今柳州已成为国家低碳试点城市、国家循环经济示范城市。
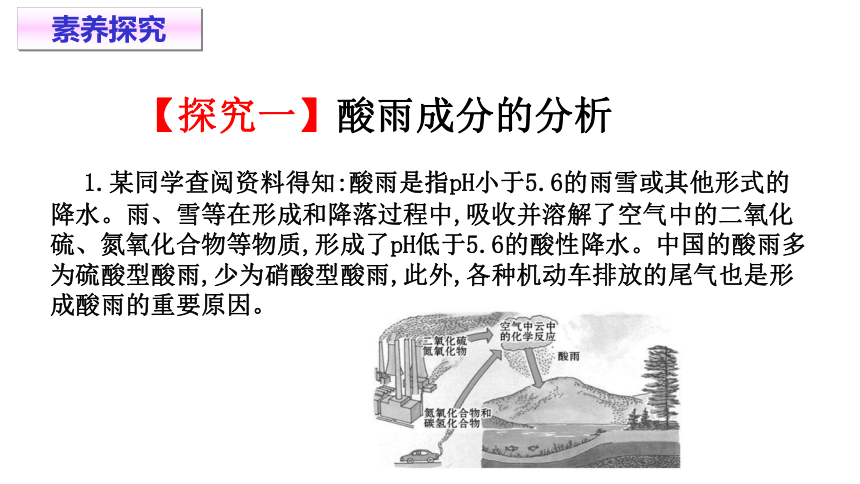
1.某同学查阅资料得知:酸雨是指pH小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化合物等物质,形成了pH低于5.6的酸性降水。中国的酸雨多为硫酸型酸雨,少为硝酸型酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
素养探究
【探究一】酸雨成分的分析
(1)酸雨是指pH小于5.6的雨雪或其他形式的降水。以5.6为标准是因为正常雨水的pH大约为5.6,请分析原因。
提示:空气中含有CO2, CO2与雨水反应生成碳酸,故雨水的pH约为5.6。
(2) 硝酸型酸雨是如何形成?
提示:氮的氧化物NO2、NO与雨水反应生成硝酸,使雨水的pH小于5.6,发生的反应为2NO+O2==== 2NO2、3NO2+H2O====2HNO3+NO。
提示:酸雨中的阴离子主要是硝酸根离子和硫酸根离子,通过硫酸根离子和硝酸根离子的浓度比值将酸雨的类型分为三类,
如下:(1)硫酸型或燃煤型:硫酸根/硝酸根≥3
(2)混合型:0.5<硫酸根/硝酸根<3
(3)硝酸型或燃油型:硫酸根/硝酸根≤0.5。
由此,可以根据一个地方的酸雨类型来初步判断酸雨的主要影响因素。
(3)怎样判断酸雨的类型
(4)某测定酸雨的站点对取得的酸雨样品进行了pH的测定,随时间推移,得到了如下实验数据。试分析酸雨的类型、形成原因及pH随时间变化的原因。
时间(h) 开始 8 16 24 32 40 48
pH 5.0 4.8 4.5 4.3 4.2 4.0 4.0
提示:隔一段时间检测,发现pH逐渐减小,酸性增强,发生的反应为2H2SO3+O2====2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,由此可以得出酸雨形成过程为二氧化硫与水反应SO2+H2O====H2SO3,酸雨为硫酸型酸雨。
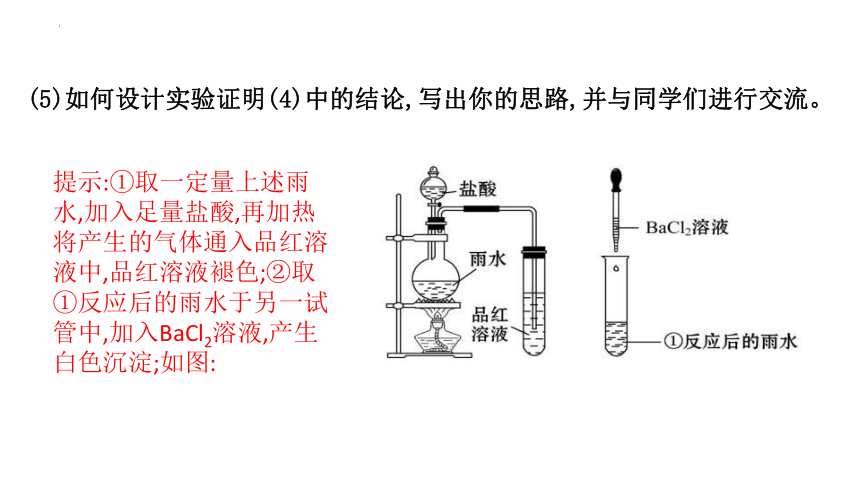
(5)如何设计实验证明(4)中的结论,写出你的思路,并与同学们进行交流。
提示:①取一定量上述雨水,加入足量盐酸,再加热将产生的气体通入品红溶液中,品红溶液褪色;②取①反应后的雨水于另一试管中,加入BaCl2溶液,产生白色沉淀;如图:
1.用pH试纸测定酸雨的pH的操作是什么
思考提升
提示:取一片pH试纸放在洁净的玻璃片上,用洁净的玻璃棒蘸取雨水滴在试纸的中央,待颜色不变后与标准比色卡比对,确定pH。
2.现有相同的雨水样品2份,两位同学在不同时间测定该雨水样品的pH,所得数据如下:
测试时间/h pH
甲同学 0 4.73
乙同学 2 4.56
提示:这是由于雨水中的H2SO3被空气中氧气氧化所致: 2H2SO3+O2====2H2SO4,使溶液的氢离子浓度增大。
雨水样品的pH变化的原因是什么
提示:含有硫的煤(用S代替)→SO2→H2SO3→H2SO4
①S+O2 SO2, ②SO2+H2O====H2SO3,
③2H2SO3+O2====2H2SO4。
3.用化学方程式描述硫酸型酸雨的形成过程
提示:由于粗放型发展模式,使二氧化硫和氮氧化物的排放量日渐增多,使大气遭到严重污染,酸雨的问题越来越突出。主要的危害有:
2. “酸雨之都”受到哪些危害?
(1)酸雨可导致土壤酸化。
土壤中含有大量铝的氢氧化物,土壤酸化后,可加速土壤中含铝的原生和次生矿物风化而释放大量铝离子,形成植物可吸收形态的铝化合物。植物长期和过量吸收铝,会中毒,甚至死亡。
【探究二】酸雨的危害
(2)酸雨能诱发植物病虫害,使农作物大幅度减产。大豆、蔬菜也容易受酸雨危害,导致蛋白质含量和产量下降。
(3)酸雨能使非金属建筑材料(混凝土、砂浆和灰砂砖)表面硬化水泥溶解,出现空洞和裂缝,导致强度降低,从而损坏建筑物。
3.通过近20年的治理,柳州空气的二氧化硫含量已于2006年达标。
(1)把煤燃烧产生的废气通入CaCO3与水形成浆状物,可以起到很好的脱硫效果,同时制得副产品石膏。试写出有关反应的化学方程式。
【探究三】防止酸雨的措施的选择
提示:由于亚硫酸的酸性大于碳酸,故发生的反应为SO2+CaCO3====CaSO3+CO2,CaSO3再被氧气氧化:2CaSO3+O2====2CaSO4。
(2)为了持续打好环保战,柳州市政府推广绿色低碳的出行方式,大力支持当地清洁车辆的生产与使用。如使用纯电动汽车,这些措施可以大大减少汽车尾气的排放,汽车尾气的主要污染气体有哪些 造成的主要环境危害有哪些
提示:汽车尾气的主要污染气体为CO、NO、NO2等,对环境的主要危害有光化学烟雾、酸雨等。
(3)为了彻底修复城市生态,进一步改造城市风貌,柳州市不仅做了“节能减排”的减法,还进行“绿色覆盖”的加法,实施了一系列城市绿化建设工程。这些做法体现了什么环境治理的思想
提示:柳州市的做法体现了环境治理的两种措施:①控制进入大气、土壤和水体的碳、硫和氮等化合物的量;②增强生态系统对碳、硫和氮等化合物的吸收能力。
提示:①开发新能源,如氢能、太阳能、水能、潮汐能、地热能等。
②使用燃煤脱硫技术,减少二氧化硫排放。
③工业生产排放气体处理达标后再排放。
④少开车,多乘坐公共交通工具出行。
⑤使用天然气等较清洁能源,少用煤。
(4)通过上面的分析你能提出哪些酸雨的防治措施
4.水华指淡水水体中藻类大量繁殖的一种自然生态现象,是藻类大量繁殖后使水体呈现蓝色或绿色的一种现象。你能解释原因吗 可以采取什么措施防止这种现象的发生
【探究四】迁移应用1
提示:水华主要是由于生活及工农业生产中含有大量氮、磷的废污水进入水体后,水体富营养化,引起藻类大量繁殖。为了防止水体富营养化可采取以下措施:①严控水域附近建设氮肥厂、磷肥厂;②禁止含磷洗涤剂的使用;③工业、生活废水去营养化处理;④合理使用氮肥、磷肥。
5.中国气象局气候变化中心发布《中国气候变化蓝皮书(2019)》。报告指出,1992~2018年,中国酸雨总体呈减弱、减少趋势;2018年,全国平均降水pH为5.90,全国平均酸雨和强酸雨频率均为1992年以来的最低值。酸雨与工业化的快速发展及化石燃料的大量使用有关。某工业烟气中含有CO、CO2、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如下图所示。
【探究四】迁移应用2
(1)SO2的浓度:Ⅰ________Ⅱ(填“>”或“<”)。
(2)在这个过程中可以循环使用的物质是________。
(3)上述吸收过程中主要反应的化学方程式是________。
(4)解吸过程需要加热,在这个过程中常伴有少量
产生。
①证明产物中含 的实验方法是取少量解吸产物的溶液,________(填操作和现象)。
②产生 的原因是___________________________。
(3)亚硫酸钠溶液吸收二氧化硫反应生成亚硫酸氢钠,反应方程式为Na2SO3+SO2+H2O====2NaHSO3;
(4)①硫酸根的检验方法是先加入过量盐酸,不产生沉淀,再加入BaCl2溶液,有白色沉淀生成;
②亚硫酸根或亚硫酸氢根中的硫为+4价,易被空气中的
氧气氧化为+6价的硫,即硫酸根,反应方程式为2 +O2====2 。
【解析】(1)(2)烟气中含有CO、CO2、N2、SO2等气体,通过亚硫酸钠吸收二氧化硫,因此富集了二氧化硫,亚硫酸氢钠受热易分解,生成二氧化硫、水和亚硫酸钠,因此SO2的浓度:Ⅰ<Ⅱ,可以循环使用的是Na2SO3;
答案:(1)< (2)Na2SO3 (3)Na2SO3+SO2+H2O====2NaHSO3
(4)①先加入过量盐酸,不产生沉淀,再加入BaCl2溶液,
有白色沉淀生成 ②加热过程中, (或 )被空
气中的氧气氧化成 (或2 +O2====2 )
某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
①将一片红色的玫瑰花瓣浸在一份水样中;
②向雨水试样中滴加氯化钡溶液,有白色沉淀生成;
(1)一段时间后,观察到玫瑰花瓣红色变浅,原因是________________。
(2)生成白色沉淀的离子方程式是_________________。
素养提升
第二组,拟用如图装置定量分析空气中SO2的含量:
(3)通入空气前应进行的实验操作是___________________________________;酸性KMnO4溶液中导管末端做成球状多孔结构的作用是__ 。
(4)已知:5SO2+2 +2H2O====5 +2Mn2++4H+。随着空气的不断通入,酸性高锰酸钾溶液颜色逐渐变浅直至褪色,说明SO2具有________________性。
(5)若实验中气体流速为a L·min-1,酸性KMnO4溶液的体积为b L,其浓度为c mol·L-1,从气体通入到紫色恰好褪去,用时5 min,则空气中二氧化硫的含量为________g·L-1。
【解析】(1)玫瑰花瓣颜色变浅,则酸雨中存在漂白物质,即酸雨中的SO2有漂白作用。
(2)酸雨中含有硫酸,可以与钡离子结合生成沉淀。
(3)有气体参与的体系应先进行气密性检查;多孔结构表面积增大,使SO2尽可能地与高锰酸钾反应,有利于SO2的充分吸收。
(4)根据反应可知5SO2+2 +2H2O====5 +2Mn2++4H+,SO2与酸性高锰酸钾溶液反应,硫从+4价变为+6价,酸性高锰酸钾溶液颜色逐渐变浅直至褪色,说明SO2具有还原性。
(5)高锰酸钾的物质的量为c mol·L-1×b L=bc mol,根据化学方程式5SO2+
2 +2H2O====5 +2Mn2++4H+,吸收的SO2物质的量为 bc mol,质量为64 g·mol-1×
bc mol=160 bc g;气体体积为a L·min-1×5 min=5a L,SO2的含量为 g·L-1。
答案:(1)SO2有漂白作用
(2)Ba2++ ====BaSO4↓
(3)气密性检查 增大接触面积,有利于SO2的充分
吸收
(4)还原 (5)
1.科学态度与社会责任:运用所学的化学知识和方法解释生产、生活中简单的化学问题;在实践中逐步形成节约成本、循环利用、保护环境等观念。
2.科学探究与创新意识:能根据文献和实际需要提出综合性的探究课题,根据假设提出多种探究方案,并评价和优化方案。
3.科学态度与社会责任:具有理论联系实际的观念,有将化学成果应用于生产、生活的意识,能依据实际条件并运用所学的化学知识和方法解决生产、生活中简单的化学问题。
素养评价
2019人教版第二册
第五章 化工生产中的重要非金属元素
研究与实践
雨水PH测定及酸雨防治选择
1.核心素养:
(1)科学探究与创新意识:能发现和提出有探究价值的问题,能从问题和假设出发,依据研究目的,设计探究方案。
(2)科学态度与社会责任:具有探索未知、崇尚真理的意识;具有节约资源、保护环境的可持续发展意识。
学习目标
2.素养目标:
通过课题的探究学习,掌握硫、氮及其化合物的相关知识,初步养成绿色应用意识,增强社会责任感。
课题任务:
以硫及其化合物、氮及其化合物的知识为载体,了解酸雨,解决酸雨的防治问题
柳州蝶变:从“酸雨之都”到“宜居花城”在上世纪80至90年代,广西柳州传统重工业聚集,粗放型发展模式使大气遭到严重污染,年酸雨出现频率最高达98%,被列为全国四大“酸雨之都”之一。
作为广西最大的工业基地和西南工业重镇,柳州市多年来一直努力在工业发展与环境保护之间寻求平衡,现已成为践行绿色发展理念的城市典范。近20多年来,柳州市经过酸雨治理、生态建设和新型工业化探索,已经由过去的“酸雨之都”蜕变为“宜居花城”。
情景创设
在绿色发展理念的指引下,柳州实现了经济效益与环境效益的统一,工业发展与生态环境的良性互动,走出了一条“生态工业城”的发展新路。如今柳州已成为国家低碳试点城市、国家循环经济示范城市。
1.某同学查阅资料得知:酸雨是指pH小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化合物等物质,形成了pH低于5.6的酸性降水。中国的酸雨多为硫酸型酸雨,少为硝酸型酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
素养探究
【探究一】酸雨成分的分析
(1)酸雨是指pH小于5.6的雨雪或其他形式的降水。以5.6为标准是因为正常雨水的pH大约为5.6,请分析原因。
提示:空气中含有CO2, CO2与雨水反应生成碳酸,故雨水的pH约为5.6。
(2) 硝酸型酸雨是如何形成?
提示:氮的氧化物NO2、NO与雨水反应生成硝酸,使雨水的pH小于5.6,发生的反应为2NO+O2==== 2NO2、3NO2+H2O====2HNO3+NO。
提示:酸雨中的阴离子主要是硝酸根离子和硫酸根离子,通过硫酸根离子和硝酸根离子的浓度比值将酸雨的类型分为三类,
如下:(1)硫酸型或燃煤型:硫酸根/硝酸根≥3
(2)混合型:0.5<硫酸根/硝酸根<3
(3)硝酸型或燃油型:硫酸根/硝酸根≤0.5。
由此,可以根据一个地方的酸雨类型来初步判断酸雨的主要影响因素。
(3)怎样判断酸雨的类型
(4)某测定酸雨的站点对取得的酸雨样品进行了pH的测定,随时间推移,得到了如下实验数据。试分析酸雨的类型、形成原因及pH随时间变化的原因。
时间(h) 开始 8 16 24 32 40 48
pH 5.0 4.8 4.5 4.3 4.2 4.0 4.0
提示:隔一段时间检测,发现pH逐渐减小,酸性增强,发生的反应为2H2SO3+O2====2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,由此可以得出酸雨形成过程为二氧化硫与水反应SO2+H2O====H2SO3,酸雨为硫酸型酸雨。
(5)如何设计实验证明(4)中的结论,写出你的思路,并与同学们进行交流。
提示:①取一定量上述雨水,加入足量盐酸,再加热将产生的气体通入品红溶液中,品红溶液褪色;②取①反应后的雨水于另一试管中,加入BaCl2溶液,产生白色沉淀;如图:
1.用pH试纸测定酸雨的pH的操作是什么
思考提升
提示:取一片pH试纸放在洁净的玻璃片上,用洁净的玻璃棒蘸取雨水滴在试纸的中央,待颜色不变后与标准比色卡比对,确定pH。
2.现有相同的雨水样品2份,两位同学在不同时间测定该雨水样品的pH,所得数据如下:
测试时间/h pH
甲同学 0 4.73
乙同学 2 4.56
提示:这是由于雨水中的H2SO3被空气中氧气氧化所致: 2H2SO3+O2====2H2SO4,使溶液的氢离子浓度增大。
雨水样品的pH变化的原因是什么
提示:含有硫的煤(用S代替)→SO2→H2SO3→H2SO4
①S+O2 SO2, ②SO2+H2O====H2SO3,
③2H2SO3+O2====2H2SO4。
3.用化学方程式描述硫酸型酸雨的形成过程
提示:由于粗放型发展模式,使二氧化硫和氮氧化物的排放量日渐增多,使大气遭到严重污染,酸雨的问题越来越突出。主要的危害有:
2. “酸雨之都”受到哪些危害?
(1)酸雨可导致土壤酸化。
土壤中含有大量铝的氢氧化物,土壤酸化后,可加速土壤中含铝的原生和次生矿物风化而释放大量铝离子,形成植物可吸收形态的铝化合物。植物长期和过量吸收铝,会中毒,甚至死亡。
【探究二】酸雨的危害
(2)酸雨能诱发植物病虫害,使农作物大幅度减产。大豆、蔬菜也容易受酸雨危害,导致蛋白质含量和产量下降。
(3)酸雨能使非金属建筑材料(混凝土、砂浆和灰砂砖)表面硬化水泥溶解,出现空洞和裂缝,导致强度降低,从而损坏建筑物。
3.通过近20年的治理,柳州空气的二氧化硫含量已于2006年达标。
(1)把煤燃烧产生的废气通入CaCO3与水形成浆状物,可以起到很好的脱硫效果,同时制得副产品石膏。试写出有关反应的化学方程式。
【探究三】防止酸雨的措施的选择
提示:由于亚硫酸的酸性大于碳酸,故发生的反应为SO2+CaCO3====CaSO3+CO2,CaSO3再被氧气氧化:2CaSO3+O2====2CaSO4。
(2)为了持续打好环保战,柳州市政府推广绿色低碳的出行方式,大力支持当地清洁车辆的生产与使用。如使用纯电动汽车,这些措施可以大大减少汽车尾气的排放,汽车尾气的主要污染气体有哪些 造成的主要环境危害有哪些
提示:汽车尾气的主要污染气体为CO、NO、NO2等,对环境的主要危害有光化学烟雾、酸雨等。
(3)为了彻底修复城市生态,进一步改造城市风貌,柳州市不仅做了“节能减排”的减法,还进行“绿色覆盖”的加法,实施了一系列城市绿化建设工程。这些做法体现了什么环境治理的思想
提示:柳州市的做法体现了环境治理的两种措施:①控制进入大气、土壤和水体的碳、硫和氮等化合物的量;②增强生态系统对碳、硫和氮等化合物的吸收能力。
提示:①开发新能源,如氢能、太阳能、水能、潮汐能、地热能等。
②使用燃煤脱硫技术,减少二氧化硫排放。
③工业生产排放气体处理达标后再排放。
④少开车,多乘坐公共交通工具出行。
⑤使用天然气等较清洁能源,少用煤。
(4)通过上面的分析你能提出哪些酸雨的防治措施
4.水华指淡水水体中藻类大量繁殖的一种自然生态现象,是藻类大量繁殖后使水体呈现蓝色或绿色的一种现象。你能解释原因吗 可以采取什么措施防止这种现象的发生
【探究四】迁移应用1
提示:水华主要是由于生活及工农业生产中含有大量氮、磷的废污水进入水体后,水体富营养化,引起藻类大量繁殖。为了防止水体富营养化可采取以下措施:①严控水域附近建设氮肥厂、磷肥厂;②禁止含磷洗涤剂的使用;③工业、生活废水去营养化处理;④合理使用氮肥、磷肥。
5.中国气象局气候变化中心发布《中国气候变化蓝皮书(2019)》。报告指出,1992~2018年,中国酸雨总体呈减弱、减少趋势;2018年,全国平均降水pH为5.90,全国平均酸雨和强酸雨频率均为1992年以来的最低值。酸雨与工业化的快速发展及化石燃料的大量使用有关。某工业烟气中含有CO、CO2、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如下图所示。
【探究四】迁移应用2
(1)SO2的浓度:Ⅰ________Ⅱ(填“>”或“<”)。
(2)在这个过程中可以循环使用的物质是________。
(3)上述吸收过程中主要反应的化学方程式是________。
(4)解吸过程需要加热,在这个过程中常伴有少量
产生。
①证明产物中含 的实验方法是取少量解吸产物的溶液,________(填操作和现象)。
②产生 的原因是___________________________。
(3)亚硫酸钠溶液吸收二氧化硫反应生成亚硫酸氢钠,反应方程式为Na2SO3+SO2+H2O====2NaHSO3;
(4)①硫酸根的检验方法是先加入过量盐酸,不产生沉淀,再加入BaCl2溶液,有白色沉淀生成;
②亚硫酸根或亚硫酸氢根中的硫为+4价,易被空气中的
氧气氧化为+6价的硫,即硫酸根,反应方程式为2 +O2====2 。
【解析】(1)(2)烟气中含有CO、CO2、N2、SO2等气体,通过亚硫酸钠吸收二氧化硫,因此富集了二氧化硫,亚硫酸氢钠受热易分解,生成二氧化硫、水和亚硫酸钠,因此SO2的浓度:Ⅰ<Ⅱ,可以循环使用的是Na2SO3;
答案:(1)< (2)Na2SO3 (3)Na2SO3+SO2+H2O====2NaHSO3
(4)①先加入过量盐酸,不产生沉淀,再加入BaCl2溶液,
有白色沉淀生成 ②加热过程中, (或 )被空
气中的氧气氧化成 (或2 +O2====2 )
某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
①将一片红色的玫瑰花瓣浸在一份水样中;
②向雨水试样中滴加氯化钡溶液,有白色沉淀生成;
(1)一段时间后,观察到玫瑰花瓣红色变浅,原因是________________。
(2)生成白色沉淀的离子方程式是_________________。
素养提升
第二组,拟用如图装置定量分析空气中SO2的含量:
(3)通入空气前应进行的实验操作是___________________________________;酸性KMnO4溶液中导管末端做成球状多孔结构的作用是__ 。
(4)已知:5SO2+2 +2H2O====5 +2Mn2++4H+。随着空气的不断通入,酸性高锰酸钾溶液颜色逐渐变浅直至褪色,说明SO2具有________________性。
(5)若实验中气体流速为a L·min-1,酸性KMnO4溶液的体积为b L,其浓度为c mol·L-1,从气体通入到紫色恰好褪去,用时5 min,则空气中二氧化硫的含量为________g·L-1。
【解析】(1)玫瑰花瓣颜色变浅,则酸雨中存在漂白物质,即酸雨中的SO2有漂白作用。
(2)酸雨中含有硫酸,可以与钡离子结合生成沉淀。
(3)有气体参与的体系应先进行气密性检查;多孔结构表面积增大,使SO2尽可能地与高锰酸钾反应,有利于SO2的充分吸收。
(4)根据反应可知5SO2+2 +2H2O====5 +2Mn2++4H+,SO2与酸性高锰酸钾溶液反应,硫从+4价变为+6价,酸性高锰酸钾溶液颜色逐渐变浅直至褪色,说明SO2具有还原性。
(5)高锰酸钾的物质的量为c mol·L-1×b L=bc mol,根据化学方程式5SO2+
2 +2H2O====5 +2Mn2++4H+,吸收的SO2物质的量为 bc mol,质量为64 g·mol-1×
bc mol=160 bc g;气体体积为a L·min-1×5 min=5a L,SO2的含量为 g·L-1。
答案:(1)SO2有漂白作用
(2)Ba2++ ====BaSO4↓
(3)气密性检查 增大接触面积,有利于SO2的充分
吸收
(4)还原 (5)
1.科学态度与社会责任:运用所学的化学知识和方法解释生产、生活中简单的化学问题;在实践中逐步形成节约成本、循环利用、保护环境等观念。
2.科学探究与创新意识:能根据文献和实际需要提出综合性的探究课题,根据假设提出多种探究方案,并评价和优化方案。
3.科学态度与社会责任:具有理论联系实际的观念,有将化学成果应用于生产、生活的意识,能依据实际条件并运用所学的化学知识和方法解决生产、生活中简单的化学问题。
素养评价
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
