1.2.1有机化合物的分离提纯课件(共13张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.1有机化合物的分离提纯课件(共13张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 09:01:24 | ||
图片预览




文档简介
(共13张PPT)
第二节 有机化合物的结构特点
第一章 有机化合物的结构特点与研究方法
第一课时
有机化合物的分离、提纯
科学 社会 技术 P21
青蒿素的提取:葛洪《肘后备急方》 “青蒿一握,以水升渍,绞取汁,尽服之。”
20世纪70年代初,我国屠喲呦等科学家使用乙醚从中药中提取并用柱色谱分离得到抗疟有效成分青蒿素,随后展开了对青蒿素分子结构的测定和相关医学研究。国科学院上海有机化学研究所和中国中中医研究院中
从上述信息,你能总结出研究有机化合物的一般方法吗?
药研究所等单位的科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。 经红外光谱和核磁共振谱分析,确定青嵩素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(一0一0一)。1975年底, 我国科学家通过X射线衍射最终测定了青蒿素的分子结构。
【情境引入】
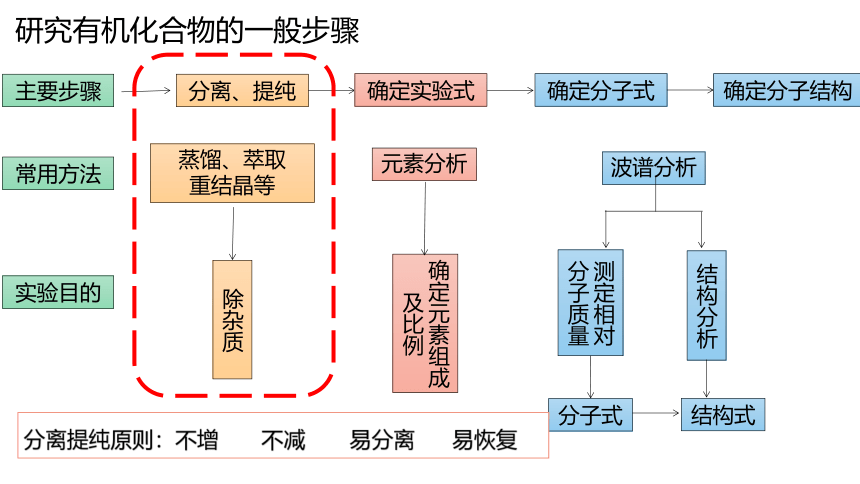
主要步骤
分离、提纯
波谱分析
研究有机化合物的一般步骤
除杂质
元素分析
确定元素组成及比例
测定相对
分子质量
分子式
结构分析
结构式
确定实验式
确定分子式
确定分子结构
常用方法
蒸馏、萃取
重结晶等
实验目的
分离提纯原则:不增 不减 易分离 易恢复
有机化合物的分离、提纯
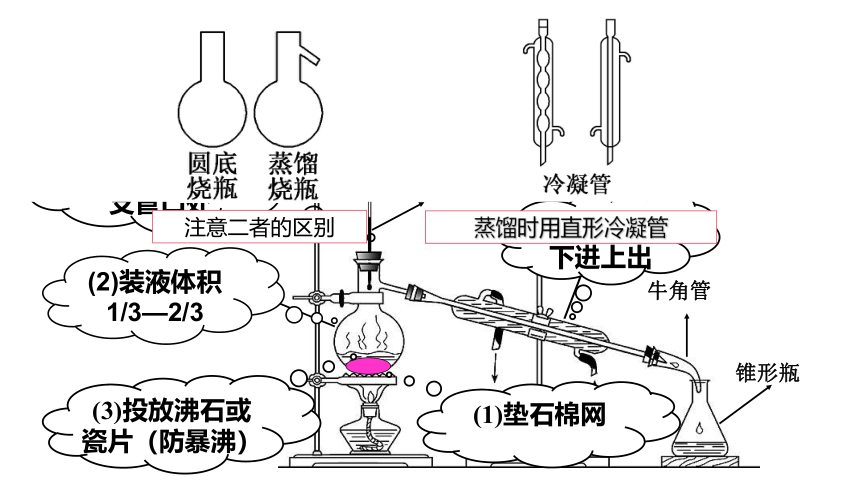
冷凝管
圆底烧瓶
牛角管
锥形瓶
温度计
(4)温度计水银球置于蒸馏烧瓶支管口处
(5)冷凝水下进上出
(3)投放沸石或瓷片(防暴沸)
(1)垫石棉网
(2)装液体积1/3—2/3
蒸馏—适用范围
适用条件
有机化合物的热稳定性较高
有机化合物与杂质的沸点相差较大
相互溶解的液体混合物
易氧化、易分解的有机物采用减压蒸馏
注意二者的区别
蒸馏时用直形冷凝管
萃取
液-液萃取
固-液萃取
利用待分离组分在两种互不相溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程
利用溶剂从固体物质中溶解出待分离组分的过程
有机化合物的分离、提纯
萃取剂的选择依据
(笔记)
常用萃取剂
乙醚、乙酸乙酯、二氯甲烷、苯、四氯化碳等
萃取剂和原溶剂互不相溶
溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
萃取剂与原溶液不反应
主要实验仪器:
分液漏斗
烧杯
铁架台
液-液萃取
主要实验步骤:
萃取
液-液萃取
有机化合物的分离、提纯
用CCl4萃取碘水中的碘单质
碘水
分液:将萃取后两种互不相溶的液体分开的操作
检漏:分液漏斗使用前需检漏(分液漏斗内液体不超过容积的2/3)
振荡、放气:双手托住分液漏斗,右手按住玻璃塞,平放用力振荡(振荡后注意放气)
静置分层:打开上端玻璃塞(有利于分层),静置(下端尖嘴部分紧靠烧杯内壁)
分液:密度大的液体从下面放出,密度相对小的液体从上面倒出(打开上方的玻璃塞)
重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度
不与被提纯物质发生化学反应
杂质在此溶剂中溶解度很小或者很大,易于除去
被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,高温时,溶解度大,低温时,溶解度小,冷却后易于结晶析出
利用被提纯物质与杂质在同一溶剂中的溶解度不同
适用范围
提纯固体有机化合物的常用方法
提纯原理
溶剂要求
有机化合物的分离、提纯
重结晶
【探究实验】重结晶法提纯苯甲酸
【问题】某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?
其结构可表示为
苯甲酸微溶于水,易溶于乙醇等有机溶剂
苯甲酸在水中的溶解度如下
温度 25℃ 50℃ 95℃
苯甲酸 0.34g 0.85g 6.8g
NaCl 36.0 37.0 39.1
有机化合物的分离、提纯
【探究实验】重结晶法提纯苯甲酸
【资料】
《教材》P14中【讨论】
(1)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(2)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
(3)如何检验提纯后的苯甲酸中氯化钠已经被除净?
加热:使苯甲酸溶解;趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出
加热溶解——搅拌,加速苯甲酸溶解 过滤——引流
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明已被除净
色谱法 P16
色谱法起源于20世纪初,1903年俄国植物学家米哈伊尔·茨维特用碳酸钙填充竖立的玻璃管,以石油醚洗脱植物色素的提取液,经过一段时间洗脱之后,植物色素在碳酸钙柱中实现分离,由一条色带分散为数条平行的色带,从而分离得到了三种色素。茨维特将这种分离、提纯有机物的方法命名为色谱法。
25年后德国化学家库恩再分离、提纯胡萝卜素异构体和维生素结构中,应用色谱法,获得了1938年诺贝尔化学奖。
此后,色谱法成为分离、提纯有机物必不可少的方法。并发展出了纸上色谱法、薄层色谱法、气相色谱法和液相色谱法等。
有机化合物的分离、提纯
本节小结
有机化合物的分离、提纯
1.下列实验中,所采取的分离方法与对应原理 都正确的是
选项 目的 分离方法 原理
A. 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B. 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C. 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D. 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
D
是利用二者在不同温度下溶解度变化差别很大,使用重结晶法。
×
【学习评价】
2.根据右图信息,下列实验的步骤是什么?
(1)提纯KNO3、NaCl (少量)混合物中KNO3
(2)提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中。
溶解,蒸发浓缩,冷却结晶,过滤得到KNO3晶体,杂质NaCl留在滤液中。
3.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
氯化铵和硫酸钠的溶解度随温度变化图
20
30
40
50
60
70
80
20
30
40
50
60
70
80
90
100
氯化铵
溶解度/g
硫酸钠
温度/℃
硫酸铵
混合
溶解
蒸发
浓缩
趁热
过滤
Na2SO4晶体
滤液
冷却
结晶
过滤
滤液
NH4Cl
洗涤
干燥
NH4Cl产品
氯化钠
(1)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为____。
(2)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________。
33~40℃
重结晶
第二节 有机化合物的结构特点
第一章 有机化合物的结构特点与研究方法
第一课时
有机化合物的分离、提纯
科学 社会 技术 P21
青蒿素的提取:葛洪《肘后备急方》 “青蒿一握,以水升渍,绞取汁,尽服之。”
20世纪70年代初,我国屠喲呦等科学家使用乙醚从中药中提取并用柱色谱分离得到抗疟有效成分青蒿素,随后展开了对青蒿素分子结构的测定和相关医学研究。国科学院上海有机化学研究所和中国中中医研究院中
从上述信息,你能总结出研究有机化合物的一般方法吗?
药研究所等单位的科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。 经红外光谱和核磁共振谱分析,确定青嵩素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(一0一0一)。1975年底, 我国科学家通过X射线衍射最终测定了青蒿素的分子结构。
【情境引入】
主要步骤
分离、提纯
波谱分析
研究有机化合物的一般步骤
除杂质
元素分析
确定元素组成及比例
测定相对
分子质量
分子式
结构分析
结构式
确定实验式
确定分子式
确定分子结构
常用方法
蒸馏、萃取
重结晶等
实验目的
分离提纯原则:不增 不减 易分离 易恢复
有机化合物的分离、提纯
冷凝管
圆底烧瓶
牛角管
锥形瓶
温度计
(4)温度计水银球置于蒸馏烧瓶支管口处
(5)冷凝水下进上出
(3)投放沸石或瓷片(防暴沸)
(1)垫石棉网
(2)装液体积1/3—2/3
蒸馏—适用范围
适用条件
有机化合物的热稳定性较高
有机化合物与杂质的沸点相差较大
相互溶解的液体混合物
易氧化、易分解的有机物采用减压蒸馏
注意二者的区别
蒸馏时用直形冷凝管
萃取
液-液萃取
固-液萃取
利用待分离组分在两种互不相溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程
利用溶剂从固体物质中溶解出待分离组分的过程
有机化合物的分离、提纯
萃取剂的选择依据
(笔记)
常用萃取剂
乙醚、乙酸乙酯、二氯甲烷、苯、四氯化碳等
萃取剂和原溶剂互不相溶
溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
萃取剂与原溶液不反应
主要实验仪器:
分液漏斗
烧杯
铁架台
液-液萃取
主要实验步骤:
萃取
液-液萃取
有机化合物的分离、提纯
用CCl4萃取碘水中的碘单质
碘水
分液:将萃取后两种互不相溶的液体分开的操作
检漏:分液漏斗使用前需检漏(分液漏斗内液体不超过容积的2/3)
振荡、放气:双手托住分液漏斗,右手按住玻璃塞,平放用力振荡(振荡后注意放气)
静置分层:打开上端玻璃塞(有利于分层),静置(下端尖嘴部分紧靠烧杯内壁)
分液:密度大的液体从下面放出,密度相对小的液体从上面倒出(打开上方的玻璃塞)
重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度
不与被提纯物质发生化学反应
杂质在此溶剂中溶解度很小或者很大,易于除去
被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,高温时,溶解度大,低温时,溶解度小,冷却后易于结晶析出
利用被提纯物质与杂质在同一溶剂中的溶解度不同
适用范围
提纯固体有机化合物的常用方法
提纯原理
溶剂要求
有机化合物的分离、提纯
重结晶
【探究实验】重结晶法提纯苯甲酸
【问题】某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?
其结构可表示为
苯甲酸微溶于水,易溶于乙醇等有机溶剂
苯甲酸在水中的溶解度如下
温度 25℃ 50℃ 95℃
苯甲酸 0.34g 0.85g 6.8g
NaCl 36.0 37.0 39.1
有机化合物的分离、提纯
【探究实验】重结晶法提纯苯甲酸
【资料】
《教材》P14中【讨论】
(1)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(2)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
(3)如何检验提纯后的苯甲酸中氯化钠已经被除净?
加热:使苯甲酸溶解;趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出
加热溶解——搅拌,加速苯甲酸溶解 过滤——引流
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明已被除净
色谱法 P16
色谱法起源于20世纪初,1903年俄国植物学家米哈伊尔·茨维特用碳酸钙填充竖立的玻璃管,以石油醚洗脱植物色素的提取液,经过一段时间洗脱之后,植物色素在碳酸钙柱中实现分离,由一条色带分散为数条平行的色带,从而分离得到了三种色素。茨维特将这种分离、提纯有机物的方法命名为色谱法。
25年后德国化学家库恩再分离、提纯胡萝卜素异构体和维生素结构中,应用色谱法,获得了1938年诺贝尔化学奖。
此后,色谱法成为分离、提纯有机物必不可少的方法。并发展出了纸上色谱法、薄层色谱法、气相色谱法和液相色谱法等。
有机化合物的分离、提纯
本节小结
有机化合物的分离、提纯
1.下列实验中,所采取的分离方法与对应原理 都正确的是
选项 目的 分离方法 原理
A. 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B. 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C. 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D. 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
D
是利用二者在不同温度下溶解度变化差别很大,使用重结晶法。
×
【学习评价】
2.根据右图信息,下列实验的步骤是什么?
(1)提纯KNO3、NaCl (少量)混合物中KNO3
(2)提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中。
溶解,蒸发浓缩,冷却结晶,过滤得到KNO3晶体,杂质NaCl留在滤液中。
3.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
氯化铵和硫酸钠的溶解度随温度变化图
20
30
40
50
60
70
80
20
30
40
50
60
70
80
90
100
氯化铵
溶解度/g
硫酸钠
温度/℃
硫酸铵
混合
溶解
蒸发
浓缩
趁热
过滤
Na2SO4晶体
滤液
冷却
结晶
过滤
滤液
NH4Cl
洗涤
干燥
NH4Cl产品
氯化钠
(1)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为____。
(2)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________。
33~40℃
重结晶
