5.1 硫及其化合物 第三课时 课件(共16张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1 硫及其化合物 第三课时 课件(共16张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 30.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 09:05:12 | ||
图片预览






文档简介
(共16张PPT)
高中化学必修第二册
第1节 硫及其化合物
第五章化工生产中的重要非金属元素
(3)硫酸根离子的检验
(3)硫酸根离子的检验
学习目标
1、了解硫酸根离子的检验。
2、通过思考讨论粗盐提纯流程以及注意事项。
新课导入
在上节课中,我们学习了硫酸方面知识,在溶液中,硫酸或硫酸盐会电离出SO42-。这一节课,我们学习一下SO42-的检验
上学期我们在学习氯的相关知识中,氯离子是怎么检验的呢?
1.硫酸根离子的检验
⒈硫酸根离子的检验
【实验5-4】
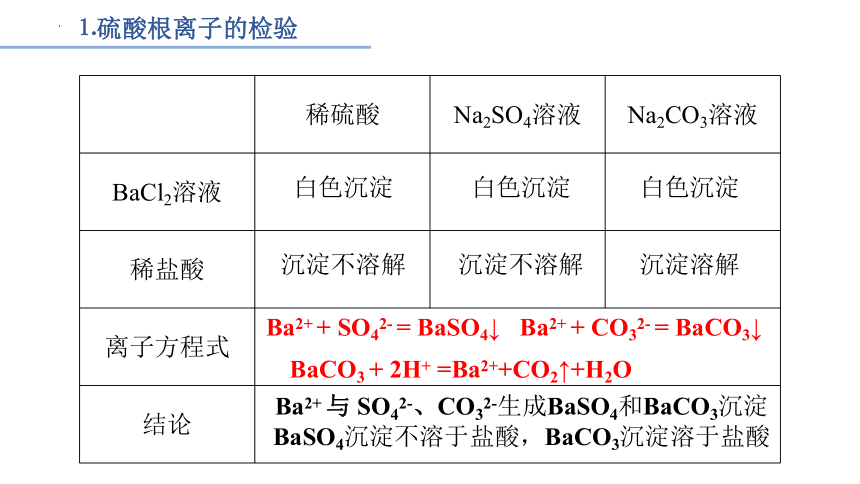
在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。从这个实验中你能够得出什么结论?写出相关反应的离子方程式。
⒈硫酸根离子的检验
稀硫酸 Na2SO4溶液 Na2CO3溶液
BaCl2溶液
稀盐酸
离子方程式 结论 白色沉淀
白色沉淀
白色沉淀
沉淀不溶解
沉淀不溶解
沉淀溶解
Ba2+ + SO42- = BaSO4↓
Ba2+ + CO32- = BaCO3↓
BaCO3 + 2H+ =Ba2++CO2↑+H2O
Ba2+ 与 SO42-、CO32-生成BaSO4和BaCO3沉淀
BaSO4沉淀不溶于盐酸,BaCO3沉淀溶于盐酸
⒈硫酸根离子的检验
检验SO42- 的正确操作方法:
①原理:Ba2+ + SO42- = BaSO4 ↓
②流程
③步骤
取少量待测液于试管中,先加入足量稀盐酸酸化,再加入BaCl2 溶液,若有白色沉淀生成,证明待测液中有SO42-
加入盐酸酸化的BaCl2 溶液
⒈硫酸根离子的检验
④注意
滴加稀盐酸——排除CO32-、SO32-、Ag+ 等干扰,
不能用HNO3酸化,因其具有强氧化性,
不能用Ba(NO3)2溶液,被氧化,
不能写加入盐酸酸化的BaCl2 溶液。
2.粗盐的提纯
⒉粗盐的提纯
粗盐
细盐
现在我们用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?
⒉粗盐的提纯
(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐及MgCl2、CaCl2等杂质。如果按照下表所示顺序除去他们,应加入什么实际?写出相关反应的离子方程式(可以参考附录II)
思考与讨论
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
⒉粗盐的提纯
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Na2CO3
Ca2++CO32-=CaCO3↓
Mg2++2OH-=Mg(OH)2↓
Ba2++SO42-=BaCO3↓
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法可以除去这些离子?
引入了OH-和CO32-,加入盐酸除去。
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
考虑试剂用量及加入顺序
NaOH——BaCl2——Na2CO3——HCl
或BaCl2 ——NaOH——Na2CO3—— HCl
或BaCl2 ——Na2CO3——NaOH—— HCl
注意:Na2CO3必须在BaCl2之后,
盐酸必须在Na2CO3和NaOH之后
⒉粗盐的提纯
拓展:物质除杂提纯的原则
①不增——不增加新的杂质
②不减——不减少被提纯的物质
③易分离——被提纯的物质容易分离
④易复原——被提纯的物质容易复原
高中化学必修第二册
第1节 硫及其化合物
第五章化工生产中的重要非金属元素
(3)硫酸根离子的检验
(3)硫酸根离子的检验
学习目标
1、了解硫酸根离子的检验。
2、通过思考讨论粗盐提纯流程以及注意事项。
新课导入
在上节课中,我们学习了硫酸方面知识,在溶液中,硫酸或硫酸盐会电离出SO42-。这一节课,我们学习一下SO42-的检验
上学期我们在学习氯的相关知识中,氯离子是怎么检验的呢?
1.硫酸根离子的检验
⒈硫酸根离子的检验
【实验5-4】
在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。从这个实验中你能够得出什么结论?写出相关反应的离子方程式。
⒈硫酸根离子的检验
稀硫酸 Na2SO4溶液 Na2CO3溶液
BaCl2溶液
稀盐酸
离子方程式 结论 白色沉淀
白色沉淀
白色沉淀
沉淀不溶解
沉淀不溶解
沉淀溶解
Ba2+ + SO42- = BaSO4↓
Ba2+ + CO32- = BaCO3↓
BaCO3 + 2H+ =Ba2++CO2↑+H2O
Ba2+ 与 SO42-、CO32-生成BaSO4和BaCO3沉淀
BaSO4沉淀不溶于盐酸,BaCO3沉淀溶于盐酸
⒈硫酸根离子的检验
检验SO42- 的正确操作方法:
①原理:Ba2+ + SO42- = BaSO4 ↓
②流程
③步骤
取少量待测液于试管中,先加入足量稀盐酸酸化,再加入BaCl2 溶液,若有白色沉淀生成,证明待测液中有SO42-
加入盐酸酸化的BaCl2 溶液
⒈硫酸根离子的检验
④注意
滴加稀盐酸——排除CO32-、SO32-、Ag+ 等干扰,
不能用HNO3酸化,因其具有强氧化性,
不能用Ba(NO3)2溶液,被氧化,
不能写加入盐酸酸化的BaCl2 溶液。
2.粗盐的提纯
⒉粗盐的提纯
粗盐
细盐
现在我们用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?
⒉粗盐的提纯
(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐及MgCl2、CaCl2等杂质。如果按照下表所示顺序除去他们,应加入什么实际?写出相关反应的离子方程式(可以参考附录II)
思考与讨论
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
⒉粗盐的提纯
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Na2CO3
Ca2++CO32-=CaCO3↓
Mg2++2OH-=Mg(OH)2↓
Ba2++SO42-=BaCO3↓
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法可以除去这些离子?
引入了OH-和CO32-,加入盐酸除去。
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
考虑试剂用量及加入顺序
NaOH——BaCl2——Na2CO3——HCl
或BaCl2 ——NaOH——Na2CO3—— HCl
或BaCl2 ——Na2CO3——NaOH—— HCl
注意:Na2CO3必须在BaCl2之后,
盐酸必须在Na2CO3和NaOH之后
⒉粗盐的提纯
拓展:物质除杂提纯的原则
①不增——不增加新的杂质
②不减——不减少被提纯的物质
③易分离——被提纯的物质容易分离
④易复原——被提纯的物质容易复原
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
