第三章第三节 金属晶体与离子晶体 (第1课时 ) 课件 (共35张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章第三节 金属晶体与离子晶体 (第1课时 ) 课件 (共35张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 09:11:28 | ||
图片预览







文档简介
(共35张PPT)
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
(第1课时)
河北冀州中学高二化学组
1.能辨识常见的金属晶体,能从微观的角度分析金属晶体中构成微粒及微粒间作用力,并解释金属的物理性质
2.能辨识常见的离子晶体,能从微观角度理解离子键对晶体性质的影响,能从宏观角度解释离子晶体的差异
3.通过对离子晶体模型的认识,理解离子晶体的结构特点,预测其性质
生活中的金属
具有金属光泽
导电性
导热性
延展性等
金属有哪些物理性质
为什么?
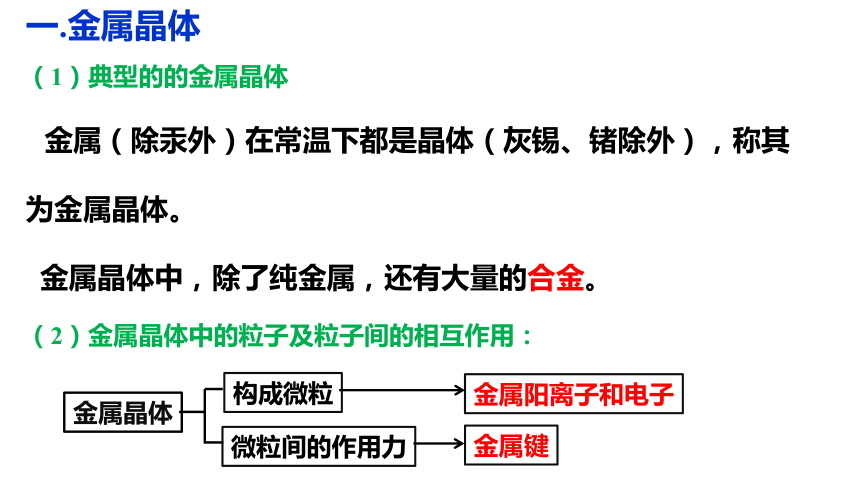
一.金属晶体
(1)典型的的金属晶体
金属(除汞外)在常温下都是晶体(灰锡、锗除外),称其为金属晶体。
金属晶体中,除了纯金属,还有大量的合金。
(2)金属晶体中的粒子及粒子间的相互作用:
金属阳离子和电子
金属键
构成微粒
金属晶体
微粒间的作用力
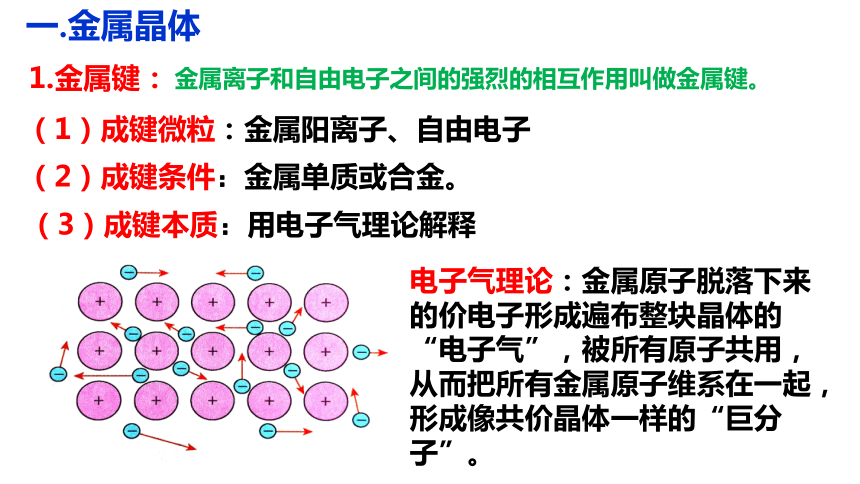
1.金属键:
金属离子和自由电子之间的强烈的相互作用叫做金属键。
(1)成键微粒:金属阳离子、自由电子
(2)成键条件:金属单质或合金。
(3)成键本质:用电子气理论解释
一.金属晶体
电子气理论:金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有金属原子维系在一起,形成像共价晶体一样的“巨分子”。
①自由电子不是专属于某个特定的金属阳离子,而是在整块固态金属中自由移动。
③金属键既没有方向性,也没有饱和性,是金属阳离子和自由电子之间存在的强烈的静电作用。
②金属键的成键粒子是金属阳离子和自由电子。
④金属晶体与共价晶体一样是一种“巨分子”。
一.金属晶体
(4)金属键的特征:
熔点较低,硬度较小
钨是熔点最高的金属
铬是硬度最大的金属
形成的金属键强弱不同!
【思考讨论】下列金属性质出现的原因?
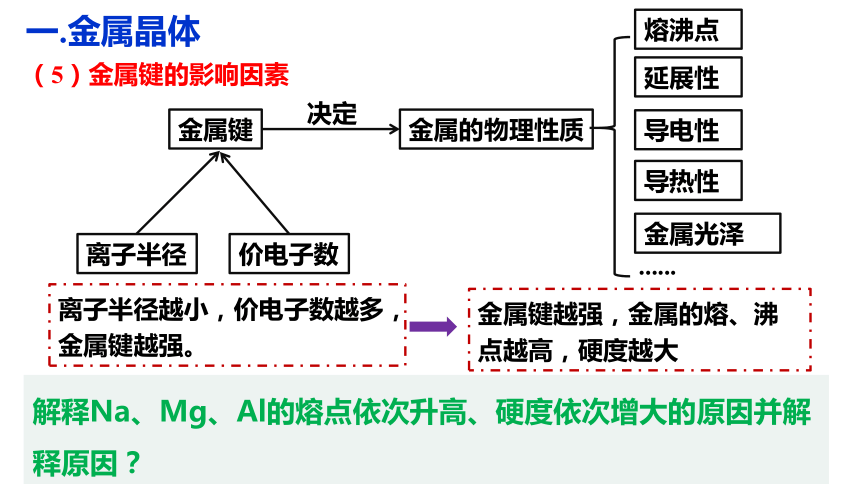
(5)金属键的影响因素
离子半径
价电子数
金属键
金属的物理性质
决定
延展性
导电性
导热性
金属光泽
......
熔沸点
离子半径越小,价电子数越多,
金属键越强。
金属键越强,金属的熔、沸点越高,硬度越大
一.金属晶体
解释Na、Mg、Al的熔点依次升高、硬度依次增大的原因并解释原因?
(1)金属或合金的延展性很好:
外力
在金属离子间的电子可以起到类似轴承中滚珠的润滑剂作用。
当金属晶体受外力作用时,晶体中各原子层就会发生相对滑动。
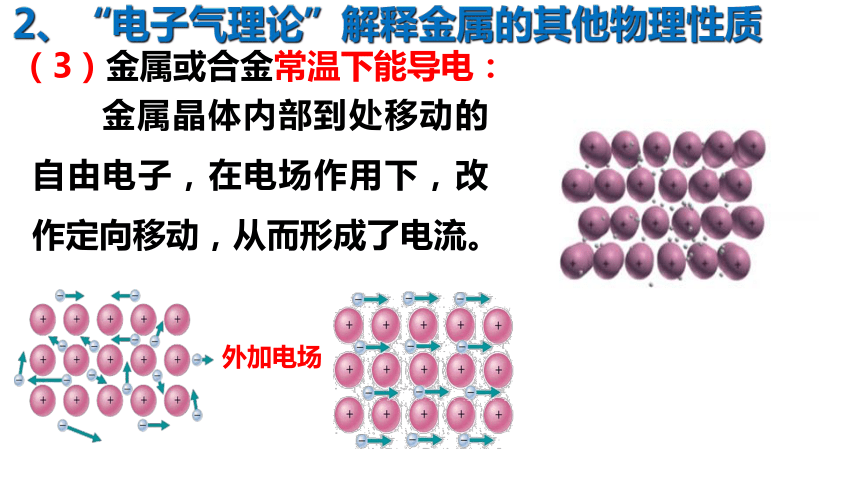
2、“电子气理论”解释金属的其他物理性质
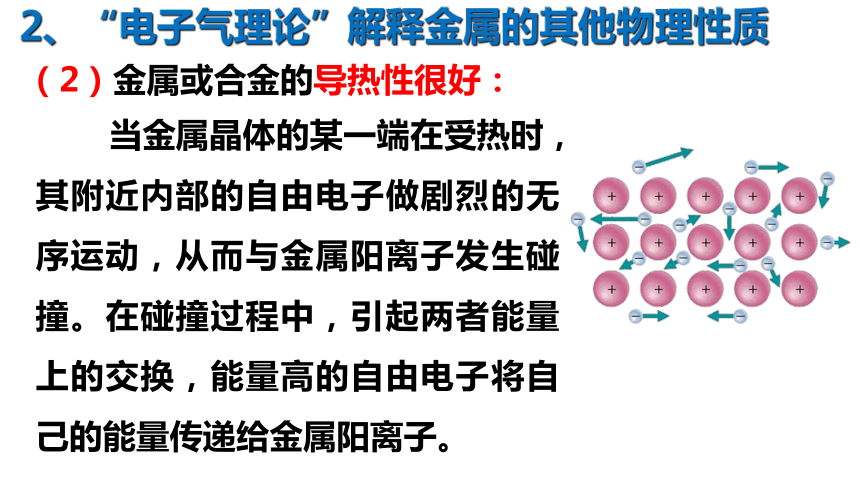
(2)金属或合金的导热性很好:
当金属晶体的某一端在受热时,其附近内部的自由电子做剧烈的无序运动,从而与金属阳离子发生碰撞。在碰撞过程中,引起两者能量上的交换,能量高的自由电子将自己的能量传递给金属阳离子。
2、“电子气理论”解释金属的其他物理性质
金属晶体内部到处移动的自由电子,在电场作用下,改作定向移动,从而形成了电流。
外加电场
(3)金属或合金常温下能导电:
2、“电子气理论”解释金属的其他物理性质
(4)金属大都有特殊的金属光泽:
由于金属内部原子以最紧密堆积状态排列,且存在自由电子,所以当光线照射到金属表面时,自由电子可以吸收所有频率的光并很快放出,使金属不透明且具有金属光泽。
2、“电子气理论”解释金属的其他物理性质
1.正误判断
(1)金属在常温下都是晶体( )
(2)金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用( )
(3)金属晶体在外力作用下,各层之间发生相对滑动,金属键被破坏( )
(4)共价晶体的熔点一定比金属晶体的高,分子晶体的熔点一定比金属晶体的低( )
(5)金属晶体除了纯金属,还有大量的合金( )
(6)有机高分子化合物一定不能导电( )
(7)金属的电导率随温度的升高而降低( )
×
×
×
×
√
×
√
【课堂练习】
2.下列关于金属及金属键的说法正确的是( )
A.金属键具有方向性和饱和性
B.金属键是金属阳离子与自由电子之间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属具有光泽是因为金属阳离子吸收并放出可见光
B
【课堂练习】
3.金属晶体的下列性质中,不能用金属晶体结构加以解释的是( )
A.易导电 B.易导热
C.有延展性 D.易锈蚀
D
【课堂练习】
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
【情景导入】
思考分析:上述物质类型,构成粒子分别是什么?
1.离子晶体
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体。
2.离子晶体中的粒子及粒子间的相互作用:
阳离子和阴离子
离子键
构成微粒
离子晶体
微粒间的作用力
二、离子晶体
3.离子键
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
特征:离子键没有方向性和饱和性。
影响因素:一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强。
二、离子晶体
静电引力和斥力
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
对比观察
①揉捏食盐晶体,你的感受?
②盐焗时,发现食盐都未熔融,说明了什么?
【实践活动】
【归纳】4.离子晶体的性质
熔沸点较高,难挥发,
硬度较大,难压缩,
水溶液或者熔融状态下导电。
离子晶体的熔点是否都较高?分析下表中的数据,能得出什么结论?
【对比分析】
离子晶体的熔点差异也较大,与离子键强弱有关
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。
化合物 熔点/℃
NH4NO3 169.6
Ca(H2PO4)2 109
CH3COOCs 194
C2H5NH3NO3 12
有些离子组成的物质在常温下甚至以液态形式存在。
CuSO4 · 5H2O
离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点
KAl (SO4 )2· 12H2O
有的还存在电中性分子( H2O、NH3等)。例如硫酸铜晶体、明矾中还存在共价键、氢键等。
【知识拓展】课本87-88页
硝酸乙基铵
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
5.常见离子晶体的结构类型
NaCl晶体结构模型
(1)NaCl晶体
1.根据小球大小判断哪种代表Na+,Cl-
2. 在NaCl晶体的一个晶胞中,Cl-的个数等于 ,Na+的个数等于 。
3. Na+ 数目与Cl-数目之比为 。
4
4
1:1
5.常见的几种离子晶体
二、离子晶体
4、与Na+ 等距离且最近的Cl- 有:
与Cl- 等距离且最近的Na+ 有:
6个
6个
它们所围成的空间几何构型是___。
6.与一个钠离子相邻最近且距离相等的钠离子有 个;距离是 。(晶胞边长为a)
正八面体
12
4.每个Cs+周围吸引着几个Cl- 每个Cl-周围吸引着几个Cs+
5、这几个Cs+(或Cl-)在空间构成的几何构型为 ;
6、在每个Cs+周围与它最近的且距离相等的Cs+ 有 个.
氯化铯晶体结构
1.根据小球大小判断哪种代表Cs+ ,Cl-
2. 在CsCl晶体的一个晶胞中,Cl-的
个数等于 , Cs+的个数等于 。
3. Cs+数目与Cl-数目之比为 。
1
1
1:1
立方体
6
5.常见的几种离子晶体
二、离子晶体
8
(2)CsCl晶体
①1个CaF2晶胞中含 个Ca2+和 个F-。
②每个Ca2+周围最近且等距离的F-有 个,每个F-周围最近且等距离的Ca2+有 个;Ca2+和F-的配位数分别为 、 。
③在每个Ca2+周围最近且等距离的Ca2+有 个,在每个F-周围最近等距离的F-有 个。
4
8
8
4
8
4
12
6
5.常见的几种离子晶体
二、离子晶体
(3)CaF2晶体
5.常见的几种离子晶体
二、离子晶体
离子晶体 金属晶体 共价晶体 分子晶体
存在微粒
微粒间作用
主要性质
实例
晶体小结:阅读同步训练57页
阴阳离子 金属离子、自由电子 原子 分子
离子键 金属键 共价键 分子间作用力
硬而脆,易溶于极性溶剂,熔化时能够导电,溶沸点高 金属光泽,是电和热的良导体,熔沸点高或低 质地硬,不溶于大多数溶剂,导电性差,熔沸点很高 硬度小,水溶液能够导电,溶沸点低
食盐晶体 镁、铝 金刚石 NH3、HCl
离子晶体的判断方法:
(1)依据构成晶体的微粒和微粒间的作用力判断。
(2)依据物质类别判断。活泼金属氧化物、强碱和绝大多数盐是离子晶体。
(3)依据导电性判断。离子晶体溶于水和熔融状态下均导电。
(4)依据熔、沸点和溶解性判断。离子晶体熔、沸点较高,多数能溶于水,难溶于有机溶剂。
5、离子晶体的判断方法 【归纳总结】
【归纳总结】
①不同类晶体熔、沸点比较思路:
首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),结构类型相同时再根据相应规律进行判断。
6、比较晶体熔、沸点的基本思路
②同类晶体熔、沸点比较思路:
共价晶体→共价键键能→键长→原子半径;
分子晶体→分子间作用力→氢键及相对分子质量;
离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
【归纳总结】
1.下列实验事实中不能确定该物质一定是离子晶体的有哪些?说明理由。
(1)晶体熔点达2 500 ℃
(2)晶体不导电,溶于水导电
(3)晶体不导电,熔融能导电
【课堂练习】
2.下列说法错误的是( )
A.离子晶体在熔化状态下能导电
B.在晶体中只要有阴离子就一定有阳离子
C.共价晶体中一定有非极性共价键
D.分子晶体中不一定含有共价键
C
【课堂练习】
3.下列关于离子晶体的性质的叙述正确的是( )
A.熔、沸点较高,难挥发
B.硬度很小,容易变形
C.都能溶于有机溶剂而难溶于水
D.密度很小
A
【课堂练习】
4.下列关于CaF2的表述正确的是( )
A.Ca2+与F-间仅存在静电吸引作用
B.F-的离子半径小于Cl-的离子半径,则CaF2的熔点低于CaCl2的熔点
C.阴、阳离子比为2∶1的物质,均与CaF2晶体构型相同
D.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
化学
【课堂练习】
D
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
(第1课时)
河北冀州中学高二化学组
1.能辨识常见的金属晶体,能从微观的角度分析金属晶体中构成微粒及微粒间作用力,并解释金属的物理性质
2.能辨识常见的离子晶体,能从微观角度理解离子键对晶体性质的影响,能从宏观角度解释离子晶体的差异
3.通过对离子晶体模型的认识,理解离子晶体的结构特点,预测其性质
生活中的金属
具有金属光泽
导电性
导热性
延展性等
金属有哪些物理性质
为什么?
一.金属晶体
(1)典型的的金属晶体
金属(除汞外)在常温下都是晶体(灰锡、锗除外),称其为金属晶体。
金属晶体中,除了纯金属,还有大量的合金。
(2)金属晶体中的粒子及粒子间的相互作用:
金属阳离子和电子
金属键
构成微粒
金属晶体
微粒间的作用力
1.金属键:
金属离子和自由电子之间的强烈的相互作用叫做金属键。
(1)成键微粒:金属阳离子、自由电子
(2)成键条件:金属单质或合金。
(3)成键本质:用电子气理论解释
一.金属晶体
电子气理论:金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有金属原子维系在一起,形成像共价晶体一样的“巨分子”。
①自由电子不是专属于某个特定的金属阳离子,而是在整块固态金属中自由移动。
③金属键既没有方向性,也没有饱和性,是金属阳离子和自由电子之间存在的强烈的静电作用。
②金属键的成键粒子是金属阳离子和自由电子。
④金属晶体与共价晶体一样是一种“巨分子”。
一.金属晶体
(4)金属键的特征:
熔点较低,硬度较小
钨是熔点最高的金属
铬是硬度最大的金属
形成的金属键强弱不同!
【思考讨论】下列金属性质出现的原因?
(5)金属键的影响因素
离子半径
价电子数
金属键
金属的物理性质
决定
延展性
导电性
导热性
金属光泽
......
熔沸点
离子半径越小,价电子数越多,
金属键越强。
金属键越强,金属的熔、沸点越高,硬度越大
一.金属晶体
解释Na、Mg、Al的熔点依次升高、硬度依次增大的原因并解释原因?
(1)金属或合金的延展性很好:
外力
在金属离子间的电子可以起到类似轴承中滚珠的润滑剂作用。
当金属晶体受外力作用时,晶体中各原子层就会发生相对滑动。
2、“电子气理论”解释金属的其他物理性质
(2)金属或合金的导热性很好:
当金属晶体的某一端在受热时,其附近内部的自由电子做剧烈的无序运动,从而与金属阳离子发生碰撞。在碰撞过程中,引起两者能量上的交换,能量高的自由电子将自己的能量传递给金属阳离子。
2、“电子气理论”解释金属的其他物理性质
金属晶体内部到处移动的自由电子,在电场作用下,改作定向移动,从而形成了电流。
外加电场
(3)金属或合金常温下能导电:
2、“电子气理论”解释金属的其他物理性质
(4)金属大都有特殊的金属光泽:
由于金属内部原子以最紧密堆积状态排列,且存在自由电子,所以当光线照射到金属表面时,自由电子可以吸收所有频率的光并很快放出,使金属不透明且具有金属光泽。
2、“电子气理论”解释金属的其他物理性质
1.正误判断
(1)金属在常温下都是晶体( )
(2)金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用( )
(3)金属晶体在外力作用下,各层之间发生相对滑动,金属键被破坏( )
(4)共价晶体的熔点一定比金属晶体的高,分子晶体的熔点一定比金属晶体的低( )
(5)金属晶体除了纯金属,还有大量的合金( )
(6)有机高分子化合物一定不能导电( )
(7)金属的电导率随温度的升高而降低( )
×
×
×
×
√
×
√
【课堂练习】
2.下列关于金属及金属键的说法正确的是( )
A.金属键具有方向性和饱和性
B.金属键是金属阳离子与自由电子之间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属具有光泽是因为金属阳离子吸收并放出可见光
B
【课堂练习】
3.金属晶体的下列性质中,不能用金属晶体结构加以解释的是( )
A.易导电 B.易导热
C.有延展性 D.易锈蚀
D
【课堂练习】
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
【情景导入】
思考分析:上述物质类型,构成粒子分别是什么?
1.离子晶体
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体。
2.离子晶体中的粒子及粒子间的相互作用:
阳离子和阴离子
离子键
构成微粒
离子晶体
微粒间的作用力
二、离子晶体
3.离子键
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
特征:离子键没有方向性和饱和性。
影响因素:一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强。
二、离子晶体
静电引力和斥力
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
对比观察
①揉捏食盐晶体,你的感受?
②盐焗时,发现食盐都未熔融,说明了什么?
【实践活动】
【归纳】4.离子晶体的性质
熔沸点较高,难挥发,
硬度较大,难压缩,
水溶液或者熔融状态下导电。
离子晶体的熔点是否都较高?分析下表中的数据,能得出什么结论?
【对比分析】
离子晶体的熔点差异也较大,与离子键强弱有关
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。
化合物 熔点/℃
NH4NO3 169.6
Ca(H2PO4)2 109
CH3COOCs 194
C2H5NH3NO3 12
有些离子组成的物质在常温下甚至以液态形式存在。
CuSO4 · 5H2O
离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点
KAl (SO4 )2· 12H2O
有的还存在电中性分子( H2O、NH3等)。例如硫酸铜晶体、明矾中还存在共价键、氢键等。
【知识拓展】课本87-88页
硝酸乙基铵
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
5.常见离子晶体的结构类型
NaCl晶体结构模型
(1)NaCl晶体
1.根据小球大小判断哪种代表Na+,Cl-
2. 在NaCl晶体的一个晶胞中,Cl-的个数等于 ,Na+的个数等于 。
3. Na+ 数目与Cl-数目之比为 。
4
4
1:1
5.常见的几种离子晶体
二、离子晶体
4、与Na+ 等距离且最近的Cl- 有:
与Cl- 等距离且最近的Na+ 有:
6个
6个
它们所围成的空间几何构型是___。
6.与一个钠离子相邻最近且距离相等的钠离子有 个;距离是 。(晶胞边长为a)
正八面体
12
4.每个Cs+周围吸引着几个Cl- 每个Cl-周围吸引着几个Cs+
5、这几个Cs+(或Cl-)在空间构成的几何构型为 ;
6、在每个Cs+周围与它最近的且距离相等的Cs+ 有 个.
氯化铯晶体结构
1.根据小球大小判断哪种代表Cs+ ,Cl-
2. 在CsCl晶体的一个晶胞中,Cl-的
个数等于 , Cs+的个数等于 。
3. Cs+数目与Cl-数目之比为 。
1
1
1:1
立方体
6
5.常见的几种离子晶体
二、离子晶体
8
(2)CsCl晶体
①1个CaF2晶胞中含 个Ca2+和 个F-。
②每个Ca2+周围最近且等距离的F-有 个,每个F-周围最近且等距离的Ca2+有 个;Ca2+和F-的配位数分别为 、 。
③在每个Ca2+周围最近且等距离的Ca2+有 个,在每个F-周围最近等距离的F-有 个。
4
8
8
4
8
4
12
6
5.常见的几种离子晶体
二、离子晶体
(3)CaF2晶体
5.常见的几种离子晶体
二、离子晶体
离子晶体 金属晶体 共价晶体 分子晶体
存在微粒
微粒间作用
主要性质
实例
晶体小结:阅读同步训练57页
阴阳离子 金属离子、自由电子 原子 分子
离子键 金属键 共价键 分子间作用力
硬而脆,易溶于极性溶剂,熔化时能够导电,溶沸点高 金属光泽,是电和热的良导体,熔沸点高或低 质地硬,不溶于大多数溶剂,导电性差,熔沸点很高 硬度小,水溶液能够导电,溶沸点低
食盐晶体 镁、铝 金刚石 NH3、HCl
离子晶体的判断方法:
(1)依据构成晶体的微粒和微粒间的作用力判断。
(2)依据物质类别判断。活泼金属氧化物、强碱和绝大多数盐是离子晶体。
(3)依据导电性判断。离子晶体溶于水和熔融状态下均导电。
(4)依据熔、沸点和溶解性判断。离子晶体熔、沸点较高,多数能溶于水,难溶于有机溶剂。
5、离子晶体的判断方法 【归纳总结】
【归纳总结】
①不同类晶体熔、沸点比较思路:
首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),结构类型相同时再根据相应规律进行判断。
6、比较晶体熔、沸点的基本思路
②同类晶体熔、沸点比较思路:
共价晶体→共价键键能→键长→原子半径;
分子晶体→分子间作用力→氢键及相对分子质量;
离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
【归纳总结】
1.下列实验事实中不能确定该物质一定是离子晶体的有哪些?说明理由。
(1)晶体熔点达2 500 ℃
(2)晶体不导电,溶于水导电
(3)晶体不导电,熔融能导电
【课堂练习】
2.下列说法错误的是( )
A.离子晶体在熔化状态下能导电
B.在晶体中只要有阴离子就一定有阳离子
C.共价晶体中一定有非极性共价键
D.分子晶体中不一定含有共价键
C
【课堂练习】
3.下列关于离子晶体的性质的叙述正确的是( )
A.熔、沸点较高,难挥发
B.硬度很小,容易变形
C.都能溶于有机溶剂而难溶于水
D.密度很小
A
【课堂练习】
4.下列关于CaF2的表述正确的是( )
A.Ca2+与F-间仅存在静电吸引作用
B.F-的离子半径小于Cl-的离子半径,则CaF2的熔点低于CaCl2的熔点
C.阴、阳离子比为2∶1的物质,均与CaF2晶体构型相同
D.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
化学
【课堂练习】
D
