1.2.3元素周期律(电负性)课件(共14张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.2.3元素周期律(电负性)课件(共14张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |
|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-01 00:00:00 | ||
图片预览


文档简介
(共14张PPT)
第一章 原子结构与性质
第二节 原子结构与元素性质
2、元素周期律(电负性)
阅读总结
化学键:
元素相互化合,相邻的原子之间产生的强烈的化学作用力,形象地叫做化学键。
键合电子:
原子中用于形成化学键的电子称为键合电子
键合电子
②意义:电负性越大的原子,对键合电子的吸引力越大
①定义:描述不同元素的原子对键合电子吸引力的大小
电负性:
学习任务:探究电负性的递变规律
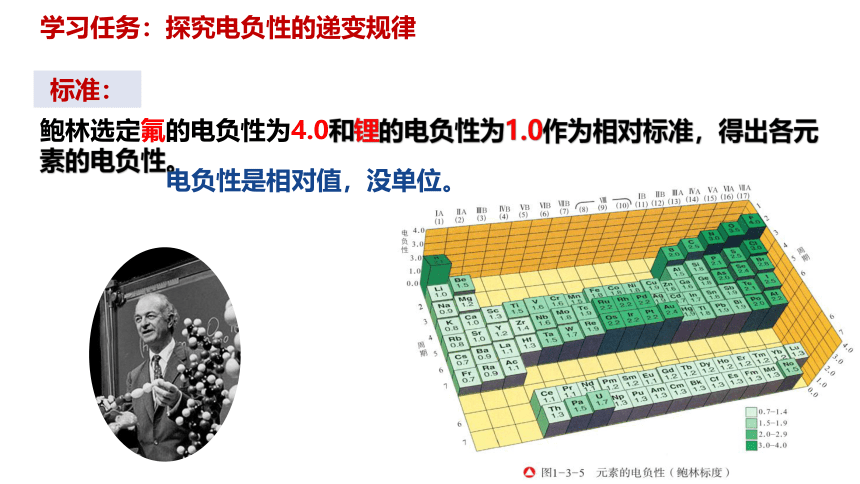
鲍林选定氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性。
电负性是相对值,没单位。
标准:
学习任务:探究电负性的递变规律
贰
TOW
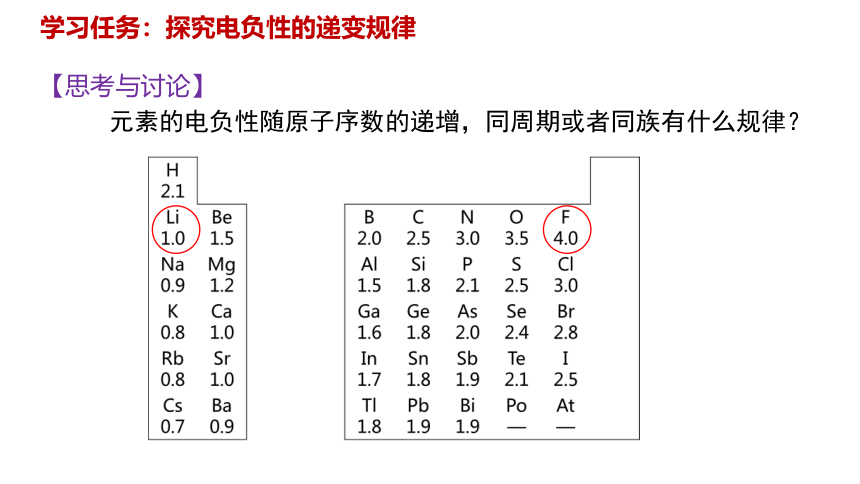
元素的电负性随原子序数的递增,同周期或者同族有什么规律?
【思考与讨论】
学习任务:探究电负性的递变规律
电负性的周期性变化
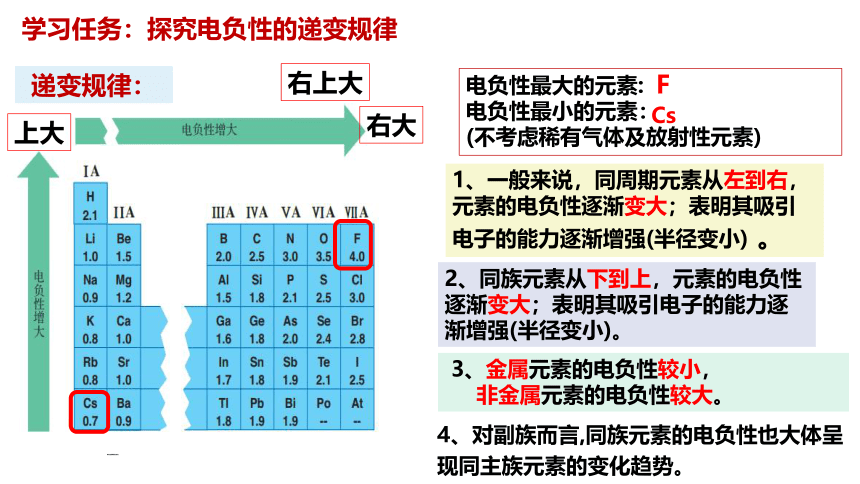
电负性最大的元素:
电负性最小的元素:
(不考虑稀有气体及放射性元素)
F
Cs
右上大
上大
右大
1、一般来说,同周期元素从左到右,元素的电负性逐渐变大;表明其吸引电子的能力逐渐增强(半径变小) 。
2、同族元素从下到上,元素的电负性逐渐变大;表明其吸引电子的能力逐渐增强(半径变小)。
3、金属元素的电负性较小,
非金属元素的电负性较大。
4、对副族而言,同族元素的电负性也大体呈现同主族元素的变化趋势。
递变规律:
学习任务:探究电负性的递变规律
电负性的应用:
H 2.1
Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0
Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0
K 0.9 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.5 Br 2.8
Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5
Cs 0.7 Ba 0.9 Ti 1.8 Pb 1.9 Bi 1.9
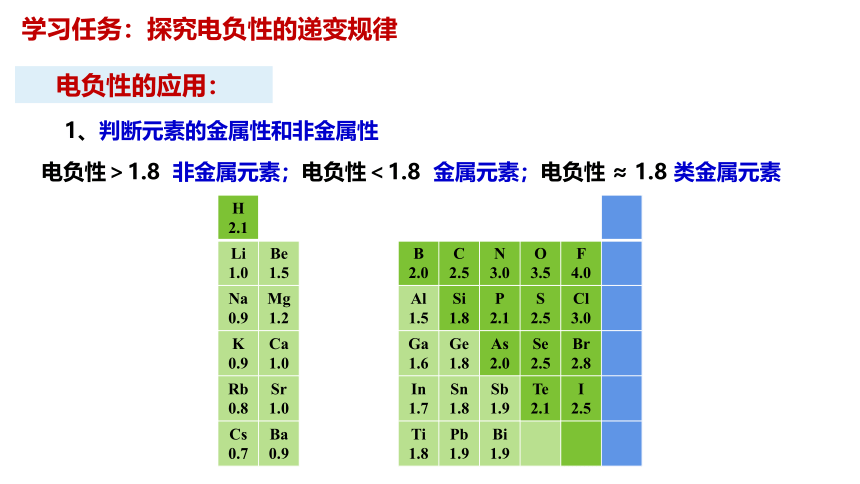
1、判断元素的金属性和非金属性
电负性>1.8 非金属元素;电负性<1.8 金属元素;电负性 ≈ 1.8 类金属元素
学习任务:探究电负性的递变规律
H 2.1
Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0
Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0
K 0.9 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.5 Br 2.8
Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5
Cs 0.7 Ba 0.9 Ti 1.8 Pb 1.9 Bi 1.9
2、判断化学键类型
两成键元素间电负性差值大于1.7,通常形成离子键
两成键元素间电负性差值小于1.7,通常形成共价键
电负性 0.9 3.0
电负性差 2.1
离子化合物
电负性 2.1 3.0
电负性差 0.9
共价化合物
学习任务:探究电负性的递变规律
H 2.1
Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0
Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0
K 0.9 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.5 Br 2.8
Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5
Cs 0.7 Ba 0.9 Ti 1.8 Pb 1.9 Bi 1.9
H
C
H
H
H
H
Si
H
H
H
CH4
SiH4
-4 +1
+4 -1
3、判断元素化合价的正负
学习任务:探究电负性的递变规律
利用图1-23的数据制作第三周期主族元素、第ⅠA和ⅦA族元素的电负性变化图,并找出其变化趋势。
同周期主族元素:
同主族元素:
从左至右电负性逐渐变大
从上至下电负性逐渐变小
【探究】课本P26
电负性
金属性
应用
金属性/非金属性
元素类型
电负性
不同元素的原子对吸引键合电子能力的大小
电负性呈现周期性的递变
非金属性
化学键类型
化合价
H
F
键合电子
总结
评价任务
1.正误判断
(1)一般认为元素的电负性小于1.8的为金属元素,大于1.8的为非金属元素
( )
(2)元素电负性的大小反映了元素原子对键合电子吸引力的大小( )
(3)同一周期电负性最大的元素为稀有气体元素( )
(4)元素的电负性越大,则元素的非金属性越强( )
√
√
×
√
2.电负性越大的元素,非金属性越强吗?第一电离能越大吗?
元素的电负性越大,非金属性越强;但第一电离能不一定越大,例如电负性:N<O,而第一电离能:N>O。
评价任务
3.下列各组元素按电负性由大到小排列正确的是
A.F>N>O B.O>Cl>F
C.As>P>N D.Cl>S>As
√
4.下列元素的原子间最容易形成离子键的是
A.Na和Cl B.S和O
C.Al和Br D.Mg和S
√
5.利用电负性的相关知识,回答下列问题。
(1)CH4和CO2所含的三种元素按电负性从大到小的顺序排列为________。
O>C>H
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为__________。
C>H>Si
评价任务
(3)溴与氯能以_______键结合形成BrCl。BrCl中Br的化合价为______。写出BrCl与水发生反应的化学方程式:_________________________。
共价
+1
BrCl+H2O===HCl+HBrO
同周期(从左至右) 同主族
元素原子的最外层电子排布 ns1→ns2np6 相同
元素化合价 +1→+7(O、F除外) -4 →-1 →0 相同
元素的金属性 非金属性 减弱 增强 增强
减弱
原子半径 减小 增大
电离能 增大趋势 减小
电负性 增大 减小趋势
复习回顾
第一章 原子结构与性质
第二节 原子结构与元素性质
2、元素周期律(电负性)
阅读总结
化学键:
元素相互化合,相邻的原子之间产生的强烈的化学作用力,形象地叫做化学键。
键合电子:
原子中用于形成化学键的电子称为键合电子
键合电子
②意义:电负性越大的原子,对键合电子的吸引力越大
①定义:描述不同元素的原子对键合电子吸引力的大小
电负性:
学习任务:探究电负性的递变规律
鲍林选定氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性。
电负性是相对值,没单位。
标准:
学习任务:探究电负性的递变规律
贰
TOW
元素的电负性随原子序数的递增,同周期或者同族有什么规律?
【思考与讨论】
学习任务:探究电负性的递变规律
电负性的周期性变化
电负性最大的元素:
电负性最小的元素:
(不考虑稀有气体及放射性元素)
F
Cs
右上大
上大
右大
1、一般来说,同周期元素从左到右,元素的电负性逐渐变大;表明其吸引电子的能力逐渐增强(半径变小) 。
2、同族元素从下到上,元素的电负性逐渐变大;表明其吸引电子的能力逐渐增强(半径变小)。
3、金属元素的电负性较小,
非金属元素的电负性较大。
4、对副族而言,同族元素的电负性也大体呈现同主族元素的变化趋势。
递变规律:
学习任务:探究电负性的递变规律
电负性的应用:
H 2.1
Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0
Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0
K 0.9 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.5 Br 2.8
Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5
Cs 0.7 Ba 0.9 Ti 1.8 Pb 1.9 Bi 1.9
1、判断元素的金属性和非金属性
电负性>1.8 非金属元素;电负性<1.8 金属元素;电负性 ≈ 1.8 类金属元素
学习任务:探究电负性的递变规律
H 2.1
Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0
Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0
K 0.9 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.5 Br 2.8
Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5
Cs 0.7 Ba 0.9 Ti 1.8 Pb 1.9 Bi 1.9
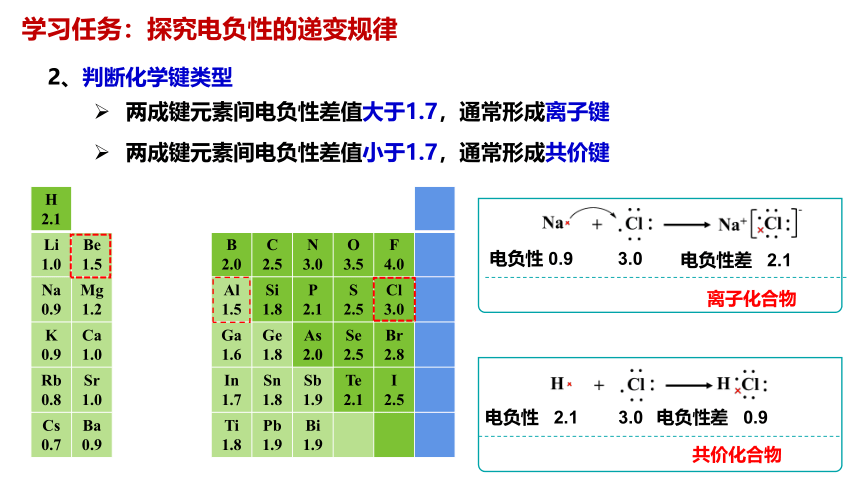
2、判断化学键类型
两成键元素间电负性差值大于1.7,通常形成离子键
两成键元素间电负性差值小于1.7,通常形成共价键
电负性 0.9 3.0
电负性差 2.1
离子化合物
电负性 2.1 3.0
电负性差 0.9
共价化合物
学习任务:探究电负性的递变规律
H 2.1
Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0
Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0
K 0.9 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.5 Br 2.8
Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5
Cs 0.7 Ba 0.9 Ti 1.8 Pb 1.9 Bi 1.9
H
C
H
H
H
H
Si
H
H
H
CH4
SiH4
-4 +1
+4 -1
3、判断元素化合价的正负
学习任务:探究电负性的递变规律
利用图1-23的数据制作第三周期主族元素、第ⅠA和ⅦA族元素的电负性变化图,并找出其变化趋势。
同周期主族元素:
同主族元素:
从左至右电负性逐渐变大
从上至下电负性逐渐变小
【探究】课本P26
电负性
金属性
应用
金属性/非金属性
元素类型
电负性
不同元素的原子对吸引键合电子能力的大小
电负性呈现周期性的递变
非金属性
化学键类型
化合价
H
F
键合电子
总结
评价任务
1.正误判断
(1)一般认为元素的电负性小于1.8的为金属元素,大于1.8的为非金属元素
( )
(2)元素电负性的大小反映了元素原子对键合电子吸引力的大小( )
(3)同一周期电负性最大的元素为稀有气体元素( )
(4)元素的电负性越大,则元素的非金属性越强( )
√
√
×
√
2.电负性越大的元素,非金属性越强吗?第一电离能越大吗?
元素的电负性越大,非金属性越强;但第一电离能不一定越大,例如电负性:N<O,而第一电离能:N>O。
评价任务
3.下列各组元素按电负性由大到小排列正确的是
A.F>N>O B.O>Cl>F
C.As>P>N D.Cl>S>As
√
4.下列元素的原子间最容易形成离子键的是
A.Na和Cl B.S和O
C.Al和Br D.Mg和S
√
5.利用电负性的相关知识,回答下列问题。
(1)CH4和CO2所含的三种元素按电负性从大到小的顺序排列为________。
O>C>H
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为__________。
C>H>Si
评价任务
(3)溴与氯能以_______键结合形成BrCl。BrCl中Br的化合价为______。写出BrCl与水发生反应的化学方程式:_________________________。
共价
+1
BrCl+H2O===HCl+HBrO
同周期(从左至右) 同主族
元素原子的最外层电子排布 ns1→ns2np6 相同
元素化合价 +1→+7(O、F除外) -4 →-1 →0 相同
元素的金属性 非金属性 减弱 增强 增强
减弱
原子半径 减小 增大
电离能 增大趋势 减小
电负性 增大 减小趋势
复习回顾
