第二章第二节第一课时氯气(共15张PPT)2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第二章第二节第一课时氯气(共15张PPT)2022-2023学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | zip | ||
| 文件大小 | 587.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-01 00:00:00 | ||
图片预览


文档简介
(共15张PPT)
氯及其化合物(第一课时)
学习目标
1、学生通过阅读教材,总结出氯气的物理性质以及用方程式描述出氯气常见化学性质。
2、本节重点探究氯气与水反应的实质、次氯酸的性质,能总结氯水成分、分析氯水的性质。
3、学生通过对氯气的学习,能够尝试解决实际问题,增强保护环境意识。
【模块一】
点燃
点燃
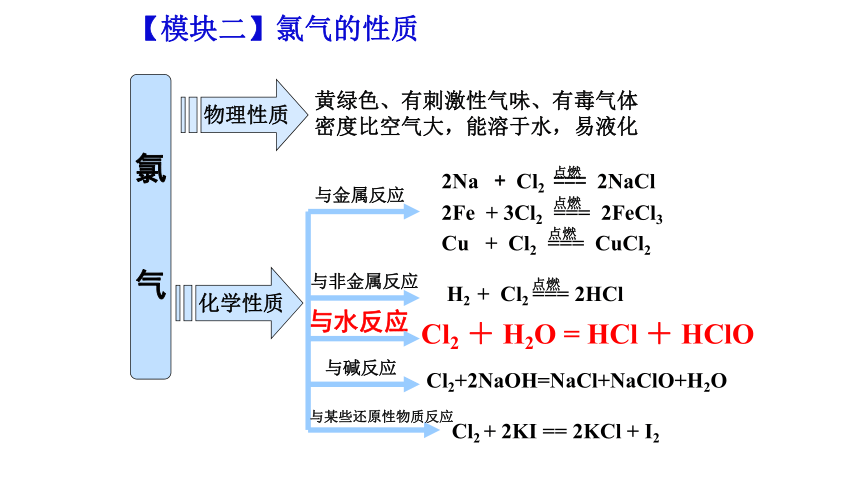
2Na + Cl2 === 2NaCl
2Fe + 3Cl2 === 2FeCl3
Cu + Cl2 === CuCl2
点燃
H2 + Cl2 === 2HCl
点燃
Cl2+2NaOH=NaCl+NaClO+H2O
氯
气
物理性质
化学性质
Cl2 + H2O = HCl + HClO
与碱反应
与水反应
与非金属反应
与金属反应
黄绿色、有刺激性气味、有毒气体
密度比空气大,能溶于水,易液化
与某些还原性物质反应
Cl2 + 2KI == 2KCl + I2
【模块二】氯气的性质
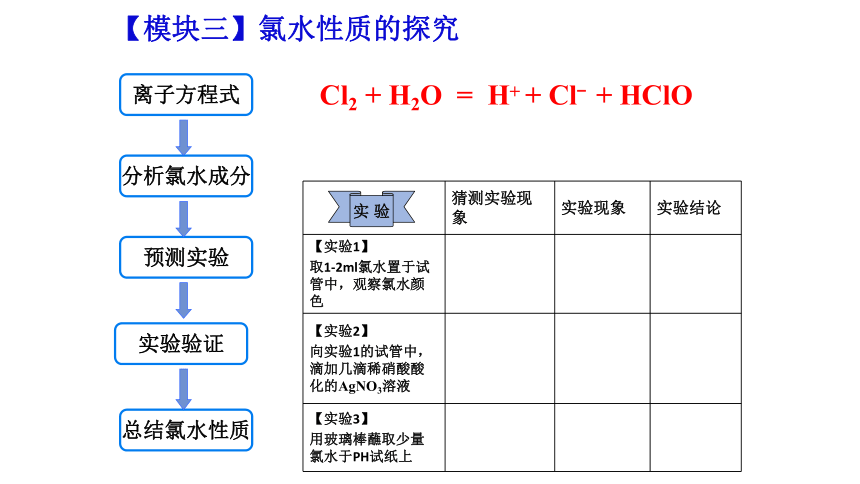
离子方程式
分析氯水成分
预测实验
实验验证
【模块三】氯水性质的探究
猜测实验现象 实验现象 实验结论
【实验1】
取1-2ml氯水置于试管中,观察氯水颜色
【实验2】
向实验1的试管中,滴加几滴稀硝酸酸化的AgNO3溶液
【实验3】
用玻璃棒蘸取少量氯水于PH试纸上
Cl2 + H2O = H+ + Cl- + HClO
总结氯水性质
实 验
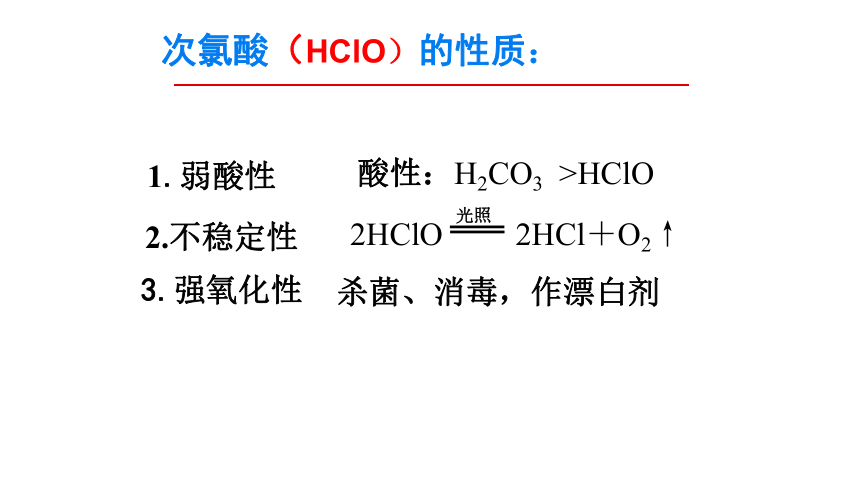
次氯酸(HClO)的性质:
3.强氧化性
1.弱酸性
2.不稳定性
光照
2HClO 2HCl+O2↑
杀菌、消毒,作漂白剂
酸性:H2CO3 >HClO
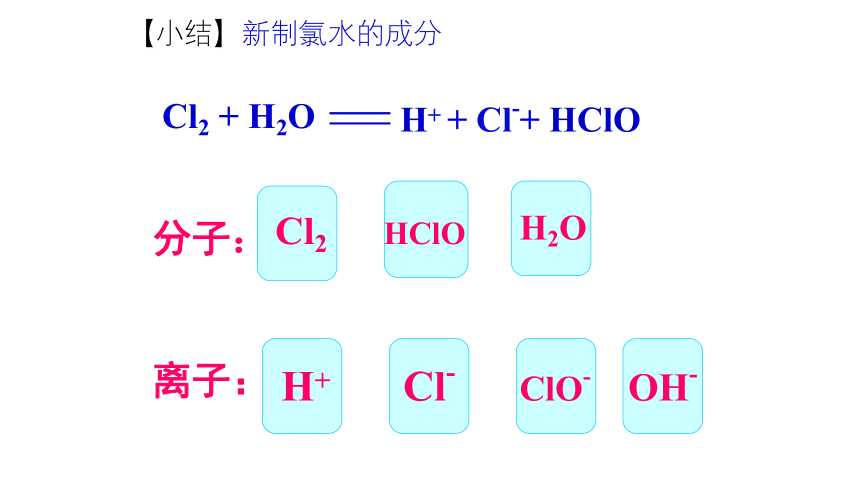
【小结】新制氯水的成分
分子:
离子:
OH-
ClO-
Cl-
H+
Cl2
HClO
H2O
Cl2 + H2O
H+ + Cl-+ HClO
游戏大比拼
现 象
小组在卡片中寻找能解释现象的微粒,
并迅速举起卡片,比比谁的反应速度快!
氯水呈浅黄绿色,
且有刺激性气味
加入NaHCO3粉末
有无色无味的气体产生
滴加紫色石蕊试液,
溶液先变红,后褪色
将氯水滴到含有酚酞的NaOH
溶液中,红色褪去
液氯 新制氯水 久制氯水
组成微粒
类别
(纯净物或混合物)
颜色
主要性质
【自主归纳】液氯、新制氯水、久置氯水的区别
液氯 新制氯水 久制氯水
组成微粒 Cl2 Cl2、HClO、H2O
Cl-、H+、ClO-、OH- H2O
Cl-、H+、OH-
类别
(纯净物或混合物) 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
主要性质 氧化性 氧化性、
酸性、漂白性 酸性
【自主归纳】液氯、新制氯水、久置氯水的区别
【模块四】拓展训练
如果发生氯气泄漏事件,之后发生局部爆炸造成了
严重的后果。假设当时你在氯气泄漏现场,你会怎
么办?
保护环境,保护我们的家园
氯及其化合物(第一课时)
学习目标
1、学生通过阅读教材,总结出氯气的物理性质以及用方程式描述出氯气常见化学性质。
2、本节重点探究氯气与水反应的实质、次氯酸的性质,能总结氯水成分、分析氯水的性质。
3、学生通过对氯气的学习,能够尝试解决实际问题,增强保护环境意识。
【模块一】
点燃
点燃
2Na + Cl2 === 2NaCl
2Fe + 3Cl2 === 2FeCl3
Cu + Cl2 === CuCl2
点燃
H2 + Cl2 === 2HCl
点燃
Cl2+2NaOH=NaCl+NaClO+H2O
氯
气
物理性质
化学性质
Cl2 + H2O = HCl + HClO
与碱反应
与水反应
与非金属反应
与金属反应
黄绿色、有刺激性气味、有毒气体
密度比空气大,能溶于水,易液化
与某些还原性物质反应
Cl2 + 2KI == 2KCl + I2
【模块二】氯气的性质
离子方程式
分析氯水成分
预测实验
实验验证
【模块三】氯水性质的探究
猜测实验现象 实验现象 实验结论
【实验1】
取1-2ml氯水置于试管中,观察氯水颜色
【实验2】
向实验1的试管中,滴加几滴稀硝酸酸化的AgNO3溶液
【实验3】
用玻璃棒蘸取少量氯水于PH试纸上
Cl2 + H2O = H+ + Cl- + HClO
总结氯水性质
实 验
次氯酸(HClO)的性质:
3.强氧化性
1.弱酸性
2.不稳定性
光照
2HClO 2HCl+O2↑
杀菌、消毒,作漂白剂
酸性:H2CO3 >HClO
【小结】新制氯水的成分
分子:
离子:
OH-
ClO-
Cl-
H+
Cl2
HClO
H2O
Cl2 + H2O
H+ + Cl-+ HClO
游戏大比拼
现 象
小组在卡片中寻找能解释现象的微粒,
并迅速举起卡片,比比谁的反应速度快!
氯水呈浅黄绿色,
且有刺激性气味
加入NaHCO3粉末
有无色无味的气体产生
滴加紫色石蕊试液,
溶液先变红,后褪色
将氯水滴到含有酚酞的NaOH
溶液中,红色褪去
液氯 新制氯水 久制氯水
组成微粒
类别
(纯净物或混合物)
颜色
主要性质
【自主归纳】液氯、新制氯水、久置氯水的区别
液氯 新制氯水 久制氯水
组成微粒 Cl2 Cl2、HClO、H2O
Cl-、H+、ClO-、OH- H2O
Cl-、H+、OH-
类别
(纯净物或混合物) 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
主要性质 氧化性 氧化性、
酸性、漂白性 酸性
【自主归纳】液氯、新制氯水、久置氯水的区别
【模块四】拓展训练
如果发生氯气泄漏事件,之后发生局部爆炸造成了
严重的后果。假设当时你在氯气泄漏现场,你会怎
么办?
保护环境,保护我们的家园
